物质的转化规律(有关炼铁的计算题)
图片预览





文档简介
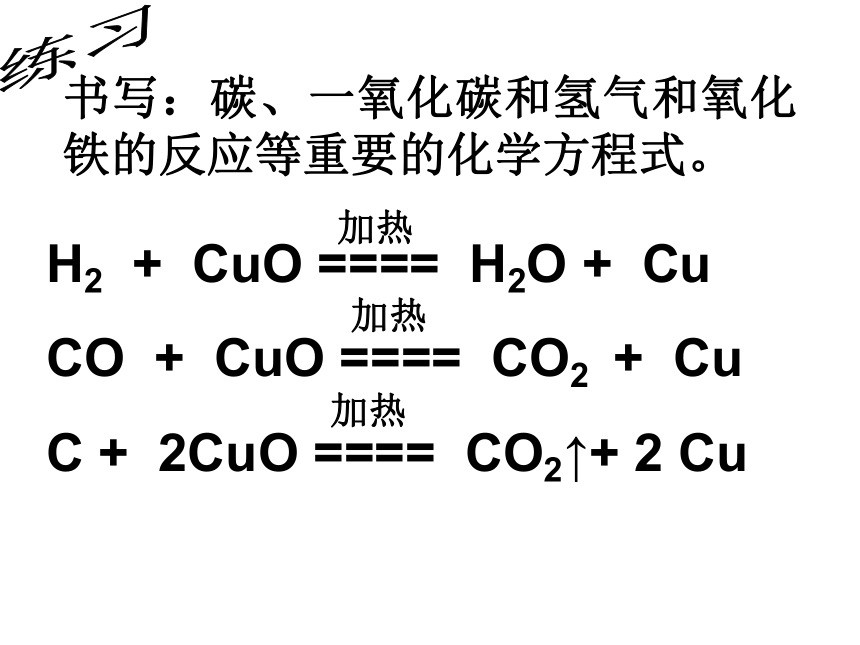
课件13张PPT。(第三课时)科学第五册第二章第二节物质转化规律练习书写:碳、一氧化碳和氢气和氧化铁的反应等重要的化学方程式。H2 + CuO ==== H2O + Cu
CO + CuO ==== CO2 + Cu
C + 2CuO ==== CO2↑+ 2 Cu加热加热加热计算:有关纯度问题的计算方法一、根据元素质量守恒思想计算,
铁矿石中的铁的质量= 生铁中铁的质量1、根据混合物质量及其纯度,如何计算纯净物质量?例1、 100吨含Fe2O3的质量分数为85%的铁矿石中,理论上可炼的铁多少吨 ?
纯净物质量==混合物质量 X 纯度
MFe2O3= 100吨× 85%=85吨2、根据纯净物的质量,求出其中组成元素的质量分数:(1)某元素的质量分数=该元素的质量/化合物的质量
=(该元素原子量× 原子个数)/化合物式量
=2Fe/ Fe2O3=0.73根据纯净物的质量和纯净物中该元素的质量分数,求出该元素的质量。该元素的质量=纯净物的质量×纯净物中该元素的质量分数=85吨×0.7=59.5吨例题2:铁矿石 85% Fe2O3 70% Fe 96% 生铁100吨含Fe2O3的质量分数为85%的铁矿石中,可炼出含铁的质量分数为96%的生铁多少吨?思路:习题1:用2000吨含Fe2O375%的铁矿石,最多可以炼出多少吨铁?方法二:根据化学方程式计算
1、写出相关的化学方程式
2、在化学方程式下标上题目中已知质量的物质的相对分子质量和实际质量,同时标出需要球的物质的相对分子质量
3、列式
4、求解计算100吨含Fe2O3的质量分数为85%的铁矿石,可炼出含铁的质量分数为96%的生铁多少吨?解:3CO+Fe2O3 ====2Fe+3CO2
160112100×85%X·96%==解析:反应后,固体质量减轻是由于铁的氧化物失氧所致。
解:设铁的氧化物化学式为FexOy,则:FexOy + yCO xFe + yCO2 固体减轻 56x+16y 56x 16y 2.32g 1.68g 2.32g-1.68g
56x∶1.68g=16y∶(2.32g-1.68g)
故:x∶y=3∶4
即所求铁的氧化物化学式为Fe3O4习题2:铁的氧化物2.32g,被CO还原后,只剩下1.68g铁,求铁的氧化物的化学式。(2)含一定量杂质的反应物或生成物质量的计算
例2 :31.25克石灰石跟足量的盐酸反应生成了11克二氧
化碳。求: 这种石灰石中碳酸钙的质量分数。
解:设石灰石中碳酸钙的质量为x克。
CaCO3+2HCl==CaCl2+ H2O+CO2
100 44
x 11克
100/x=44/11克 x=25克
CaCO3%=25克/31.25克=80% 答:略思考(1)这此石灰石在工业上可制得CO2多少克?
(2)同时生成生石灰多少克?纯度多少?1、现有氯化钙(CaCl2 )样品(只混有少量NaCl),某同学取12克该样品溶解在24克水中,然后向其中滴加100克碳酸钠(Na2CO3)溶液,此时两者恰好完全反应,过滤后可得干燥沉淀物(CaCO3 )10克。
求:(1)样品中氯化钙的质量分数;
(2)反应后所得氯化钠溶液中溶质的质量分数。
CO + CuO ==== CO2 + Cu
C + 2CuO ==== CO2↑+ 2 Cu加热加热加热计算:有关纯度问题的计算方法一、根据元素质量守恒思想计算,
铁矿石中的铁的质量= 生铁中铁的质量1、根据混合物质量及其纯度,如何计算纯净物质量?例1、 100吨含Fe2O3的质量分数为85%的铁矿石中,理论上可炼的铁多少吨 ?
纯净物质量==混合物质量 X 纯度
MFe2O3= 100吨× 85%=85吨2、根据纯净物的质量,求出其中组成元素的质量分数:(1)某元素的质量分数=该元素的质量/化合物的质量
=(该元素原子量× 原子个数)/化合物式量
=2Fe/ Fe2O3=0.73根据纯净物的质量和纯净物中该元素的质量分数,求出该元素的质量。该元素的质量=纯净物的质量×纯净物中该元素的质量分数=85吨×0.7=59.5吨例题2:铁矿石 85% Fe2O3 70% Fe 96% 生铁100吨含Fe2O3的质量分数为85%的铁矿石中,可炼出含铁的质量分数为96%的生铁多少吨?思路:习题1:用2000吨含Fe2O375%的铁矿石,最多可以炼出多少吨铁?方法二:根据化学方程式计算
1、写出相关的化学方程式
2、在化学方程式下标上题目中已知质量的物质的相对分子质量和实际质量,同时标出需要球的物质的相对分子质量
3、列式
4、求解计算100吨含Fe2O3的质量分数为85%的铁矿石,可炼出含铁的质量分数为96%的生铁多少吨?解:3CO+Fe2O3 ====2Fe+3CO2
160112100×85%X·96%==解析:反应后,固体质量减轻是由于铁的氧化物失氧所致。
解:设铁的氧化物化学式为FexOy,则:FexOy + yCO xFe + yCO2 固体减轻 56x+16y 56x 16y 2.32g 1.68g 2.32g-1.68g
56x∶1.68g=16y∶(2.32g-1.68g)
故:x∶y=3∶4
即所求铁的氧化物化学式为Fe3O4习题2:铁的氧化物2.32g,被CO还原后,只剩下1.68g铁,求铁的氧化物的化学式。(2)含一定量杂质的反应物或生成物质量的计算
例2 :31.25克石灰石跟足量的盐酸反应生成了11克二氧
化碳。求: 这种石灰石中碳酸钙的质量分数。
解:设石灰石中碳酸钙的质量为x克。
CaCO3+2HCl==CaCl2+ H2O+CO2
100 44
x 11克
100/x=44/11克 x=25克
CaCO3%=25克/31.25克=80% 答:略思考(1)这此石灰石在工业上可制得CO2多少克?
(2)同时生成生石灰多少克?纯度多少?1、现有氯化钙(CaCl2 )样品(只混有少量NaCl),某同学取12克该样品溶解在24克水中,然后向其中滴加100克碳酸钠(Na2CO3)溶液,此时两者恰好完全反应,过滤后可得干燥沉淀物(CaCO3 )10克。
求:(1)样品中氯化钙的质量分数;
(2)反应后所得氯化钠溶液中溶质的质量分数。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
