几种重要的盐
图片预览




文档简介
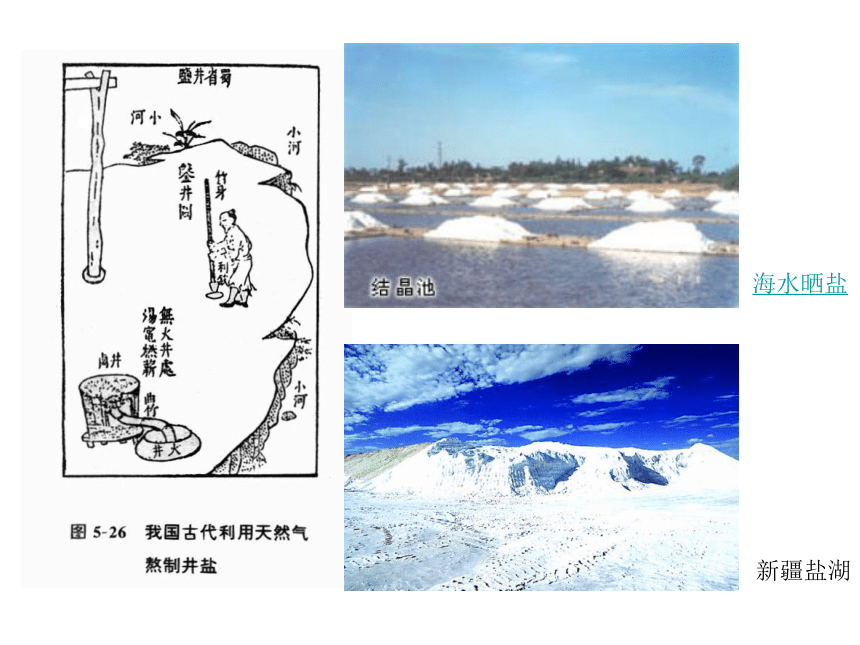
课件22张PPT。第四节 几种重要的盐·CaCO3(二)桐庐瑶琳仙境 绿柱石 橄榄石 锆石(水晶) Be3Al2Si6O18 (Mg,Fe)2[SiO4] ZrSiO4 自然界中几种属于盐类的宝石矿物新疆盐湖海水晒盐二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐1、氯化钠(NaCl) 盐酸盐(1)俗名: 。食盐 (2)食盐的来源:井水制盐、海水晒盐、盐湖 (3)阅读22页说一说食盐在生活中的用途?
a. 腌制火腿。食用盐掺入KIO3——加碘盐预防大脖子病
b.制生理盐水(0.9%)
c.杀菌(浓盐水):浓盐水使细胞失水死亡
d.食用调味品:每天摄入5克左右.(4)性质 “工业用盐”和食盐相似,误食会中毒,成分是亚硝酸钠,化学式为NaNO2物理性质:白色晶体,有咸味,易溶于水。粗盐有杂质易潮解 化学性质:NaCl=Na++Cl-预测猜想:汗液中主要是什么?
怎么检查他的存在?AgNO3+NaCl==AgCl↓+NaNO3二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐2、碳酸钠(Na2CO3)俗名:纯碱或苏打(2)碳酸钠晶体化学式:Na2CO3·10H2O含有一定数量水分子的物质称为结晶水合物,如CuSO4·5H2O。所含的水叫结晶水。注意:结晶水合物属于纯净物。(3)碳酸钠晶体常温下在空气中易失去结晶水而变成粉末。Na2CO3·10H2O==Na2CO3+10H2O我们把常温下在空气中易失去结晶水的过程叫做风化。(1)风化是物理变化还是化学变化?
(2)硫酸铜晶体受热分解变成白色粉末这
个变化是风化吗?请问化学性质:碳酸钠溶液呈碱性,能使酚酞变红色演示碳酸钠溶液中滴加无色酚酞,观察现象。你还有什么启发?盐溶液不一定呈中性,纯碱不是碱
用途:作洗涤剂去污.(1)物理性质:白色粉末,易溶于水(5)化性:a、Na2CO3溶液呈碱性,使酚酞变红b、Na2CO3 + 2HCl—c、Na2CO3 + Ca(OH)2——d、 Na2CO3 + CaCl2——工业上制烧碱(6)用途:
a:产量一半用于制造玻璃
b:蒸馒头做面包,去除酸味,松软可口
c:利用碱性制肥皂,洗洁精等
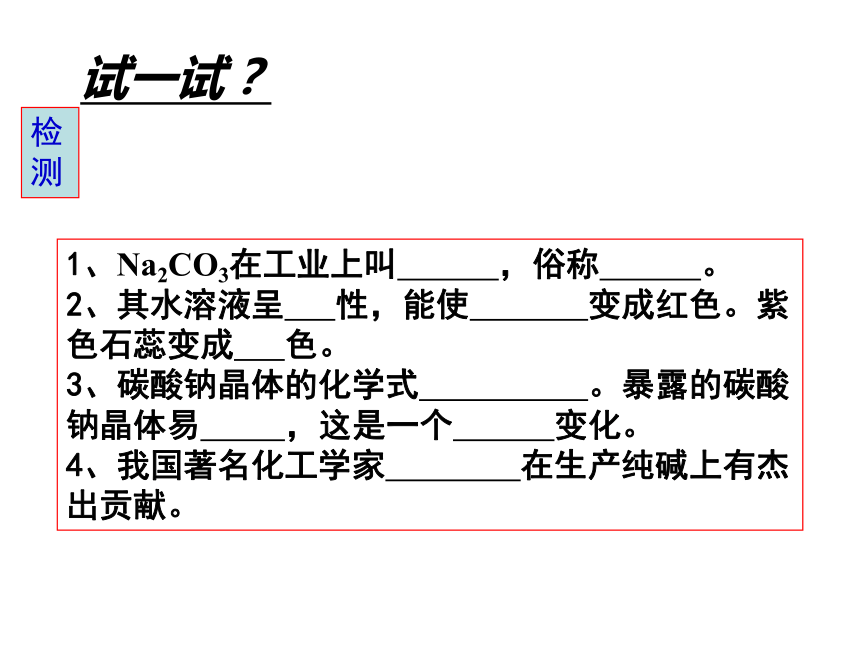
d:做酸碱灭火器的材料:制CO2气体预测二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐2、碳酸钠(Na2CO3)盐+盐→两种新盐1、Na2CO3在工业上叫 ,俗称 。
2、其水溶液呈 性,能使 变成红色。紫色石蕊变成 色。
3、碳酸钠晶体的化学式 。暴露的碳酸钠晶体易 ,这是一个 变化。
4、我国著名化工学家 在生产纯碱上有杰出贡献。检测试一试?(1)有关俗称CaCO3 :
CaO:
Ca(OH)2:生石灰,石灰石、大理石、白垩(汉白玉)熟石灰、消石灰、石灰浆、石灰乳二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐3、碳酸钙(CaCO3)自然界中的存在二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐3、碳酸钙(CaCO3) 加热易分解:CaCO3==CaO+ CO2↑做建筑材料你还知道碳酸钙有那些性质?练习讨论怎样检验碳酸盐(CO32-)(2)怎么检查一块岩石为碳酸盐?(CO32-)取样品,加盐酸,有气泡产生,并将气体通入澄清石灰水,如果石灰水变浑浊,则原样品为碳酸盐。总结:
你在已学的酸,碱的性质中有关和盐的反应有:1、盐 + 酸→ 新盐 + 新酸
AgNO3 + HCl == AgCl ↓+ HNO3
CaCO3 + HCl == CaCl2 +CO2 + H2O2、可溶盐 + 可溶 碱 → 新盐 + 新碱
Na2CO3 + Ca(OH)2== CaCO3↓+2NaOH 3、可溶盐 + 可溶盐 → 新盐 + 新盐
NaCl + AgNO3 === NaNO3 + AgCl↓
BaCl2 + Na2SO4=== 2NaCl + BaSO4↓1、NaCl中含有Na2CO3杂质,用什么除去?2、氧化钙CaO中含有CaCO3 ,怎么除去?3、FeCl2(HCl) FeCl3(HCl)5、用Na2CO3 ,NaCl, CuSO4,CaCO3,Ca(OH)2 填空:
改良土壤酸性用______ 面包发酵去除酸味:———
调味用———— 制造农药杀菌:——————
制造建筑材料生石灰:——- 可做建筑外墙装饰——4、下列溶液滴入酚酞能变红的是?
A NaCl B CuSO4 C Na2CO3 D KNO3二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐4、铵盐(1)铵盐与碱混合加热会产生氨气(NH3),氨气能使湿
润的红色石蕊试纸变蓝色。NH4Cl与NaOH溶液反应,并用红色石蕊试纸测试。演示你能尝试分析原因并写出这个反应的化学方程式吗?你知道铵盐(NH4+)的检验方法吗?取样品,加入氢氧化钠加热,如果产生能使湿润红色石蕊试纸的气体(NH3),则原样品为铵盐(NH4+)(2)铵盐常用作化肥(氮肥)[NH4Cl、(NH4)2SO4、(NH4)2CO3、NH4NO3等]1、氮肥(铵盐为主,还包括硝酸盐和尿素)
作用:能促使农作物的茎叶生长茂盛,含有组成
叶绿素的重要元素
制取:酸与氨气反应制得
举例说明 氨与硫酸 氨与碳酸等 四、盐与化肥
介绍:什么是化肥?以及化肥有哪些类型?氮肥怎么制造?
看书P24后回答!
氮肥 磷肥 钾肥 复合肥
请把P24连线做好2、磷肥
作用:促进农作物要系发达,增强吸收养份和抗寒
抗旱能力,促进作物穗数增多,籽粒饱满等
代表物:过磷酸钙(混合物)3、钾肥
作用:促进农作物生长旺盛,茎杆粗壮,增强抗病虫
害能力,促进糖和淀粉的生成。
代表物:硫酸钾、氯化钾、草木灰(成份K2CO3)
使用注意:长期使用会造成土壤板结,破坏土壤结构,
所以需要施一些农家肥料(有机肥)中国化学工业的先驱、侯氏制碱法的创造者
侯德榜 许多工业部门,尤其是纺织、肥皂、造纸。玻璃、火药等行业都需要大量用(纯)碱(碳酸钠)。古代那种从草木灰中提取碱液,从盐湖水中取得天然(纯)碱的方法是远远不能满足需求的。1788年,勒布兰提出了以氯化钠为原料的制(纯)碱法,经过4年的努力,得到了一套完整的生产流程。勒布兰制(纯)碱流程因为这方法主要是利用固相反应,又是高温操作,存在许多缺陷,生产不能连续,劳动强度大,煤耗量大,产品质量不高。面对这些问题,许多人有意改革它。到了1862年,比利时化学家索尔维实现了氨碱法的工业化。由于这种新方法能连续生产,产量大,质量高,省劳动力。废物容易处理,成本低廉,它很快取代了勒布兰法。索尔维制碱法的原理很简单:先把氨气通入食盐水,然后向氨盐水中通二氧化碳,生产溶解度较小的碳酸氢钠。再将碳酸氢钠过滤出来,经焙烧得到纯净洁白的碳酸钠。
侯德榜经过调查,决定改进索尔维法开创制碱新路,他总结了索尔维法的优缺点,认为这方法的主要缺点在于,两种原料组分只利用了一半,即食盐(NaCl)中的钠和石灰(CaCO3)中的碳酸根结合成纯碱(Na2CO3)另一半组分食盐中的氯和石灰中的钙结合成了CaCl2,却没有用途。
??? 针对以上生产中不可克服的种种缺陷,侯德榜创造性地设计了联合制碱新工艺。这个新工艺是把氨厂和碱厂建在一起,联合生产。由氨厂提供碱厂需要的氨和二氧化碳。母液里的氯化铵用加入食盐的办法使它结晶出来,作为化工产品或化肥。食盐溶液又可以循环使用。命名为“侯氏联合制碱法”。 我们解决复分解反应的有关问题时就往往从离子的角度去突破。 三、 复分解反应的条件 生成物中有: 1、下列各组离子能在PH=1的溶液中大量共存的是: ( )
A、Na+、K+、NO3-、CO32-
B、Fe3+、SO42-、OH-、Na+
C、Ag+、Ba2+、Cl-、NO3-
D、K+、Cl-、Mg2+、NO3-D想想看 2、往HCl溶液中加入CaCO3直至过量,
若不计溶液体积变化,则:1、溶液的PH值如何变化?2、溶液的导电性如何变化?CaCO3+HCl分析O7PHO7PH加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量ABCD往HCl溶液中加入CaCO3,若不计溶液体积 变化溶液的PH值如何变化?( )AO导电性OOO加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量导电性导电性导电性往HCl溶液中加入CaCO3,若不计溶液体积变化
溶液的导电性如何变化?( )CABCD晶体:Na2CO3?10H2O
a. 腌制火腿。食用盐掺入KIO3——加碘盐预防大脖子病
b.制生理盐水(0.9%)
c.杀菌(浓盐水):浓盐水使细胞失水死亡
d.食用调味品:每天摄入5克左右.(4)性质 “工业用盐”和食盐相似,误食会中毒,成分是亚硝酸钠,化学式为NaNO2物理性质:白色晶体,有咸味,易溶于水。粗盐有杂质易潮解 化学性质:NaCl=Na++Cl-预测猜想:汗液中主要是什么?
怎么检查他的存在?AgNO3+NaCl==AgCl↓+NaNO3二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐2、碳酸钠(Na2CO3)俗名:纯碱或苏打(2)碳酸钠晶体化学式:Na2CO3·10H2O含有一定数量水分子的物质称为结晶水合物,如CuSO4·5H2O。所含的水叫结晶水。注意:结晶水合物属于纯净物。(3)碳酸钠晶体常温下在空气中易失去结晶水而变成粉末。Na2CO3·10H2O==Na2CO3+10H2O我们把常温下在空气中易失去结晶水的过程叫做风化。(1)风化是物理变化还是化学变化?
(2)硫酸铜晶体受热分解变成白色粉末这
个变化是风化吗?请问化学性质:碳酸钠溶液呈碱性,能使酚酞变红色演示碳酸钠溶液中滴加无色酚酞,观察现象。你还有什么启发?盐溶液不一定呈中性,纯碱不是碱
用途:作洗涤剂去污.(1)物理性质:白色粉末,易溶于水(5)化性:a、Na2CO3溶液呈碱性,使酚酞变红b、Na2CO3 + 2HCl—c、Na2CO3 + Ca(OH)2——d、 Na2CO3 + CaCl2——工业上制烧碱(6)用途:
a:产量一半用于制造玻璃
b:蒸馒头做面包,去除酸味,松软可口
c:利用碱性制肥皂,洗洁精等
d:做酸碱灭火器的材料:制CO2气体预测二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐2、碳酸钠(Na2CO3)盐+盐→两种新盐1、Na2CO3在工业上叫 ,俗称 。
2、其水溶液呈 性,能使 变成红色。紫色石蕊变成 色。
3、碳酸钠晶体的化学式 。暴露的碳酸钠晶体易 ,这是一个 变化。
4、我国著名化工学家 在生产纯碱上有杰出贡献。检测试一试?(1)有关俗称CaCO3 :
CaO:
Ca(OH)2:生石灰,石灰石、大理石、白垩(汉白玉)熟石灰、消石灰、石灰浆、石灰乳二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐3、碳酸钙(CaCO3)自然界中的存在二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐3、碳酸钙(CaCO3) 加热易分解:CaCO3==CaO+ CO2↑做建筑材料你还知道碳酸钙有那些性质?练习讨论怎样检验碳酸盐(CO32-)(2)怎么检查一块岩石为碳酸盐?(CO32-)取样品,加盐酸,有气泡产生,并将气体通入澄清石灰水,如果石灰水变浑浊,则原样品为碳酸盐。总结:
你在已学的酸,碱的性质中有关和盐的反应有:1、盐 + 酸→ 新盐 + 新酸
AgNO3 + HCl == AgCl ↓+ HNO3
CaCO3 + HCl == CaCl2 +CO2 + H2O2、可溶盐 + 可溶 碱 → 新盐 + 新碱
Na2CO3 + Ca(OH)2== CaCO3↓+2NaOH 3、可溶盐 + 可溶盐 → 新盐 + 新盐
NaCl + AgNO3 === NaNO3 + AgCl↓
BaCl2 + Na2SO4=== 2NaCl + BaSO4↓1、NaCl中含有Na2CO3杂质,用什么除去?2、氧化钙CaO中含有CaCO3 ,怎么除去?3、FeCl2(HCl) FeCl3(HCl)5、用Na2CO3 ,NaCl, CuSO4,CaCO3,Ca(OH)2 填空:
改良土壤酸性用______ 面包发酵去除酸味:———
调味用———— 制造农药杀菌:——————
制造建筑材料生石灰:——- 可做建筑外墙装饰——4、下列溶液滴入酚酞能变红的是?
A NaCl B CuSO4 C Na2CO3 D KNO3二、几种盐的性质氯化钠碳酸钠碳酸钙铵盐4、铵盐(1)铵盐与碱混合加热会产生氨气(NH3),氨气能使湿
润的红色石蕊试纸变蓝色。NH4Cl与NaOH溶液反应,并用红色石蕊试纸测试。演示你能尝试分析原因并写出这个反应的化学方程式吗?你知道铵盐(NH4+)的检验方法吗?取样品,加入氢氧化钠加热,如果产生能使湿润红色石蕊试纸的气体(NH3),则原样品为铵盐(NH4+)(2)铵盐常用作化肥(氮肥)[NH4Cl、(NH4)2SO4、(NH4)2CO3、NH4NO3等]1、氮肥(铵盐为主,还包括硝酸盐和尿素)
作用:能促使农作物的茎叶生长茂盛,含有组成
叶绿素的重要元素
制取:酸与氨气反应制得
举例说明 氨与硫酸 氨与碳酸等 四、盐与化肥
介绍:什么是化肥?以及化肥有哪些类型?氮肥怎么制造?
看书P24后回答!
氮肥 磷肥 钾肥 复合肥
请把P24连线做好2、磷肥
作用:促进农作物要系发达,增强吸收养份和抗寒
抗旱能力,促进作物穗数增多,籽粒饱满等
代表物:过磷酸钙(混合物)3、钾肥
作用:促进农作物生长旺盛,茎杆粗壮,增强抗病虫
害能力,促进糖和淀粉的生成。
代表物:硫酸钾、氯化钾、草木灰(成份K2CO3)
使用注意:长期使用会造成土壤板结,破坏土壤结构,
所以需要施一些农家肥料(有机肥)中国化学工业的先驱、侯氏制碱法的创造者
侯德榜 许多工业部门,尤其是纺织、肥皂、造纸。玻璃、火药等行业都需要大量用(纯)碱(碳酸钠)。古代那种从草木灰中提取碱液,从盐湖水中取得天然(纯)碱的方法是远远不能满足需求的。1788年,勒布兰提出了以氯化钠为原料的制(纯)碱法,经过4年的努力,得到了一套完整的生产流程。勒布兰制(纯)碱流程因为这方法主要是利用固相反应,又是高温操作,存在许多缺陷,生产不能连续,劳动强度大,煤耗量大,产品质量不高。面对这些问题,许多人有意改革它。到了1862年,比利时化学家索尔维实现了氨碱法的工业化。由于这种新方法能连续生产,产量大,质量高,省劳动力。废物容易处理,成本低廉,它很快取代了勒布兰法。索尔维制碱法的原理很简单:先把氨气通入食盐水,然后向氨盐水中通二氧化碳,生产溶解度较小的碳酸氢钠。再将碳酸氢钠过滤出来,经焙烧得到纯净洁白的碳酸钠。
侯德榜经过调查,决定改进索尔维法开创制碱新路,他总结了索尔维法的优缺点,认为这方法的主要缺点在于,两种原料组分只利用了一半,即食盐(NaCl)中的钠和石灰(CaCO3)中的碳酸根结合成纯碱(Na2CO3)另一半组分食盐中的氯和石灰中的钙结合成了CaCl2,却没有用途。
??? 针对以上生产中不可克服的种种缺陷,侯德榜创造性地设计了联合制碱新工艺。这个新工艺是把氨厂和碱厂建在一起,联合生产。由氨厂提供碱厂需要的氨和二氧化碳。母液里的氯化铵用加入食盐的办法使它结晶出来,作为化工产品或化肥。食盐溶液又可以循环使用。命名为“侯氏联合制碱法”。 我们解决复分解反应的有关问题时就往往从离子的角度去突破。 三、 复分解反应的条件 生成物中有: 1、下列各组离子能在PH=1的溶液中大量共存的是: ( )
A、Na+、K+、NO3-、CO32-
B、Fe3+、SO42-、OH-、Na+
C、Ag+、Ba2+、Cl-、NO3-
D、K+、Cl-、Mg2+、NO3-D想想看 2、往HCl溶液中加入CaCO3直至过量,
若不计溶液体积变化,则:1、溶液的PH值如何变化?2、溶液的导电性如何变化?CaCO3+HCl分析O7PHO7PH加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量ABCD往HCl溶液中加入CaCO3,若不计溶液体积 变化溶液的PH值如何变化?( )AO导电性OOO加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量加入CaCO3的数量导电性导电性导电性往HCl溶液中加入CaCO3,若不计溶液体积变化
溶液的导电性如何变化?( )CABCD晶体:Na2CO3?10H2O
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
