2017-2018学年下学期高二化学人教版(期中复习)每日一题2018年4月18日+化学键的相关判断
文档属性
| 名称 | 2017-2018学年下学期高二化学人教版(期中复习)每日一题2018年4月18日+化学键的相关判断 |

|
|
| 格式 | zip | ||
| 文件大小 | 306.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-04-19 00:00:00 | ||
图片预览


文档简介
4月18日 化学键的相关判断
高考频度:★★★★☆
难易程度:★★★☆☆
典例在线
下列说法中正确的是
A.NaCl和HCl溶于水破坏相同的作用力
B.Si与C同属IVA族,因此SiO2和CO2两种物质中微粒间作用完全相同
C.稳定性;H2O>H2S,沸点:H2OD.石墨转化金刚石,既有化学键的断裂,又有化学键的形成
【答案】D
【解析】A.NaCl和HCl溶于水,NaCl破坏的是离子键,HCl破坏的是共价键,破坏的作用力不同,错误;B.SiO2是原子晶体,CO2是分子晶体,两种物质中微粒间作用不相同,错误;C.非金属性越强气态氢化物越稳定,非金属性O>S,所以稳定性:H2O>H2S,H2O分子间能形成氢键,所以沸点:H2O>H2S,错误;D.石墨转化为金刚石是化学变化,既有旧化学键的断裂,又有新化学键的形成,正确。答案选D。
解题必备
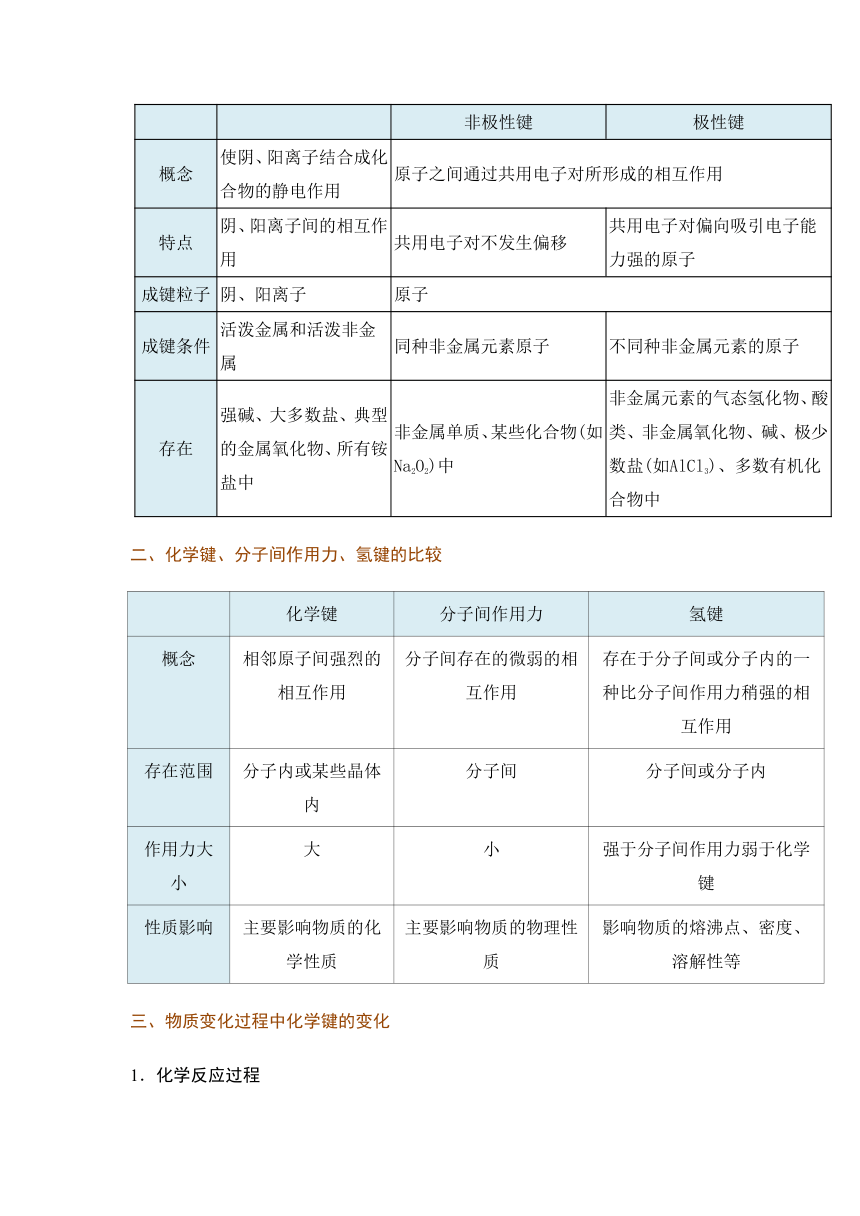
一、离子键和共价键的比较
键型
离子键
共价键
非极性键
极性键
概念
使阴、阳离子结合成化合物的静电作用
原子之间通过共用电子对所形成的相互作用
特点
阴、阳离子间的相互作用
共用电子对不发生偏移
共用电子对偏向吸引电子能力强的原子
成键粒子
阴、阳离子
原子
成键条件
活泼金属和活泼非金属
同种非金属元素原子
不同种非金属元素的原子
存在
强碱、大多数盐、典型的金属氧化物、所有铵盐中
非金属单质、某些化合物(如Na2O2)中
非金属元素的气态氢化物、酸类、非金属氧化物、碱、极少数盐(如AlCl3)、多数有机化合物中
二、化学键、分子间作用力、氢键的比较
化学键
分子间作用力
氢键
概念
相邻原子间强烈的相互作用
分子间存在的微弱的相互作用
存在于分子间或分子内的一种比分子间作用力稍强的相互作用
存在范围
分子内或某些晶体内
分子间
分子间或分子内
作用力大小
大
小
强于分子间作用力弱于化学键
性质影响
主要影响物质的化学性质
主要影响物质的物理性质
影响物质的熔沸点、密度、溶解性等
三、物质变化过程中化学键的变化
1.化学反应过程
化学反应过程中一定有反应物中旧化学键的破坏和产物中新化学键的形成。如:
H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程
离子化合物电离阴、阳离子
3.共价化合物的溶解或熔化过程
(1)溶解过程
(2)熔化
4.单质的熔化或溶解过程
单质的特点
化学键变化
举 例
由分子构成的固体单质
熔化或升华时只破坏分子间作用力,不破坏化学键
P4的熔化,I2的升华
由原子构成的单质
熔化时破坏共价键
金刚石或晶体硅
能与水反应的某些活泼非金属单质
溶于水后,分子内共价键被破坏
Cl2、F2等
【特别提醒】1.化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+
2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
2.化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等,只有旧化学键的断裂而没有新化学键的生成,故不是化学变化。
易混易错
1.化学键判断的“四个不是”
(1)不是所有的物质都含有化学键,如稀有气体中不含化学键。
(2)不是只要含有共价键的物质就属于共价化合物,单质例外。
(3)不是所有的离子化合物都含有金属元素,如铵盐中含离子键。
(4)不是只要含有金属元素的化合物就是离子化合物,如氯化铝中所含的是共价键,属于共价化合物。
2.化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”:离子化合物中一定含离子键;含离子键的化合物一定是离子化合物;共价化合物中一定不含离子键。
(2)“三个可能”:离子化合物中可能含有共价键,如NaOH;金属与非金属形成的化合物可能是共价化合物,如AlCl3;完全由非金属形成的化合物可能是离子化合物,如NH4Cl。
学霸推荐
1.下列各组物质中化学键的类型相同的是
A.HCl MgCl2 NH4Cl B.HF Na2O CO2
C.CaCl2 NaOH H2O2 D.NH3 H2O CO2
2.下列说法正确的是
A.H2O2中既有离子键又有共价键
B.HCl溶于水能电离出H+和Cl?,所以HCl是离子化合物
C.干冰属于分子晶体,熔化破坏共价键和分子间作用力
D.PCl3分子中每个原子的最外层都具有8电子的稳定结构
3.下列说法正确的是
A.共价化合物中可能含有离子键
B.离子化合物中只含有离子键
C.区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
D.离子化合物熔融状态能电离出自由移动的离子,而共价化合物熔融状态不能电离出自由移动的离子
4.下列叙述正确的是
A.O2分子间存在着非极性共价键
B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物
D.盐酸中含有H+和Cl?,故HCl为离子化合物
5.下列变化过程中,只破坏共价键的是
A.冰变水 B.Na2SO4熔融呈液态
C.HCl溶于水得盐酸 D.NH4Cl溶于水
参考答案
1.【答案】D
【解析】A. HCl分子中存在共价键,MgCl2中存在离子键,NH4Cl中既有共价键又有离子键,化学键的类型不同,故A项错误;B项,HF、Na2O、CO2中的化学键分别为共价键、离子键、共价键,化学键类型不同,故B项错误;C项,CaCl2中的化学键为离子键,NaOH、H2O2中含有共价键和离子键,化学键类型不同,故C项错误。D项,NH3、H2O、CO2中的化学键均为共价键,类型相同,故D项正确;综上所述,本题正确答案为D。
2.【答案】D
3.【答案】D
【解析】A.共价化合物中只有共价键,不可能含有离子键,A错误;B.离子化合物中一定有离子键,也可能含有共价键,如氯化铵、氢氧化钠等等,B不正确;C.区别离子化合物和共价化合物的方法是看其在熔融状态下是否能够导电,离子化合物和部分共价化合物在水溶液中能发生电离,所以C不正确;D.离子化合物熔融状态能电离出自由移动的离子,而共价化合物熔融状态不能电离出自由移动的离子,D正确。本题选D。
4.【答案】B
5.【答案】C
【解析】冰是分子晶体,熔化为水时破坏氢键、分子间作用力,A错误;Na2SO4属于离子化合物,熔融时电离破坏离子键,B错误;HCl中含有共价键,溶于水发生电离,破坏共价键,C正确;NH4Cl溶于水破坏了离子键和共价键,D错误;正确选项为C。
学霸之路
高考频度:★★★★☆
难易程度:★★★☆☆
典例在线
下列说法中正确的是
A.NaCl和HCl溶于水破坏相同的作用力
B.Si与C同属IVA族,因此SiO2和CO2两种物质中微粒间作用完全相同
C.稳定性;H2O>H2S,沸点:H2O
【答案】D
【解析】A.NaCl和HCl溶于水,NaCl破坏的是离子键,HCl破坏的是共价键,破坏的作用力不同,错误;B.SiO2是原子晶体,CO2是分子晶体,两种物质中微粒间作用不相同,错误;C.非金属性越强气态氢化物越稳定,非金属性O>S,所以稳定性:H2O>H2S,H2O分子间能形成氢键,所以沸点:H2O>H2S,错误;D.石墨转化为金刚石是化学变化,既有旧化学键的断裂,又有新化学键的形成,正确。答案选D。
解题必备
一、离子键和共价键的比较
键型
离子键
共价键
非极性键
极性键
概念
使阴、阳离子结合成化合物的静电作用
原子之间通过共用电子对所形成的相互作用
特点
阴、阳离子间的相互作用
共用电子对不发生偏移
共用电子对偏向吸引电子能力强的原子
成键粒子
阴、阳离子
原子
成键条件
活泼金属和活泼非金属
同种非金属元素原子
不同种非金属元素的原子
存在
强碱、大多数盐、典型的金属氧化物、所有铵盐中
非金属单质、某些化合物(如Na2O2)中
非金属元素的气态氢化物、酸类、非金属氧化物、碱、极少数盐(如AlCl3)、多数有机化合物中
二、化学键、分子间作用力、氢键的比较
化学键
分子间作用力
氢键
概念
相邻原子间强烈的相互作用
分子间存在的微弱的相互作用
存在于分子间或分子内的一种比分子间作用力稍强的相互作用
存在范围
分子内或某些晶体内
分子间
分子间或分子内
作用力大小
大
小
强于分子间作用力弱于化学键
性质影响
主要影响物质的化学性质
主要影响物质的物理性质
影响物质的熔沸点、密度、溶解性等
三、物质变化过程中化学键的变化
1.化学反应过程
化学反应过程中一定有反应物中旧化学键的破坏和产物中新化学键的形成。如:
H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程
离子化合物电离阴、阳离子
3.共价化合物的溶解或熔化过程
(1)溶解过程
(2)熔化
4.单质的熔化或溶解过程
单质的特点
化学键变化
举 例
由分子构成的固体单质
熔化或升华时只破坏分子间作用力,不破坏化学键
P4的熔化,I2的升华
由原子构成的单质
熔化时破坏共价键
金刚石或晶体硅
能与水反应的某些活泼非金属单质
溶于水后,分子内共价键被破坏
Cl2、F2等
【特别提醒】1.化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+
2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
2.化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等,只有旧化学键的断裂而没有新化学键的生成,故不是化学变化。
易混易错
1.化学键判断的“四个不是”
(1)不是所有的物质都含有化学键,如稀有气体中不含化学键。
(2)不是只要含有共价键的物质就属于共价化合物,单质例外。
(3)不是所有的离子化合物都含有金属元素,如铵盐中含离子键。
(4)不是只要含有金属元素的化合物就是离子化合物,如氯化铝中所含的是共价键,属于共价化合物。
2.化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”:离子化合物中一定含离子键;含离子键的化合物一定是离子化合物;共价化合物中一定不含离子键。
(2)“三个可能”:离子化合物中可能含有共价键,如NaOH;金属与非金属形成的化合物可能是共价化合物,如AlCl3;完全由非金属形成的化合物可能是离子化合物,如NH4Cl。
学霸推荐
1.下列各组物质中化学键的类型相同的是
A.HCl MgCl2 NH4Cl B.HF Na2O CO2
C.CaCl2 NaOH H2O2 D.NH3 H2O CO2
2.下列说法正确的是
A.H2O2中既有离子键又有共价键
B.HCl溶于水能电离出H+和Cl?,所以HCl是离子化合物
C.干冰属于分子晶体,熔化破坏共价键和分子间作用力
D.PCl3分子中每个原子的最外层都具有8电子的稳定结构
3.下列说法正确的是
A.共价化合物中可能含有离子键
B.离子化合物中只含有离子键
C.区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
D.离子化合物熔融状态能电离出自由移动的离子,而共价化合物熔融状态不能电离出自由移动的离子
4.下列叙述正确的是
A.O2分子间存在着非极性共价键
B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物
D.盐酸中含有H+和Cl?,故HCl为离子化合物
5.下列变化过程中,只破坏共价键的是
A.冰变水 B.Na2SO4熔融呈液态
C.HCl溶于水得盐酸 D.NH4Cl溶于水
参考答案
1.【答案】D
【解析】A. HCl分子中存在共价键,MgCl2中存在离子键,NH4Cl中既有共价键又有离子键,化学键的类型不同,故A项错误;B项,HF、Na2O、CO2中的化学键分别为共价键、离子键、共价键,化学键类型不同,故B项错误;C项,CaCl2中的化学键为离子键,NaOH、H2O2中含有共价键和离子键,化学键类型不同,故C项错误。D项,NH3、H2O、CO2中的化学键均为共价键,类型相同,故D项正确;综上所述,本题正确答案为D。
2.【答案】D
3.【答案】D
【解析】A.共价化合物中只有共价键,不可能含有离子键,A错误;B.离子化合物中一定有离子键,也可能含有共价键,如氯化铵、氢氧化钠等等,B不正确;C.区别离子化合物和共价化合物的方法是看其在熔融状态下是否能够导电,离子化合物和部分共价化合物在水溶液中能发生电离,所以C不正确;D.离子化合物熔融状态能电离出自由移动的离子,而共价化合物熔融状态不能电离出自由移动的离子,D正确。本题选D。
4.【答案】B
5.【答案】C
【解析】冰是分子晶体,熔化为水时破坏氢键、分子间作用力,A错误;Na2SO4属于离子化合物,熔融时电离破坏离子键,B错误;HCl中含有共价键,溶于水发生电离,破坏共价键,C正确;NH4Cl溶于水破坏了离子键和共价键,D错误;正确选项为C。
学霸之路
