3、金属
图片预览









文档简介
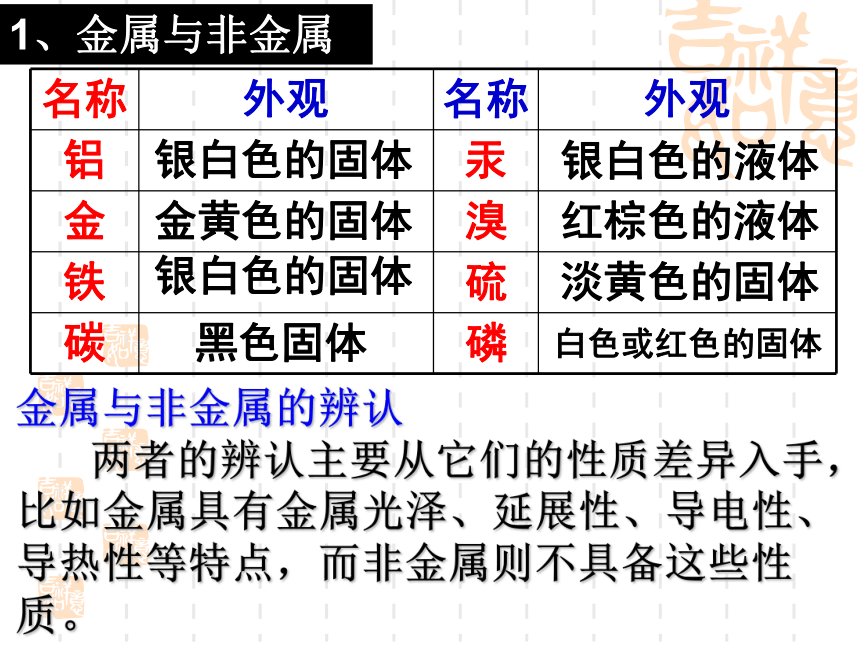
课件53张PPT。第五章 第三节 金属银白色的固体银白色的液体金黄色的固体红棕色的液体银白色的固体淡黄色的固体黑色固体白色或红色的固体金属与非金属的辨认
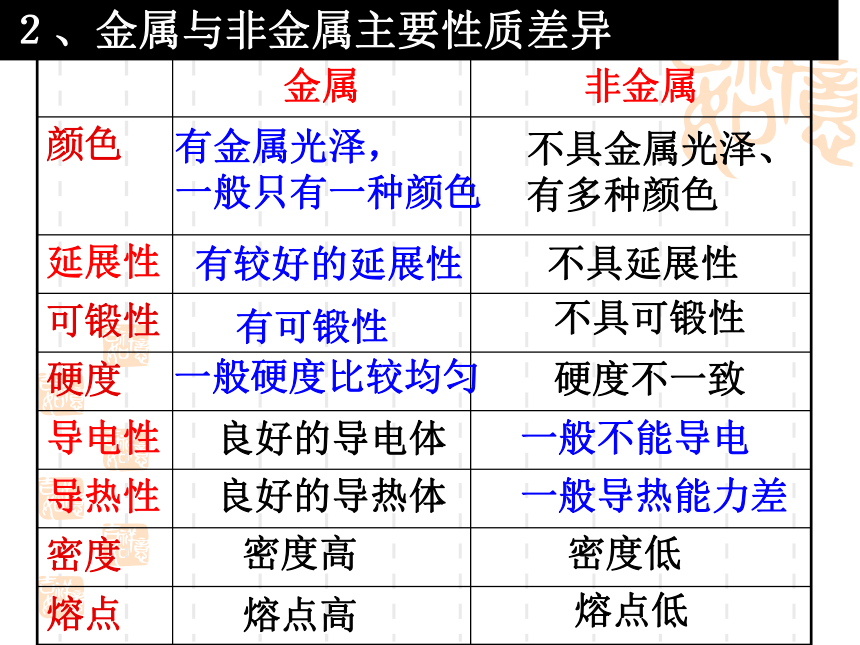
两者的辨认主要从它们的性质差异入手,比如金属具有金属光泽、延展性、导电性、导热性等特点,而非金属则不具备这些性质。1、金属与非金属2、金属与非金属主要性质差异有金属光泽, 一般只有一种颜色不具金属光泽、
有多种颜色有较好的延展性不具延展性有可锻性不具可锻性一般硬度比较均匀硬度不一致良好的导电体一般不能导电良好的导热体一般导热能力差密度高密度低熔点高熔点低注意点: (1)金属一定能导电、导热, 但能导电导热的单质不一定是金属。如非金属石墨也能导电,也能导热。 (2)金属在常温下,除汞是液态外,一般都是固态。
非金属在常温下,除溴是液态外,一般都是气态或固态 。折断的是非金属分辨金属还是非金属做导电性实验能导电的是金属不能导电的是非金属放在光照处有特殊金属光泽的是金属单质无特殊光泽的是非金属单质在火上烤导热的是金属不导热的是非金属硬物单击可锻的是金属碎裂的是非金属用力拉伸长的是金属3、常见金属性质与用途的关系
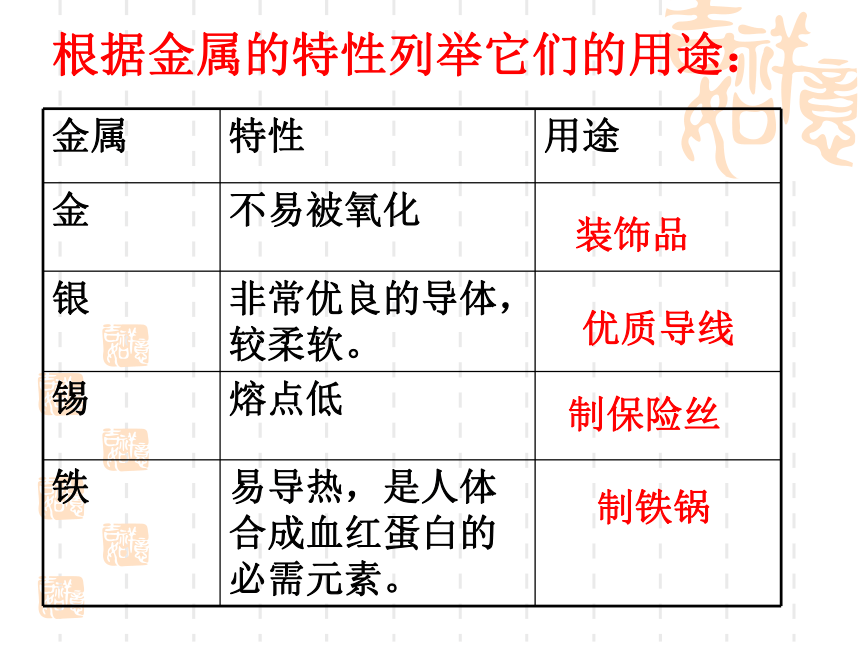
人们常根据金属的一般属性和每种金属的独特性质,如:密度、外表、价格等来选择使用金属。像金常用于首饰行业,铜可做导线,铝可做铝罐,锡可镀铁器等等。性质 用途决定装饰品优质导线制保险丝制铁锅根据金属的特性列举它们的用途:硬度好做机械(菜刀、锤子、车床)熔点高灯丝钨金属的密度轻金属: 密度 < 4.5 g/cm3
重金属:密度 >4.5 g/cm3
铝、钾、镁、钙 等 铁、铜、铅、汞 等 铝 1.铝是化学性质比较活泼的金属,在地壳中含量占第三位,是地壳中含量最多的金属元素. 2.铝在自然界主要以化合态存在.如铝矿(Al2O3).明矾(KAl(SO4)2.12H2O)问1.铝为何具有很强的抗腐蚀能力? 常温下,铝在空气中表面能形成致密的氧化膜(Al2O3),保护铝不再被氧化腐蚀。化学方程式:4Al+3O2==2Al2O3问2:铝合金用于航天、航海方面的材料,
是利用它的哪些性质? 轻金属(密度小),强度大,抗腐蚀能力强,而且是非磁性体,但不耐高温。问3:铝已成为食品污染源,它在哪些方面的应用应加以控制?1、制炊具 2、明矾净水 3、明矾用作食品膨松剂 4、胃舒平治疗胃酸过多 5、易拉罐饮料 6、包装糖果……问4、新买的铝壶烧开水后,浸水部份为何变黑? 原因是铝与天然水中的铁盐.亚铁盐反应生成的黑色铁粉覆盖在铝表面反应方程式:Al+FeCl3==Fe+AlCl32Al+3FeCl2==3Fe+2AlCl3问5、为何不宜用钢刷来擦洗铝制餐具呢?若用钢刷擦洗铝制品,容易把氧化薄膜除掉,导致内部的铝进一步氧化,从而起不到保护作用。1、制造飞机和制造机器底座,对所用金属的密度和硬度会有什么要求? 2、电炉丝是用金属钨制成的,你认为它利用了钨的哪些性质? 导电性.导热性.熔点高3、制造飞机材料为何用铝合金而不用纯铝?4、为什么菜刀.镰刀.锤子等用铁制而不用铅制? 铁的硬度大,铅的硬度小纯铝质软,而铝合金强度大铁——第一金属钢铁是国民经济建设中最重要的材料
钢铁是世界上产量最大的金属钛——未来的第三金属银灰色,外形似钢
能承受剧烈温差——制作火箭发动机壳体、人造卫星外壳、导弹
表面易形成氧化物薄膜,抗腐蚀——核潜艇
对人体无毒,不与人体发生反应,与人体组织长成一体——医疗器械、人工关节、人工心瓣、人工齿根金属的活动性比较 金铜铁铝四兄弟
遇氧表现有差异。
常温见氧脸披纱; .
纯氧炉中火星射; .
火中见氧红变黑; .
此子不愧真君子, .
脸不改色心不跳。FeCuAlAuMg>Fe
Fe>Cu
一.金属与氧气的反应?火星四射,放出大量的热,黑色固体
?发出白光,放热,生成白色固体
由红色变为黑色? 点燃
3Fe+2O2==Fe3O4
??
点燃
2Mg+O2==2MgO
△
2Cu+O2==2CuO结论:
1.不同的金属与氧气的反应条
件不同. 2.与氧气反应条件的不同,说明金属
的化学活动性不同.二.金属的化学活动性顺序讨论:观察此图,你有何看法?金属活动性由强逐渐减弱 (失电子由易到难)金属活动性顺序表练习:等质量的A,B,C三种金属分别与质量相同,质量分数也相同的稀硫酸充分反应放出氢气的情况如下图所示:AC判断:1 活动性最强的金属是2 活动性最弱的金属是3 反应不再发生时,最先用完的一种物质是( )( )( )硫酸4、谁过量金属 相同质量的下列金属与足量的稀盐酸反应,产生氢气最多的是( ) A Zn B Fe C Mg D Al D 将一瓶盐酸等分成三份,分别跟等质量的Al 、Fe、 Zn反应后,三种金属都有剩余,且剩余金属的质量Al >Fe> Zn,若生成氢气的质量分别为a、b、c,则其间的关系是( ) A ab>c C a=b=c D 无法比较 C说明:铁能把铜从硫酸铜溶液中反应出来,这也是比较金属活动性的依据之一。现象:_________________________________________________
________________________________________________________将铁钉投入到硫酸铜溶液中有何现象? 铁钉表面会有红色物质析出,若时间足够
长,则溶液会从蓝色变为浅绿色。Fe + CuSO4 = Cu + FeSO4 该反应的化学方程式:回忆:活动性:Fe﹥Cu根据刚才的实验填写表格上述反应的共同特征1、反应物和产物都只有两种;2、反应物是单质和化合物,产物也是单质和化合物;结论:置换反应:特点:单质+化合物 → 单质+化合物(一)判断金属跟盐溶液能否发生置换反应。 在金属活动性顺序中,只有一种活动性较强的金属才能把另一种活性较弱的金属从它的盐溶液中置换出来。
在金属活动顺序里,位于前面的金属能把位于后面的金属从它们盐溶液中置换出来。金属+ 可溶性的盐 = 金属 + 盐1.单质金属要排在盐中金属元素前面2.盐必须是可溶性,即是溶液。3.K Ca Na与盐溶液混合时,要先跟水反应。B下列反应的化学方程式中,正确的是( )A. Cu+2AgCl=2Ag+CuCl2B. Zn+2AgNO3=2Ag+Zn(NO3)2C. 2Na+CuSO4=Cu+Na2SO4D. 2Fe+3CuCl2=2FeCl3+3Cu 把混有少量氧化铜粉末的铁粉,放入盛稀硫酸的烧杯中,充分反应后,有部分铁剩余,过滤,滤液中含有的溶质是 ( )
A H2SO4 B CuSO4和FeSO4
C H2SO4和FeSO4 D 只有FeSO4D(二)判断金属跟混合盐溶液反应的次序。 (一般来说)反应的先后次序是: 在金属活动性顺序中,排在越后面的金属,越易从它们的盐溶液里被置换出来。
或者说:金属活动性相差越大,置换反应越易发生。一、金属的化学性质:
1、与氧气反应
(金属越活泼,反应越容易,越剧烈)
2、氢前金属+盐酸(稀硫酸)(置换反应)
(金属越活泼,反应越容易,越剧烈)
3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。
二、置换反应(A+BC==B+AC)
三、金属活动顺序及其应用
(判断金属能否在溶液中发生置换反应,及反应的快慢) 将一定质量的铁粉放入足量相同质量分数的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是( )A. Fe B. Cu C. AgC 将少量铁粉和铜粉加入一定量的硝酸银溶液中充分反应后过滤。取少量滤液,在其中滴加稀盐酸,结果出现了白色沉淀。判断滤液中存在什么金属离子?滤纸上有什么物质? 要验证镁、铁、铜三种金属的活动性顺序,可选用哪组物质进行反应( )
A 铁、铜、氯化镁溶液
B 铁、硫酸铜溶液、氯化镁溶液
C 铜、氯化锌溶液、氯化亚铁溶液 D 镁、氯化铜溶液、氯化亚铁溶液
E 镁、铜、氯化亚铁溶液B E讨论:
金属活动性顺序对置换反应有什么意义?用铜、银、金等不活泼金属制造货币,可以防止生锈、被腐蚀等。
思考:用来铸造硬币的金属应具有什么性质?A:普通铁片,水、空气(潮湿空气)
B:普通铁片,空气(内有干燥剂)
C:普通铁片,蒸馏水 (无空气即缺氧)比较( B与A ,C与A ):铁锈蚀的外部条件是:_______________。同时具备空气和水。三、列举金属腐蚀条件没有
生
锈比较( D与A ):铁锈蚀的内部条件是:
_____。与内部结构有关D: 纯铁 , 水、空气(潮湿空气)金属的生锈的原因:1、与周围环境中的水和空气等物质的作用有关 。--外因
2、与金属内部的结构有关。--内因结论铁生锈实为缓慢氧化,方程式为:4Fe+3O2+2H2O= 2Fe2O3.H2O 即铁在潮湿有空气的环境里容易生锈,在干燥或缺氧(无空气)的条件下不易生锈2、金属的防锈的方法: 根据金属锈蚀的条件,讨论金属防护的
常用方法?1、保护膜法:(外部措施)A非金属覆盖层:刷油漆、上机油、喷塑、搪瓷C自身氧化物薄膜保护层: 钢铁制品在高温下经氧化,生成一层致密牢固的氧化膜,保护内部金属不再锈蚀。 “发黑”、“发蓝”——四氧化三铁B金属镀层:电镀。白铁(镀锌)-水桶 马口铁(镀锡)-罐头盖 自行车钢圈(镀铬、镍)2、改变金属内部结构法:(内部措施)
即制成合金,如制成不锈钢。
但价格贵,难以广泛应用先擦干,再上油四、废弃金属对环境的影响
1、日常生活废弃的金属垃圾;2、大量工业废弃的金属垃圾;3、工厂排出含重金属的污水。污染来源(一)、废弃金属(填埋)对环境的影响 1、铝等金属填埋后一般不会自行分解,会破坏土壤结构,影响土质2、 铅、镉等有毒金属被腐蚀后会溶于水形成金属离子,随雨水流入河中或渗入土层,污染土壤和地下水源 .
含铅、镉等有毒金属被腐蚀后,导致土壤和地下水源重金属污染。大量使用含铅汽油和废弃的电池都可引起土壤重金属污染。 目前我国的垃圾处理方法主要以填埋为主(二)、知道回收废弃金属的意义1、防止金属对土壤与水体的污染
2、资源再利用
3、节约能源所以,我国:
金属垃圾的回收可循环再生利用。防治金属污染方法1.垃圾进行分类回收2.分类回收各种废弃的金属材料。3.使用无铅汽油。4.废旧电池不能任意丢弃,做到回收利用。5.工业废水和废渣不能任意排放和堆放。五.新金属材料的发展:
⑴合金:将2种或2种以上的金属(或金属与非金属)熔合在一起形成的具有金属特性的物质。
⑵合金的性能:合金往往比金属具有更好的性能 :硬度更大,抗腐蚀、抗变形等能力更强。1)合金的导电性比各成分金属导电性都弱。2)合金的熔点比各成分金属熔点都低。3)合金强度或硬度比各成分金属都高。⑶常见的合金:铁合金、铝合金。钢:是最常见、应用最广的一种合金材料。成分:一种由铁和碳等元素组成的合金。机械性能好:质坚硬、有弹性和延展性,
可煅轧、压延、可铸造。用途:制作车身、刀具、量具、模具。注意:钢和铁的成分都是铁的合金,属于混合物。铁的合金:以碳的含量多少来区别.2%-4.3%0.3%-2%铁矿石、焦炭、 石灰石生铁高 炉电炉、平炉、转炉Fe2O3+3CO高温2Fe+3CO2(1)高温下,用氧化剂将过多的碳和其他杂质转变为气体和炉渣除去 (2)融入改善钢性能的合金元素硬而脆,无韧性坚硬,韧性大,弹性好 请写出“千锤百炼”(或“百炼成钢”)的方程式
———————— 制造飞机的材料中为什么大量使用铝合金而不用纯铝? 铝合金比纯铝密度小、强度大、尺寸稳定性好、吸震性好、散热快等。◆餐厅里的调味品盐、油、酱、醋(假设醋酸化学式可表示为HR),用小铝杯盛放着,你们认为这种做法合理吗?为什么?六、生活好帮手,巧用妙处多如果醋酸的化学式用HR表示,你能写出铝与醋酸(HR)反应的化学方程式吗?◆老农家的葡萄园里葡萄树“生病”了,为了给树冶病,他用铁桶将硫酸铜(CuSO4)、熟石灰加水配了大桶波尔多液以备随时杀菌之用。你们认为他这样做合理吗?为什么?◆为了除去铜粉中混有少量的铁粉,有人采用了这些方法,你们认为他的方法都合理吗?
(1)用磁铁吸
(2)放在石棉网上灼烧
(3)放入足量盐酸(HCl),再过滤 (4)放入硝酸铜溶液[Cu(NO3)2]中,再过滤思考:
1、能否用锡壶盛装酸性物质?为什么?2、用铁制的容器配制浸种用的波尔多液
(含硫酸铜)?为什么?不能,因为锡能跟酸反应。
Sn + 2HCl = SnCl2 + H2↑不能,铁能跟波尔多液反应。
Fe + CuSO4 = FeSO4 + Cu
两者的辨认主要从它们的性质差异入手,比如金属具有金属光泽、延展性、导电性、导热性等特点,而非金属则不具备这些性质。1、金属与非金属2、金属与非金属主要性质差异有金属光泽, 一般只有一种颜色不具金属光泽、
有多种颜色有较好的延展性不具延展性有可锻性不具可锻性一般硬度比较均匀硬度不一致良好的导电体一般不能导电良好的导热体一般导热能力差密度高密度低熔点高熔点低注意点: (1)金属一定能导电、导热, 但能导电导热的单质不一定是金属。如非金属石墨也能导电,也能导热。 (2)金属在常温下,除汞是液态外,一般都是固态。
非金属在常温下,除溴是液态外,一般都是气态或固态 。折断的是非金属分辨金属还是非金属做导电性实验能导电的是金属不能导电的是非金属放在光照处有特殊金属光泽的是金属单质无特殊光泽的是非金属单质在火上烤导热的是金属不导热的是非金属硬物单击可锻的是金属碎裂的是非金属用力拉伸长的是金属3、常见金属性质与用途的关系
人们常根据金属的一般属性和每种金属的独特性质,如:密度、外表、价格等来选择使用金属。像金常用于首饰行业,铜可做导线,铝可做铝罐,锡可镀铁器等等。性质 用途决定装饰品优质导线制保险丝制铁锅根据金属的特性列举它们的用途:硬度好做机械(菜刀、锤子、车床)熔点高灯丝钨金属的密度轻金属: 密度 < 4.5 g/cm3
重金属:密度 >4.5 g/cm3
铝、钾、镁、钙 等 铁、铜、铅、汞 等 铝 1.铝是化学性质比较活泼的金属,在地壳中含量占第三位,是地壳中含量最多的金属元素. 2.铝在自然界主要以化合态存在.如铝矿(Al2O3).明矾(KAl(SO4)2.12H2O)问1.铝为何具有很强的抗腐蚀能力? 常温下,铝在空气中表面能形成致密的氧化膜(Al2O3),保护铝不再被氧化腐蚀。化学方程式:4Al+3O2==2Al2O3问2:铝合金用于航天、航海方面的材料,
是利用它的哪些性质? 轻金属(密度小),强度大,抗腐蚀能力强,而且是非磁性体,但不耐高温。问3:铝已成为食品污染源,它在哪些方面的应用应加以控制?1、制炊具 2、明矾净水 3、明矾用作食品膨松剂 4、胃舒平治疗胃酸过多 5、易拉罐饮料 6、包装糖果……问4、新买的铝壶烧开水后,浸水部份为何变黑? 原因是铝与天然水中的铁盐.亚铁盐反应生成的黑色铁粉覆盖在铝表面反应方程式:Al+FeCl3==Fe+AlCl32Al+3FeCl2==3Fe+2AlCl3问5、为何不宜用钢刷来擦洗铝制餐具呢?若用钢刷擦洗铝制品,容易把氧化薄膜除掉,导致内部的铝进一步氧化,从而起不到保护作用。1、制造飞机和制造机器底座,对所用金属的密度和硬度会有什么要求? 2、电炉丝是用金属钨制成的,你认为它利用了钨的哪些性质? 导电性.导热性.熔点高3、制造飞机材料为何用铝合金而不用纯铝?4、为什么菜刀.镰刀.锤子等用铁制而不用铅制? 铁的硬度大,铅的硬度小纯铝质软,而铝合金强度大铁——第一金属钢铁是国民经济建设中最重要的材料
钢铁是世界上产量最大的金属钛——未来的第三金属银灰色,外形似钢
能承受剧烈温差——制作火箭发动机壳体、人造卫星外壳、导弹
表面易形成氧化物薄膜,抗腐蚀——核潜艇
对人体无毒,不与人体发生反应,与人体组织长成一体——医疗器械、人工关节、人工心瓣、人工齿根金属的活动性比较 金铜铁铝四兄弟
遇氧表现有差异。
常温见氧脸披纱; .
纯氧炉中火星射; .
火中见氧红变黑; .
此子不愧真君子, .
脸不改色心不跳。FeCuAlAuMg>Fe
Fe>Cu
一.金属与氧气的反应?火星四射,放出大量的热,黑色固体
?发出白光,放热,生成白色固体
由红色变为黑色? 点燃
3Fe+2O2==Fe3O4
??
点燃
2Mg+O2==2MgO
△
2Cu+O2==2CuO结论:
1.不同的金属与氧气的反应条
件不同. 2.与氧气反应条件的不同,说明金属
的化学活动性不同.二.金属的化学活动性顺序讨论:观察此图,你有何看法?金属活动性由强逐渐减弱 (失电子由易到难)金属活动性顺序表练习:等质量的A,B,C三种金属分别与质量相同,质量分数也相同的稀硫酸充分反应放出氢气的情况如下图所示:AC判断:1 活动性最强的金属是2 活动性最弱的金属是3 反应不再发生时,最先用完的一种物质是( )( )( )硫酸4、谁过量金属 相同质量的下列金属与足量的稀盐酸反应,产生氢气最多的是( ) A Zn B Fe C Mg D Al D 将一瓶盐酸等分成三份,分别跟等质量的Al 、Fe、 Zn反应后,三种金属都有剩余,且剩余金属的质量Al >Fe> Zn,若生成氢气的质量分别为a、b、c,则其间的关系是( ) A a
________________________________________________________将铁钉投入到硫酸铜溶液中有何现象? 铁钉表面会有红色物质析出,若时间足够
长,则溶液会从蓝色变为浅绿色。Fe + CuSO4 = Cu + FeSO4 该反应的化学方程式:回忆:活动性:Fe﹥Cu根据刚才的实验填写表格上述反应的共同特征1、反应物和产物都只有两种;2、反应物是单质和化合物,产物也是单质和化合物;结论:置换反应:特点:单质+化合物 → 单质+化合物(一)判断金属跟盐溶液能否发生置换反应。 在金属活动性顺序中,只有一种活动性较强的金属才能把另一种活性较弱的金属从它的盐溶液中置换出来。
在金属活动顺序里,位于前面的金属能把位于后面的金属从它们盐溶液中置换出来。金属+ 可溶性的盐 = 金属 + 盐1.单质金属要排在盐中金属元素前面2.盐必须是可溶性,即是溶液。3.K Ca Na与盐溶液混合时,要先跟水反应。B下列反应的化学方程式中,正确的是( )A. Cu+2AgCl=2Ag+CuCl2B. Zn+2AgNO3=2Ag+Zn(NO3)2C. 2Na+CuSO4=Cu+Na2SO4D. 2Fe+3CuCl2=2FeCl3+3Cu 把混有少量氧化铜粉末的铁粉,放入盛稀硫酸的烧杯中,充分反应后,有部分铁剩余,过滤,滤液中含有的溶质是 ( )
A H2SO4 B CuSO4和FeSO4
C H2SO4和FeSO4 D 只有FeSO4D(二)判断金属跟混合盐溶液反应的次序。 (一般来说)反应的先后次序是: 在金属活动性顺序中,排在越后面的金属,越易从它们的盐溶液里被置换出来。
或者说:金属活动性相差越大,置换反应越易发生。一、金属的化学性质:
1、与氧气反应
(金属越活泼,反应越容易,越剧烈)
2、氢前金属+盐酸(稀硫酸)(置换反应)
(金属越活泼,反应越容易,越剧烈)
3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。
二、置换反应(A+BC==B+AC)
三、金属活动顺序及其应用
(判断金属能否在溶液中发生置换反应,及反应的快慢) 将一定质量的铁粉放入足量相同质量分数的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是( )A. Fe B. Cu C. AgC 将少量铁粉和铜粉加入一定量的硝酸银溶液中充分反应后过滤。取少量滤液,在其中滴加稀盐酸,结果出现了白色沉淀。判断滤液中存在什么金属离子?滤纸上有什么物质? 要验证镁、铁、铜三种金属的活动性顺序,可选用哪组物质进行反应( )
A 铁、铜、氯化镁溶液
B 铁、硫酸铜溶液、氯化镁溶液
C 铜、氯化锌溶液、氯化亚铁溶液 D 镁、氯化铜溶液、氯化亚铁溶液
E 镁、铜、氯化亚铁溶液B E讨论:
金属活动性顺序对置换反应有什么意义?用铜、银、金等不活泼金属制造货币,可以防止生锈、被腐蚀等。
思考:用来铸造硬币的金属应具有什么性质?A:普通铁片,水、空气(潮湿空气)
B:普通铁片,空气(内有干燥剂)
C:普通铁片,蒸馏水 (无空气即缺氧)比较( B与A ,C与A ):铁锈蚀的外部条件是:_______________。同时具备空气和水。三、列举金属腐蚀条件没有
生
锈比较( D与A ):铁锈蚀的内部条件是:
_____。与内部结构有关D: 纯铁 , 水、空气(潮湿空气)金属的生锈的原因:1、与周围环境中的水和空气等物质的作用有关 。--外因
2、与金属内部的结构有关。--内因结论铁生锈实为缓慢氧化,方程式为:4Fe+3O2+2H2O= 2Fe2O3.H2O 即铁在潮湿有空气的环境里容易生锈,在干燥或缺氧(无空气)的条件下不易生锈2、金属的防锈的方法: 根据金属锈蚀的条件,讨论金属防护的
常用方法?1、保护膜法:(外部措施)A非金属覆盖层:刷油漆、上机油、喷塑、搪瓷C自身氧化物薄膜保护层: 钢铁制品在高温下经氧化,生成一层致密牢固的氧化膜,保护内部金属不再锈蚀。 “发黑”、“发蓝”——四氧化三铁B金属镀层:电镀。白铁(镀锌)-水桶 马口铁(镀锡)-罐头盖 自行车钢圈(镀铬、镍)2、改变金属内部结构法:(内部措施)
即制成合金,如制成不锈钢。
但价格贵,难以广泛应用先擦干,再上油四、废弃金属对环境的影响
1、日常生活废弃的金属垃圾;2、大量工业废弃的金属垃圾;3、工厂排出含重金属的污水。污染来源(一)、废弃金属(填埋)对环境的影响 1、铝等金属填埋后一般不会自行分解,会破坏土壤结构,影响土质2、 铅、镉等有毒金属被腐蚀后会溶于水形成金属离子,随雨水流入河中或渗入土层,污染土壤和地下水源 .
含铅、镉等有毒金属被腐蚀后,导致土壤和地下水源重金属污染。大量使用含铅汽油和废弃的电池都可引起土壤重金属污染。 目前我国的垃圾处理方法主要以填埋为主(二)、知道回收废弃金属的意义1、防止金属对土壤与水体的污染
2、资源再利用
3、节约能源所以,我国:
金属垃圾的回收可循环再生利用。防治金属污染方法1.垃圾进行分类回收2.分类回收各种废弃的金属材料。3.使用无铅汽油。4.废旧电池不能任意丢弃,做到回收利用。5.工业废水和废渣不能任意排放和堆放。五.新金属材料的发展:
⑴合金:将2种或2种以上的金属(或金属与非金属)熔合在一起形成的具有金属特性的物质。
⑵合金的性能:合金往往比金属具有更好的性能 :硬度更大,抗腐蚀、抗变形等能力更强。1)合金的导电性比各成分金属导电性都弱。2)合金的熔点比各成分金属熔点都低。3)合金强度或硬度比各成分金属都高。⑶常见的合金:铁合金、铝合金。钢:是最常见、应用最广的一种合金材料。成分:一种由铁和碳等元素组成的合金。机械性能好:质坚硬、有弹性和延展性,
可煅轧、压延、可铸造。用途:制作车身、刀具、量具、模具。注意:钢和铁的成分都是铁的合金,属于混合物。铁的合金:以碳的含量多少来区别.2%-4.3%0.3%-2%铁矿石、焦炭、 石灰石生铁高 炉电炉、平炉、转炉Fe2O3+3CO高温2Fe+3CO2(1)高温下,用氧化剂将过多的碳和其他杂质转变为气体和炉渣除去 (2)融入改善钢性能的合金元素硬而脆,无韧性坚硬,韧性大,弹性好 请写出“千锤百炼”(或“百炼成钢”)的方程式
———————— 制造飞机的材料中为什么大量使用铝合金而不用纯铝? 铝合金比纯铝密度小、强度大、尺寸稳定性好、吸震性好、散热快等。◆餐厅里的调味品盐、油、酱、醋(假设醋酸化学式可表示为HR),用小铝杯盛放着,你们认为这种做法合理吗?为什么?六、生活好帮手,巧用妙处多如果醋酸的化学式用HR表示,你能写出铝与醋酸(HR)反应的化学方程式吗?◆老农家的葡萄园里葡萄树“生病”了,为了给树冶病,他用铁桶将硫酸铜(CuSO4)、熟石灰加水配了大桶波尔多液以备随时杀菌之用。你们认为他这样做合理吗?为什么?◆为了除去铜粉中混有少量的铁粉,有人采用了这些方法,你们认为他的方法都合理吗?
(1)用磁铁吸
(2)放在石棉网上灼烧
(3)放入足量盐酸(HCl),再过滤 (4)放入硝酸铜溶液[Cu(NO3)2]中,再过滤思考:
1、能否用锡壶盛装酸性物质?为什么?2、用铁制的容器配制浸种用的波尔多液
(含硫酸铜)?为什么?不能,因为锡能跟酸反应。
Sn + 2HCl = SnCl2 + H2↑不能,铁能跟波尔多液反应。
Fe + CuSO4 = FeSO4 + Cu
