沪教版九年级化学2.1性质活泼的氧气课件(29张ppt)
文档属性
| 名称 | 沪教版九年级化学2.1性质活泼的氧气课件(29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-05-01 20:33:52 | ||
图片预览





文档简介
课件29张PPT。九年级化学沪教版·全一册第2章
身边的化学物质第1节 性质活泼的氧气授课人:XXXX 请同学们观察,并猜测氧气有哪些物理性质呢?一、认识氧气的性质有什么事实能证明自然界的水中溶有氧气?问题讨论 :二、新课讲解
一、新课讲解
1.氧气的物理性质 (1)在通常情况下,氧气是一种无色、无气味的气体;
(2)密度稍大于空气:(3)氧气不易溶于水; ①可用向上排空气法收集;可用排水法收集; ②盖上玻片,正放于桌上。(4)氧气有三态变化:
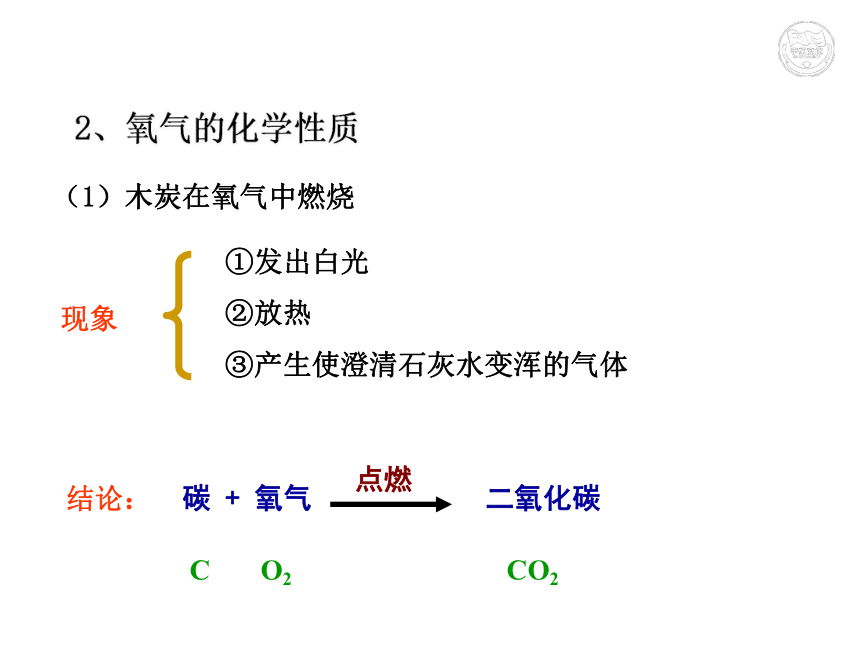
(无) (淡蓝色) (淡蓝色雪花状)属于纯净物拓展:标准状况是指:__________________。通常状况是指:__________________。0℃,1.01×105Pa20℃,1.01×105Pa(1)木炭在氧气中燃烧 现象结论:①发出白光
②放热
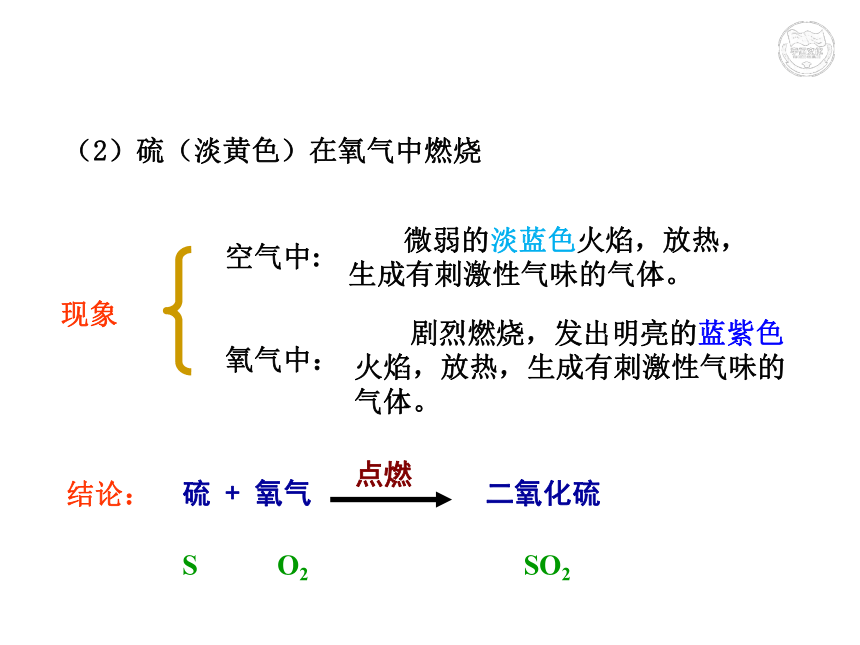
③产生使澄清石灰水变浑的气体碳 + 氧气 二氧化碳点燃 C O2 CO22、氧气的化学性质(2)硫(淡黄色)在氧气中燃烧 现象结论:空气中:
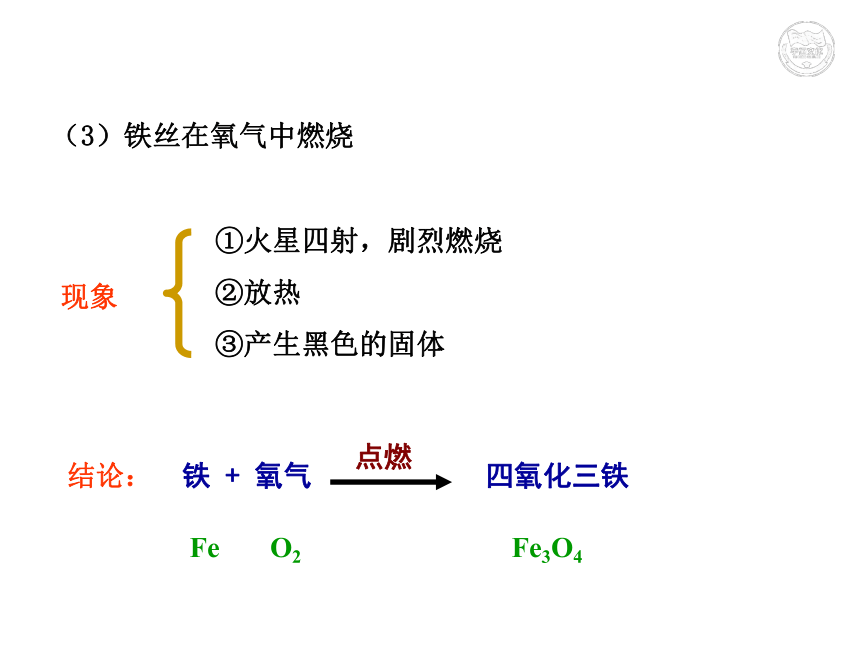
氧气中:硫 + 氧气 二氧化硫点燃 S O2 SO2 微弱的淡蓝色火焰,放热,生成有刺激性气味的气体。 剧烈燃烧,发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体。(3)铁丝在氧气中燃烧 现象结论:铁 + 氧气 四氧化三铁点燃 Fe O2 Fe3O4①火星四射,剧烈燃烧
②放热
③产生黑色的固体(4)蜡烛在氧气中燃烧 现象结论:①发出白光
②放热
③产生使澄清石灰水变浑的气体
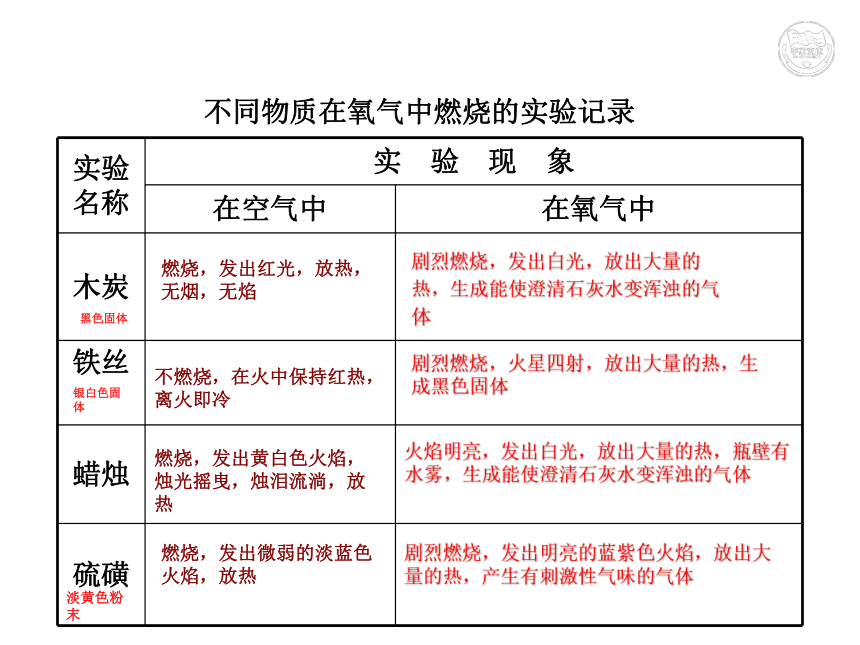
④集气瓶内壁有小水滴石蜡+氧气 二氧化碳+水点燃 不同物质在氧气中燃烧的实验记录燃烧,发出红光,放热,无烟,无焰剧烈燃烧,发出白光,放出大量的
热,生成能使澄清石灰水变浑浊的气
体不燃烧,在火中保持红热,离火即冷剧烈燃烧,火星四射,放出大量的热,生成黑色固体燃烧,发出黄白色火焰,烛光摇曳,烛泪流淌,放热火焰明亮,发出白光,放出大量的热,瓶壁有水雾,生成能使澄清石灰水变浑浊的气体燃烧,发出微弱的淡蓝色火焰,放热剧烈燃烧,发出明亮的蓝紫色火焰,放出大量的热,产生有刺激性气味的气体黑色固体银白色固体淡黄色粉末CO2CO2O2SSO2O2FeFe3O4O2H2OCO2反应的文字表达式:O2PP2O5O2MgMgO归纳:氧气的化学性质⑶ 可燃物在氧气中燃烧通常比在空气中剧烈;⑷ 某些在空气中不能燃烧的物质,在氧气中却可以燃烧,而且燃烧很剧烈。因为氧气的浓度不同⑵ 支持燃烧(助燃)、不可燃⑴ 氧气的化学性质比较活泼,能和许多物质发生氧化反应;3、氧化反应剧烈氧化缓慢氧化如:燃烧等如:橡胶老化、新陈代谢、金属锈蚀、食物的腐烂、有机物的腐熟等(物质跟氧气发
生的化学反应)剧烈氧化和缓慢氧化的相同点与不同点?相同点:不同点:讨论:化学反应、氧化反应、放热。剧烈程度和放热速度不同;缓慢氧
化无光、无焰。 缓慢氧化与自燃 缓慢氧化释放出的热量不断积聚,当温度超过可燃物的着火点时,就引发了可燃物的自发燃烧,即自燃。二、氧气的用途1、自然界氧气的获得:绿色植物的光合作用2、氧气工业制法:分离液态空气法
三、氧气的制法(利用二者沸点不同,该过程是物理变化)3、实验室加热高锰酸钾制取氧气(1)原理:KMnO4K2MnO4MnO2O2(2)装置:(3)操作步骤: ①按要求组装好仪器后检查装置的气密性;②将高锰酸钾装入试管里,并在试管口放一团棉花,用
带有导管的塞子塞紧试管口;④点燃酒精灯,给试管均匀加热后再集中加热;⑤等气泡连续均匀放出时用排水法收集氧气,并将收集好的集气瓶盖上玻片后正放在桌上;⑥实验完毕,将导管移离水面;⑦熄灭酒精灯,停止加热。 ③把试管口略向下倾斜固定在铁架台上 ;茶(查)庄(装)定点收利(离)息(熄)(4) 检验方法: 将带火星的木条伸入集气瓶内,若木条复燃,则瓶内装的是氧气。排水法:向上排空气法:(5) 验满方法: 当集气瓶口有气泡逸出时, 证明已集满。将带火星的木条伸至集气瓶口,复燃则满。不易溶于水,且常温下不与水反应密度稍大于空气且不与空气反应1、试管口要略向下倾斜,防止冷凝水倒流使试管炸裂。2、试管口要放一团棉花,防止高锰酸钾粉末进入导管。6、停止加热时,要先将导管从水槽取出,然后再熄灭酒精灯,防止试管冷却后水槽里的水倒流使试管炸裂。(6) 注意事项:3、导管伸入试管时稍露出橡皮塞即可,以便于气体排出。4、用排水法集气时,应等气泡连续、均匀冒出时再收集,
以免收集的气体中混有空气。5、用向上排空气法集气时,应将导管伸到集气瓶底
部,赶尽空气,以免气体不纯。4、实验室分解双氧水制取氧气(1)原理:(2)装置:(3)操作步骤: ①按要求组装好仪器后检查装置的气密性。②将二氧化锰放入锥形瓶中,塞紧橡皮塞。④等气泡连续均匀放出时用排水法收集氧气,并将收集好的集气瓶正放在桌上。③打开分液漏斗的开关,滴加双氧水。 可简单归纳为:“茶、庄、定、收、离催化剂:能改变其它物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质 。催化作用:催化剂在化学反应中起的作用“一变”“两不变”固固加热型固液不加热型双氧水制氧气与高锰酸钾制氧气相比具有的优点:2、产物无污染;3、不需要加热,节约能源。1、操作简单;思考:加热拓展:二、归纳小结
氧气只占空气体积分数的21%,但地球上的动植物都离不开氧气,物质的燃烧也需要消耗氧气。三、强化训练
1.工业上制取大量氧气的方法是( )
A.加热氯酸钾 B.加热高锰酸钾
C.分离液态空气 D.加热二氧化锰
2.催化剂在化学反应中所起的作用是( )
A.加快化学反应速率
B.使生成物质量增加
C.改变化学反应速率
D.减慢化学反应速率CC3.下列说法中正确的是( )
A.在过氧化氢催化分解的反应中,二氧化锰起催化作用
B.氧气的化学性质很活泼,在常温下能与所有物质发生化学反应
C.工业上分离液态空气制氧气的过程属于化学变化
D.没有二氧化锰作催化剂,过氧化氢溶液就不会产生氧气A本课结束
一、新课讲解
1.氧气的物理性质 (1)在通常情况下,氧气是一种无色、无气味的气体;
(2)密度稍大于空气:(3)氧气不易溶于水; ①可用向上排空气法收集;可用排水法收集; ②盖上玻片,正放于桌上。(4)氧气有三态变化:
(无) (淡蓝色) (淡蓝色雪花状)属于纯净物拓展:标准状况是指:__________________。通常状况是指:__________________。0℃,1.01×105Pa20℃,1.01×105Pa(1)木炭在氧气中燃烧 现象结论:①发出白光
②放热
③产生使澄清石灰水变浑的气体碳 + 氧气 二氧化碳点燃 C O2 CO22、氧气的化学性质(2)硫(淡黄色)在氧气中燃烧 现象结论:空气中:
氧气中:硫 + 氧气 二氧化硫点燃 S O2 SO2 微弱的淡蓝色火焰,放热,生成有刺激性气味的气体。 剧烈燃烧,发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体。(3)铁丝在氧气中燃烧 现象结论:铁 + 氧气 四氧化三铁点燃 Fe O2 Fe3O4①火星四射,剧烈燃烧
②放热
③产生黑色的固体(4)蜡烛在氧气中燃烧 现象结论:①发出白光
②放热
③产生使澄清石灰水变浑的气体
④集气瓶内壁有小水滴石蜡+氧气 二氧化碳+水点燃 不同物质在氧气中燃烧的实验记录燃烧,发出红光,放热,无烟,无焰剧烈燃烧,发出白光,放出大量的
热,生成能使澄清石灰水变浑浊的气
体不燃烧,在火中保持红热,离火即冷剧烈燃烧,火星四射,放出大量的热,生成黑色固体燃烧,发出黄白色火焰,烛光摇曳,烛泪流淌,放热火焰明亮,发出白光,放出大量的热,瓶壁有水雾,生成能使澄清石灰水变浑浊的气体燃烧,发出微弱的淡蓝色火焰,放热剧烈燃烧,发出明亮的蓝紫色火焰,放出大量的热,产生有刺激性气味的气体黑色固体银白色固体淡黄色粉末CO2CO2O2SSO2O2FeFe3O4O2H2OCO2反应的文字表达式:O2PP2O5O2MgMgO归纳:氧气的化学性质⑶ 可燃物在氧气中燃烧通常比在空气中剧烈;⑷ 某些在空气中不能燃烧的物质,在氧气中却可以燃烧,而且燃烧很剧烈。因为氧气的浓度不同⑵ 支持燃烧(助燃)、不可燃⑴ 氧气的化学性质比较活泼,能和许多物质发生氧化反应;3、氧化反应剧烈氧化缓慢氧化如:燃烧等如:橡胶老化、新陈代谢、金属锈蚀、食物的腐烂、有机物的腐熟等(物质跟氧气发
生的化学反应)剧烈氧化和缓慢氧化的相同点与不同点?相同点:不同点:讨论:化学反应、氧化反应、放热。剧烈程度和放热速度不同;缓慢氧
化无光、无焰。 缓慢氧化与自燃 缓慢氧化释放出的热量不断积聚,当温度超过可燃物的着火点时,就引发了可燃物的自发燃烧,即自燃。二、氧气的用途1、自然界氧气的获得:绿色植物的光合作用2、氧气工业制法:分离液态空气法
三、氧气的制法(利用二者沸点不同,该过程是物理变化)3、实验室加热高锰酸钾制取氧气(1)原理:KMnO4K2MnO4MnO2O2(2)装置:(3)操作步骤: ①按要求组装好仪器后检查装置的气密性;②将高锰酸钾装入试管里,并在试管口放一团棉花,用
带有导管的塞子塞紧试管口;④点燃酒精灯,给试管均匀加热后再集中加热;⑤等气泡连续均匀放出时用排水法收集氧气,并将收集好的集气瓶盖上玻片后正放在桌上;⑥实验完毕,将导管移离水面;⑦熄灭酒精灯,停止加热。 ③把试管口略向下倾斜固定在铁架台上 ;茶(查)庄(装)定点收利(离)息(熄)(4) 检验方法: 将带火星的木条伸入集气瓶内,若木条复燃,则瓶内装的是氧气。排水法:向上排空气法:(5) 验满方法: 当集气瓶口有气泡逸出时, 证明已集满。将带火星的木条伸至集气瓶口,复燃则满。不易溶于水,且常温下不与水反应密度稍大于空气且不与空气反应1、试管口要略向下倾斜,防止冷凝水倒流使试管炸裂。2、试管口要放一团棉花,防止高锰酸钾粉末进入导管。6、停止加热时,要先将导管从水槽取出,然后再熄灭酒精灯,防止试管冷却后水槽里的水倒流使试管炸裂。(6) 注意事项:3、导管伸入试管时稍露出橡皮塞即可,以便于气体排出。4、用排水法集气时,应等气泡连续、均匀冒出时再收集,
以免收集的气体中混有空气。5、用向上排空气法集气时,应将导管伸到集气瓶底
部,赶尽空气,以免气体不纯。4、实验室分解双氧水制取氧气(1)原理:(2)装置:(3)操作步骤: ①按要求组装好仪器后检查装置的气密性。②将二氧化锰放入锥形瓶中,塞紧橡皮塞。④等气泡连续均匀放出时用排水法收集氧气,并将收集好的集气瓶正放在桌上。③打开分液漏斗的开关,滴加双氧水。 可简单归纳为:“茶、庄、定、收、离催化剂:能改变其它物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质 。催化作用:催化剂在化学反应中起的作用“一变”“两不变”固固加热型固液不加热型双氧水制氧气与高锰酸钾制氧气相比具有的优点:2、产物无污染;3、不需要加热,节约能源。1、操作简单;思考:加热拓展:二、归纳小结
氧气只占空气体积分数的21%,但地球上的动植物都离不开氧气,物质的燃烧也需要消耗氧气。三、强化训练
1.工业上制取大量氧气的方法是( )
A.加热氯酸钾 B.加热高锰酸钾
C.分离液态空气 D.加热二氧化锰
2.催化剂在化学反应中所起的作用是( )
A.加快化学反应速率
B.使生成物质量增加
C.改变化学反应速率
D.减慢化学反应速率CC3.下列说法中正确的是( )
A.在过氧化氢催化分解的反应中,二氧化锰起催化作用
B.氧气的化学性质很活泼,在常温下能与所有物质发生化学反应
C.工业上分离液态空气制氧气的过程属于化学变化
D.没有二氧化锰作催化剂,过氧化氢溶液就不会产生氧气A本课结束
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
