广东省深圳市耀华实验学校2017-2018学年高一(实验班)下学期期中考试化学试题
文档属性
| 名称 | 广东省深圳市耀华实验学校2017-2018学年高一(实验班)下学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 253.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
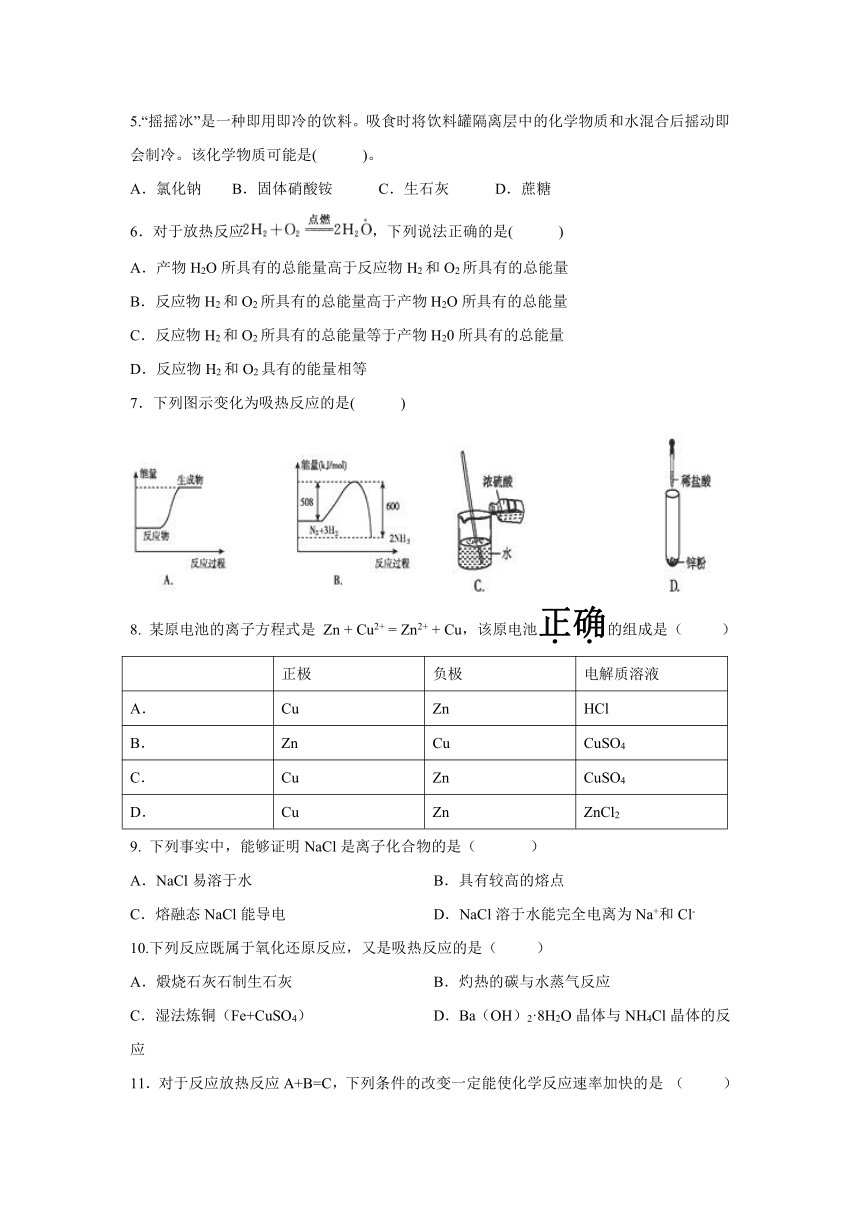
| 科目 | 化学 | ||
| 更新时间 | 2018-05-08 07:32:46 | ||
图片预览


文档简介
绝密★启用前
2017-2018学年第二学期期中考试
高一年级化学试题卷
2018.4
本试卷共2页,18小题,满分100分.考试用时50分钟.
注意事项:
1.答卷前,考生先检查试卷与答题卷是否整洁无缺损,并用黑色字迹的签字笔在答题卷指定位置填写自己的班级、姓名、学号和座位号。
2.选择题每小题选出答案后,请将答案填写在答题卷上对应的题目序号后,如需改动,用橡皮擦干净后,再选涂其它答案,答案不能答在试卷上。不按要求填涂的,答案无效。
3.非选择题必须用黑色字迹的签字笔作答,答案必须写在答题卷各题目指定区域内相应位置上,请注意每题答题空间,预先合理安排;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卷的整洁,考试结束后,将答题卷交回。
相对原子质量:H:1 C:12 O:16 Na: 23 Cl:35.5 S:32 Mg:24 Al:27 N:14 Fe:56
一、单项选择题:每小题只有一个选项符合题意,本大题共14小题,每小题3分,满分42分。
1.下列元素中,最高正化合价数值最大的是( )
A.C B.F C.S D.Cl
2.元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
A.元素原子的核外电子排布呈周期性变化 B.元素的原子半径呈周期性变化
C.元素的化合价呈周期性变化 D.元素的金属性、非金属性呈周期性变化
3.下列事实不能说明非金属性Cl>I的是( )
A.Cl2+2I- == 2Cl-+I2 B.稳定性:HCl>HI
C.酸性:HClO4>HIO4 D.酸性:HClO3>HIO3
4.下列不含有共价键的化合物是( )
A.HI B. NaOH C. Br2 D. NaCl
5.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质可能是( )。
A.氯化钠 B.固体硝酸铵 C.生石灰 D.蔗糖
6.对于放热反应,下列说法正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H20所具有的总能量
D.反应物H2和O2具有的能量相等
7.下列图示变化为吸热反应的是( )
8. 某原电池的离子方程式是 Zn + Cu2+ = Zn2+ + Cu,该原电池正确的组成是( )
正极
负极
电解质溶液
A.
Cu
Zn
HCl
B.
Zn
Cu
CuSO4
C.
Cu
Zn
CuSO4
D.
Cu
Zn
ZnCl2
9. 下列事实中,能够证明NaCl是离子化合物的是( )
A.NaCl易溶于水 B.具有较高的熔点
C.熔融态NaCl能导电 D.NaCl溶于水能完全电离为Na+和Cl-
10.下列反应既属于氧化还原反应,又是吸热反应的是( )
A.煅烧石灰石制生石灰 B.灼热的碳与水蒸气反应
C.湿法炼铜(Fe+CuSO4) D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
11.对于反应放热反应A+B=C,下列条件的改变一定能使化学反应速率加快的是 ( )
A.增加A的物质的量 B.升高体系温度 C.增加体系压强 D.降低体系温度
12. 关于化学键的下列叙述中,正确的是( )
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物中不含共价键
13. 现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生:N2+3H22NH3。下列有关说法正确的是 ( )
A.达到化学反应最大限度时,正反应和逆反应的速率都为零
B.当符合:3?正?N2?=?正?H2?时,反应达到最大限度
C.达到化学最大限度时,单位时间消耗a mol N2,同时生成3a mol H2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到最大限度态
14.已知反应:2X(g)+Y(g)2Z(g)。某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到如下表数据:
t(min)
2
4.5
5
6
X转化率
30%
40%
70%
70%
根据以上信息作出的下列判断中正确的是 ( )
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5 min时,v正(X)=v逆(Z)
C.6 min时,容器中剩余1.4 mol Y
D.其他条件不变,将X的物质的量改为10 mol,则可得4 mol Z
二、非选择题:本大题共4小题,满分58分。
15. (每空3分,共18分)I.中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
(1)该电池工作时,负极的电极反应式为CH3OH-6e- +H2O=CO2+6H+ 。仔细观察图,则 b口通入的物质为__________,c口通入的物质为__________。a口流出的物质为 。
(2)该电池正极的电极反应式为:__________________________________________________。
Ⅱ.某温度时,在一个2L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示。据图中数据,试填写下列空白:
(1)该反应的化学方程式为______________________________。
(2)从开始至4min,N的平均反应速率为__________4min末M的转化率为____________________。
16.(每空3分,共15分)X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X
Y
Z
W
R
P
Q
原子半径/nm
0.154
0.074
0.099
0.075
0.143
主要化合价
-4,+4
-2
-1、+7
-3、+5
+3
其他
阳离子核外无电子
无机非金属材料的主角
焰色反应呈黄色
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为________ ;
(2)Z的单质与水反应的化学方程式是____________________________;
(3)Y与R相比,非金属性较强的是___________(用元素符号表示)。
(4)反应3X2(g)+P2(g)=2PX3(g)过程中的能量变化如图所示,回答下列问题。
该反应是______反应(填“吸热” “放热”);该反应的△H=_______________;
17.(每空3分,共15分)铝、镁、铜在不同的电解质溶液分别构成原电池A、B、C如图所示,回答下列问题:
(1)指出两池的负极材料:A池______; B池_______;C池 。(填元素符号)
(2)写出B池两极的电极方程式:B池:正极_______________ ,负极_______________ ;
18.(共10分)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 4NO2(g)+ O2(g)。
反应5min后,测得N2O5转化了20%,求:(1)V(NO2)、V(O2)分别为多少?(2)5min时,N2O5物质的量浓度是多少?
2017-2018学年第二学期期中考试
高一年级化学答案
一、选择题每小题3分,满分42分
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
D
A
D
D
B
B
A
C
C
B
B
A
C
B
二、非选择题 共58分。
15.(每空3分,共18分)Ⅰ.(1)CH3OH(3分),O2或空气(3分) CO2 (2)O2+4H++4e-=2H2O(3分)
Ⅱ.(1)M+N2W(3分)(2)0.05mol/(L·min)(3分); 33.3%(3分)
16.(每空3分,共15分) (1).同位素 (2).2Na+2H2O=2NaOH+H2↑
(3).Cl (4).放热 E1-E2
17.(每空3分,共15分)(1)Mg; Al; Cu (2) 6H2O+6e-==3H2↑+6OH-;
2Al-6e-+8OH-==2AlO+4H2O
18.(共10分).(1)V(NO2)=0 .16mol/(L·min)V(O2)=0.O4 mol/(L·min)
(2)1.6 mol/L
2017-2018学年第二学期期中考试
高一年级化学试题卷
2018.4
本试卷共2页,18小题,满分100分.考试用时50分钟.
注意事项:
1.答卷前,考生先检查试卷与答题卷是否整洁无缺损,并用黑色字迹的签字笔在答题卷指定位置填写自己的班级、姓名、学号和座位号。
2.选择题每小题选出答案后,请将答案填写在答题卷上对应的题目序号后,如需改动,用橡皮擦干净后,再选涂其它答案,答案不能答在试卷上。不按要求填涂的,答案无效。
3.非选择题必须用黑色字迹的签字笔作答,答案必须写在答题卷各题目指定区域内相应位置上,请注意每题答题空间,预先合理安排;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卷的整洁,考试结束后,将答题卷交回。
相对原子质量:H:1 C:12 O:16 Na: 23 Cl:35.5 S:32 Mg:24 Al:27 N:14 Fe:56
一、单项选择题:每小题只有一个选项符合题意,本大题共14小题,每小题3分,满分42分。
1.下列元素中,最高正化合价数值最大的是( )
A.C B.F C.S D.Cl
2.元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
A.元素原子的核外电子排布呈周期性变化 B.元素的原子半径呈周期性变化
C.元素的化合价呈周期性变化 D.元素的金属性、非金属性呈周期性变化
3.下列事实不能说明非金属性Cl>I的是( )
A.Cl2+2I- == 2Cl-+I2 B.稳定性:HCl>HI
C.酸性:HClO4>HIO4 D.酸性:HClO3>HIO3
4.下列不含有共价键的化合物是( )
A.HI B. NaOH C. Br2 D. NaCl
5.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质可能是( )。
A.氯化钠 B.固体硝酸铵 C.生石灰 D.蔗糖
6.对于放热反应,下列说法正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H20所具有的总能量
D.反应物H2和O2具有的能量相等
7.下列图示变化为吸热反应的是( )
8. 某原电池的离子方程式是 Zn + Cu2+ = Zn2+ + Cu,该原电池正确的组成是( )
正极
负极
电解质溶液
A.
Cu
Zn
HCl
B.
Zn
Cu
CuSO4
C.
Cu
Zn
CuSO4
D.
Cu
Zn
ZnCl2
9. 下列事实中,能够证明NaCl是离子化合物的是( )
A.NaCl易溶于水 B.具有较高的熔点
C.熔融态NaCl能导电 D.NaCl溶于水能完全电离为Na+和Cl-
10.下列反应既属于氧化还原反应,又是吸热反应的是( )
A.煅烧石灰石制生石灰 B.灼热的碳与水蒸气反应
C.湿法炼铜(Fe+CuSO4) D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
11.对于反应放热反应A+B=C,下列条件的改变一定能使化学反应速率加快的是 ( )
A.增加A的物质的量 B.升高体系温度 C.增加体系压强 D.降低体系温度
12. 关于化学键的下列叙述中,正确的是( )
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物中不含共价键
13. 现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生:N2+3H22NH3。下列有关说法正确的是 ( )
A.达到化学反应最大限度时,正反应和逆反应的速率都为零
B.当符合:3?正?N2?=?正?H2?时,反应达到最大限度
C.达到化学最大限度时,单位时间消耗a mol N2,同时生成3a mol H2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到最大限度态
14.已知反应:2X(g)+Y(g)2Z(g)。某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到如下表数据:
t(min)
2
4.5
5
6
X转化率
30%
40%
70%
70%
根据以上信息作出的下列判断中正确的是 ( )
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5 min时,v正(X)=v逆(Z)
C.6 min时,容器中剩余1.4 mol Y
D.其他条件不变,将X的物质的量改为10 mol,则可得4 mol Z
二、非选择题:本大题共4小题,满分58分。
15. (每空3分,共18分)I.中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
(1)该电池工作时,负极的电极反应式为CH3OH-6e- +H2O=CO2+6H+ 。仔细观察图,则 b口通入的物质为__________,c口通入的物质为__________。a口流出的物质为 。
(2)该电池正极的电极反应式为:__________________________________________________。
Ⅱ.某温度时,在一个2L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示。据图中数据,试填写下列空白:
(1)该反应的化学方程式为______________________________。
(2)从开始至4min,N的平均反应速率为__________4min末M的转化率为____________________。
16.(每空3分,共15分)X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X
Y
Z
W
R
P
Q
原子半径/nm
0.154
0.074
0.099
0.075
0.143
主要化合价
-4,+4
-2
-1、+7
-3、+5
+3
其他
阳离子核外无电子
无机非金属材料的主角
焰色反应呈黄色
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为________ ;
(2)Z的单质与水反应的化学方程式是____________________________;
(3)Y与R相比,非金属性较强的是___________(用元素符号表示)。
(4)反应3X2(g)+P2(g)=2PX3(g)过程中的能量变化如图所示,回答下列问题。
该反应是______反应(填“吸热” “放热”);该反应的△H=_______________;
17.(每空3分,共15分)铝、镁、铜在不同的电解质溶液分别构成原电池A、B、C如图所示,回答下列问题:
(1)指出两池的负极材料:A池______; B池_______;C池 。(填元素符号)
(2)写出B池两极的电极方程式:B池:正极_______________ ,负极_______________ ;
18.(共10分)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 4NO2(g)+ O2(g)。
反应5min后,测得N2O5转化了20%,求:(1)V(NO2)、V(O2)分别为多少?(2)5min时,N2O5物质的量浓度是多少?
2017-2018学年第二学期期中考试
高一年级化学答案
一、选择题每小题3分,满分42分
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
D
A
D
D
B
B
A
C
C
B
B
A
C
B
二、非选择题 共58分。
15.(每空3分,共18分)Ⅰ.(1)CH3OH(3分),O2或空气(3分) CO2 (2)O2+4H++4e-=2H2O(3分)
Ⅱ.(1)M+N2W(3分)(2)0.05mol/(L·min)(3分); 33.3%(3分)
16.(每空3分,共15分) (1).同位素 (2).2Na+2H2O=2NaOH+H2↑
(3).Cl (4).放热 E1-E2
17.(每空3分,共15分)(1)Mg; Al; Cu (2) 6H2O+6e-==3H2↑+6OH-;
2Al-6e-+8OH-==2AlO+4H2O
18.(共10分).(1)V(NO2)=0 .16mol/(L·min)V(O2)=0.O4 mol/(L·min)
(2)1.6 mol/L
同课章节目录
