人教版高中化学必修一4.3.1《二氧化硫》获奖课件(30张)
文档属性
| 名称 | 人教版高中化学必修一4.3.1《二氧化硫》获奖课件(30张) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-05-09 21:40:01 | ||
图片预览











文档简介
(共30张PPT)
二 氧 化 硫
根据硫的化合价,写出它的氧化物和氢化物的化学式:
SO2 、 SO3 、 H2S
请开动你聪明的脑筋
一、二氧化硫的性质
(一) 物理性质
无色 刺激性气味
有毒 气体, 密度比空气大,
易液化 易溶于水(1:4:).
【讨论 交流1】 实验室制SO2 气体,应注意什么?
该如何收集?石蕊试液为什么会变红?
答: 防止污染空气
向上排空气法收集
溶液呈酸性。
(二)、化学性质
1、具有酸性氧化物的通性
(1) 与H2O反应
(二)、化学性质
1、具有酸性氧化物的通性
(1) 与H2O反应
SO2+H2O H2SO3(亚硫酸)
(2) 与碱反应
SO2+2NaOH=Na2SO3+H2O SO2吸收尾气,
SO2是亚硫酐。
【讨论 交流2】根据化合价推测 SO2还应具有的性质。
2、具有还原性
(1) 2SO2+O2 2SO3
化合价上升,被氧化
化合价降低,被还原
思考:为什么SO2可以使氯水、溴水、碘水褪色?
(2) SO2+X2+2H2O=H2SO4+2HX
化合价上升,被氧化
化合价降低,被还原
还原剂:SO2
氧化剂:O2
还原剂:SO2
氧化剂:X2
3、具有氧化性
4、具有漂白性——能使品红褪色
SO2 + 2H2S == 3S↓ + 2H2O
化合价上升,被氧化
化合价降低,被还原
还原剂:H2S
氧化剂: SO2
SO2也具有的特殊化学性质:漂白性
它能与某些有色物质化合成不稳定的无色物质而具有漂白性.
它可以用来漂白纸浆、毛、丝、草编制品等。
【讨论 交流3】 SO2的漂白性与次氯酸相同吗?
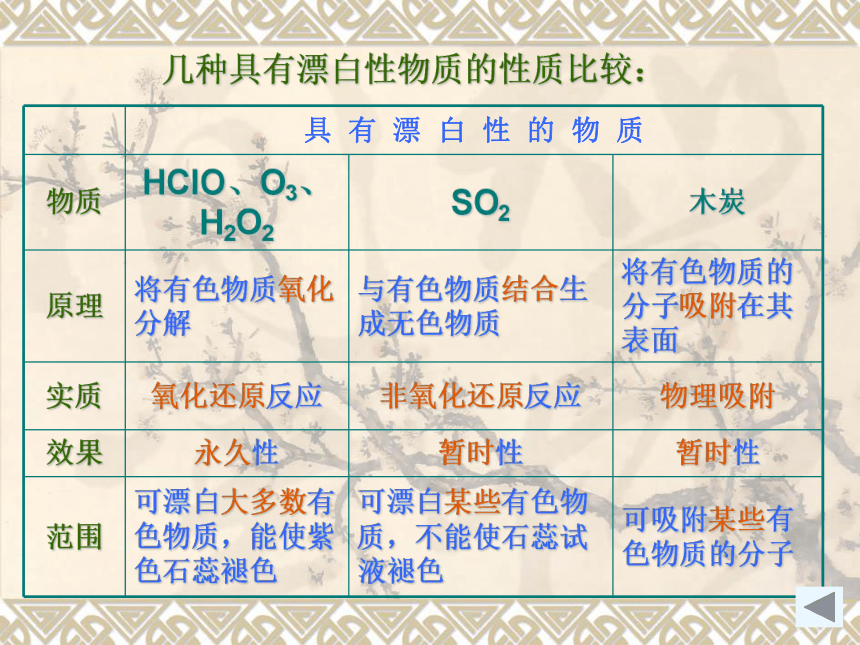
几种具有漂白性物质的性质比较:
具 有 漂 白 性 的 物 质
物质 HClO、O3、H2O2 SO2 木炭
原理 将有色物质氧化分解 与有色物质结合生成无色物质 将有色物质的分子吸附在其表面
实质 氧化还原反应 非氧化还原反应 物理吸附
效果 永久性 暂时性 暂时性
范围 可漂白大多数有色物质,能使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
【讨论 交流4】氯水和SO2都具有漂白作用,则将1molSO2和1molCl2通入同一容器水中,所得溶液的漂白作用加强吗?
提示:SO2+Cl2+2H2O=H2SO4+2HCl
二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂
【讨论 交流5】 SO2可以使溴水褪色和SO2使品红褪色原理一样吗?
提示:前者表现还原性,
后者表现漂白性。
【信息】已知SO2与澄清石灰水反应,有与CO2类似的现象。试判断SO2通入澄清石灰水直至过量有何现象,并写出反应方程式。
【讨论 交流6】 SO2与CO2怎样鉴别?
提示:利用SO2的漂白性。
(2)、北方市场上,经常见有外面
非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封闭的容器中先放入馒头或粉丝,再放入燃烧着的硫后熏一下而得到的,您能否马上就食用或用来做菜
(1)、为什么长时间放置的报纸和草帽会变黄?
你注意到了吗?怎么解释?
化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
化学性质小节
二、二氧化硫对环境的污染
空气中的二氧化硫主要来自于化石燃料(如煤与石油)的燃烧、含硫矿石的冶炼以及制造硫酸、磷肥、纸浆等产生的废气。
1、酸雨的概念:
pH值小于5.6的雨水
1852年英国化学家史密斯发现雨水的酸性
1872年编著著作中首次采用 “酸雨”这一术语。
2、酸雨成因:自然和人为因素向大气中排放污染物
酸性污染物
自然来源
人为来源
湿沉降
干沉降
大气污染 — 酸雨的形成
3、酸雨的危害实例录:
故宫太和殿台阶
(2)巫山
(3)华山松、马尾松
(4)是谁剥夺了我为人类贡献的权利?
1、对人体的直接危害;
2、引起水体酸化;
3、破坏土壤、植被、森林;
4、腐蚀金属、油漆、皮革、纺织品、建筑材料等;
5、引起地下水酸化。
小 结
4、 我国的酸雨特征
(1)、主要为硫酸及硫酸盐雨。
(2)、发展速度很快。
(3)、酸雨区面积为国土面积的30%,
1/3的河段达不到使用功能要求……
(4 )、区域性:由北向南加重。
5、如何控制酸雨?
1972年6月5日,在瑞典首都斯德哥尔摩 通过了《人类环境宣言》,并确定每年6月5日为“世界环境日”。其中1983的主题是防治酸雨。
1、改善燃料种类,积极开发新能源;
2、对煤(其中含硫为0.3%-5%)进行处理.
3、种植能够吸收SO2的有关树木。
6、主要措施:
1.下列试剂能否用来鉴别CO2和SO2两瓶气体 为什么
A.品红溶液 B.澄清的石灰水 C.氯化钙溶液 ( )
D.紫色石蕊试液 E.氯化钡和氯水的混合溶液
2.能吸收SO2气体但不会有沉淀产生的溶液是( )
A.Ba(OH)2 B.NaOH C.Na2CO3 D.NaHSO3
3.SO2既具有氧化性又具有还原性,请你判断能否用浓硫
酸来干燥SO2 说明你的理由.(浓硫酸具强氧化性)
B.C
能。因为硫元素在+4和+6价之间无其它的化合价,
因此这两者之间不能发生氧化还原反应.
即含同种元素两种物质间若不存在中间价态时,
它们就不能发生氧化还原反应.
练习
A.E
4、一个城市的环保部门采集了一份雨水样品,每隔一段时间
测定一次pH值,其结果如下:
(1).请你写出酸雨开始呈酸性的化学方程式.
(2).这种雨水的pH值逐渐减小,其原因何在
(提示:从硫元素的化合价和酸性强弱方面考虑)
测试时间 0小时后 1小时后 2小时后 4小时后 5小时后
雨水的pH值 4.74 4.63 4.57 4.53 4.53
SO2+H2O=H2SO3 SO3+H2O=H2SO4
O2+2H2SO3= 2H2SO4
空气中的氧气在灰尘等存在下能够逐渐将水中的H2SO3氧化成强酸硫酸.
5、某工厂所用的燃料为含硫煤,为防止污染环境和回收SO2,采取将燃烧产生烟道气通入石灰浆的方法,采用这种方法回收效率达95%[如用石灰石代替石灰浆则回收效率也能达到85-90%],您能分析其中的原理吗
*钙基固硫:
CaO+SO2=CaSO3
Ca(OH)2+SO2=CaSO3 +H2O
2CaSO3+O2=2CaSO4
(CaSO4与水作用生成生石膏CaSO4·2H2O)
课堂小结
SO2
1、物理性质
2、化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
*SO2的污染---酸雨
滴有紫色石蕊的水
SO2
品红退色哪!
品红溶液
二 氧 化 硫
根据硫的化合价,写出它的氧化物和氢化物的化学式:
SO2 、 SO3 、 H2S
请开动你聪明的脑筋
一、二氧化硫的性质
(一) 物理性质
无色 刺激性气味
有毒 气体, 密度比空气大,
易液化 易溶于水(1:4:).
【讨论 交流1】 实验室制SO2 气体,应注意什么?
该如何收集?石蕊试液为什么会变红?
答: 防止污染空气
向上排空气法收集
溶液呈酸性。
(二)、化学性质
1、具有酸性氧化物的通性
(1) 与H2O反应
(二)、化学性质
1、具有酸性氧化物的通性
(1) 与H2O反应
SO2+H2O H2SO3(亚硫酸)
(2) 与碱反应
SO2+2NaOH=Na2SO3+H2O SO2吸收尾气,
SO2是亚硫酐。
【讨论 交流2】根据化合价推测 SO2还应具有的性质。
2、具有还原性
(1) 2SO2+O2 2SO3
化合价上升,被氧化
化合价降低,被还原
思考:为什么SO2可以使氯水、溴水、碘水褪色?
(2) SO2+X2+2H2O=H2SO4+2HX
化合价上升,被氧化
化合价降低,被还原
还原剂:SO2
氧化剂:O2
还原剂:SO2
氧化剂:X2
3、具有氧化性
4、具有漂白性——能使品红褪色
SO2 + 2H2S == 3S↓ + 2H2O
化合价上升,被氧化
化合价降低,被还原
还原剂:H2S
氧化剂: SO2
SO2也具有的特殊化学性质:漂白性
它能与某些有色物质化合成不稳定的无色物质而具有漂白性.
它可以用来漂白纸浆、毛、丝、草编制品等。
【讨论 交流3】 SO2的漂白性与次氯酸相同吗?
几种具有漂白性物质的性质比较:
具 有 漂 白 性 的 物 质
物质 HClO、O3、H2O2 SO2 木炭
原理 将有色物质氧化分解 与有色物质结合生成无色物质 将有色物质的分子吸附在其表面
实质 氧化还原反应 非氧化还原反应 物理吸附
效果 永久性 暂时性 暂时性
范围 可漂白大多数有色物质,能使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
【讨论 交流4】氯水和SO2都具有漂白作用,则将1molSO2和1molCl2通入同一容器水中,所得溶液的漂白作用加强吗?
提示:SO2+Cl2+2H2O=H2SO4+2HCl
二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂
【讨论 交流5】 SO2可以使溴水褪色和SO2使品红褪色原理一样吗?
提示:前者表现还原性,
后者表现漂白性。
【信息】已知SO2与澄清石灰水反应,有与CO2类似的现象。试判断SO2通入澄清石灰水直至过量有何现象,并写出反应方程式。
【讨论 交流6】 SO2与CO2怎样鉴别?
提示:利用SO2的漂白性。
(2)、北方市场上,经常见有外面
非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封闭的容器中先放入馒头或粉丝,再放入燃烧着的硫后熏一下而得到的,您能否马上就食用或用来做菜
(1)、为什么长时间放置的报纸和草帽会变黄?
你注意到了吗?怎么解释?
化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
化学性质小节
二、二氧化硫对环境的污染
空气中的二氧化硫主要来自于化石燃料(如煤与石油)的燃烧、含硫矿石的冶炼以及制造硫酸、磷肥、纸浆等产生的废气。
1、酸雨的概念:
pH值小于5.6的雨水
1852年英国化学家史密斯发现雨水的酸性
1872年编著著作中首次采用 “酸雨”这一术语。
2、酸雨成因:自然和人为因素向大气中排放污染物
酸性污染物
自然来源
人为来源
湿沉降
干沉降
大气污染 — 酸雨的形成
3、酸雨的危害实例录:
故宫太和殿台阶
(2)巫山
(3)华山松、马尾松
(4)是谁剥夺了我为人类贡献的权利?
1、对人体的直接危害;
2、引起水体酸化;
3、破坏土壤、植被、森林;
4、腐蚀金属、油漆、皮革、纺织品、建筑材料等;
5、引起地下水酸化。
小 结
4、 我国的酸雨特征
(1)、主要为硫酸及硫酸盐雨。
(2)、发展速度很快。
(3)、酸雨区面积为国土面积的30%,
1/3的河段达不到使用功能要求……
(4 )、区域性:由北向南加重。
5、如何控制酸雨?
1972年6月5日,在瑞典首都斯德哥尔摩 通过了《人类环境宣言》,并确定每年6月5日为“世界环境日”。其中1983的主题是防治酸雨。
1、改善燃料种类,积极开发新能源;
2、对煤(其中含硫为0.3%-5%)进行处理.
3、种植能够吸收SO2的有关树木。
6、主要措施:
1.下列试剂能否用来鉴别CO2和SO2两瓶气体 为什么
A.品红溶液 B.澄清的石灰水 C.氯化钙溶液 ( )
D.紫色石蕊试液 E.氯化钡和氯水的混合溶液
2.能吸收SO2气体但不会有沉淀产生的溶液是( )
A.Ba(OH)2 B.NaOH C.Na2CO3 D.NaHSO3
3.SO2既具有氧化性又具有还原性,请你判断能否用浓硫
酸来干燥SO2 说明你的理由.(浓硫酸具强氧化性)
B.C
能。因为硫元素在+4和+6价之间无其它的化合价,
因此这两者之间不能发生氧化还原反应.
即含同种元素两种物质间若不存在中间价态时,
它们就不能发生氧化还原反应.
练习
A.E
4、一个城市的环保部门采集了一份雨水样品,每隔一段时间
测定一次pH值,其结果如下:
(1).请你写出酸雨开始呈酸性的化学方程式.
(2).这种雨水的pH值逐渐减小,其原因何在
(提示:从硫元素的化合价和酸性强弱方面考虑)
测试时间 0小时后 1小时后 2小时后 4小时后 5小时后
雨水的pH值 4.74 4.63 4.57 4.53 4.53
SO2+H2O=H2SO3 SO3+H2O=H2SO4
O2+2H2SO3= 2H2SO4
空气中的氧气在灰尘等存在下能够逐渐将水中的H2SO3氧化成强酸硫酸.
5、某工厂所用的燃料为含硫煤,为防止污染环境和回收SO2,采取将燃烧产生烟道气通入石灰浆的方法,采用这种方法回收效率达95%[如用石灰石代替石灰浆则回收效率也能达到85-90%],您能分析其中的原理吗
*钙基固硫:
CaO+SO2=CaSO3
Ca(OH)2+SO2=CaSO3 +H2O
2CaSO3+O2=2CaSO4
(CaSO4与水作用生成生石膏CaSO4·2H2O)
课堂小结
SO2
1、物理性质
2、化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
*SO2的污染---酸雨
滴有紫色石蕊的水
SO2
品红退色哪!
品红溶液
