浙江省2018年中考科学系统复习专题15化学反应
文档属性
| 名称 | 浙江省2018年中考科学系统复习专题15化学反应 |  | |
| 格式 | zip | ||
| 文件大小 | 360.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2018-05-11 10:19:40 | ||
图片预览





文档简介
课件29张PPT。专题15 化学反应考点一 化学反应的基本类型考点二 质量守恒定律考点一 化学反应的基本类型
1. 知道化合反应、分解反应、置换反应、
复分解反应的特点(a)
2. 辨认具体化学反应的基本类型(a)由两种或两种以上的物质生成一种物质的反应. 多合一A + B= AB由一种物质生成两种或两种 以上物质的反应 一变多AB =A + B单质+化合物→ 新单质+新化合物
A+BC=AC+B两种化合物互相交换成分,生成另外两种化合物的反应AB+CD=AD+CB考点一 化学反应的基本类型2. CO2 + 2Na O H = Na2CO 3 + H 2 O
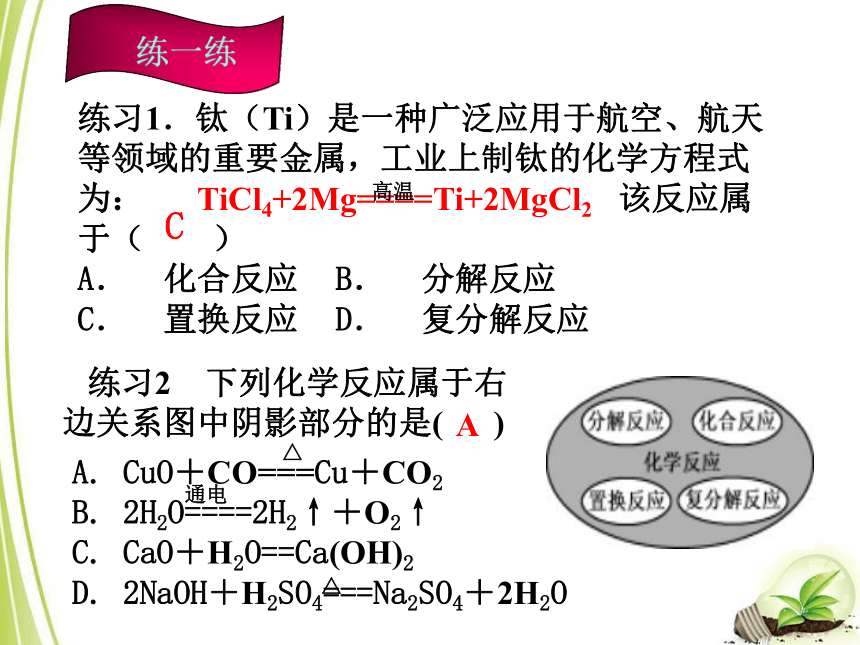
是复分解反应吗?1.绿色化学:原子利用率可达到100%的反应类型是 。化合反应思考:不是考点一 化学反应的基本类型练习2 下列化学反应属于右边关系图中阴影部分的是( )A. CuO+CO===Cu+CO2
B. 2H2O====2H2↑+O2↑
C. CaO+H2O==Ca(OH)2
D. 2NaOH+H2SO4===Na2SO4+2H2O练习1.钛(Ti)是一种广泛应用于航空、航天等领域的重要金属,工业上制钛的化学方程式为: 该反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
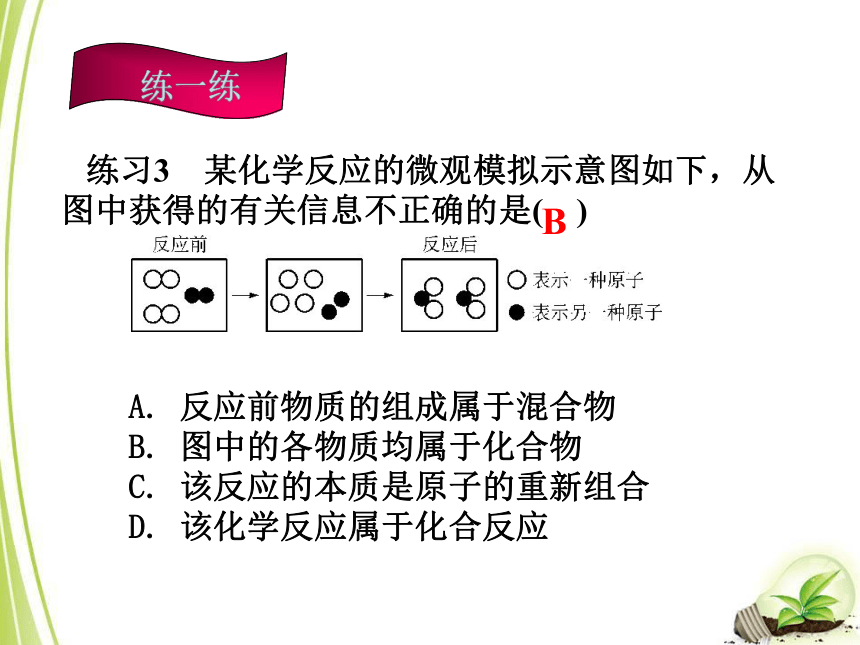
△通电△CA练习3 某化学反应的微观模拟示意图如下,从图中获得的有关信息不正确的是( )A. 反应前物质的组成属于混合物
B. 图中的各物质均属于化合物
C. 该反应的本质是原子的重新组合
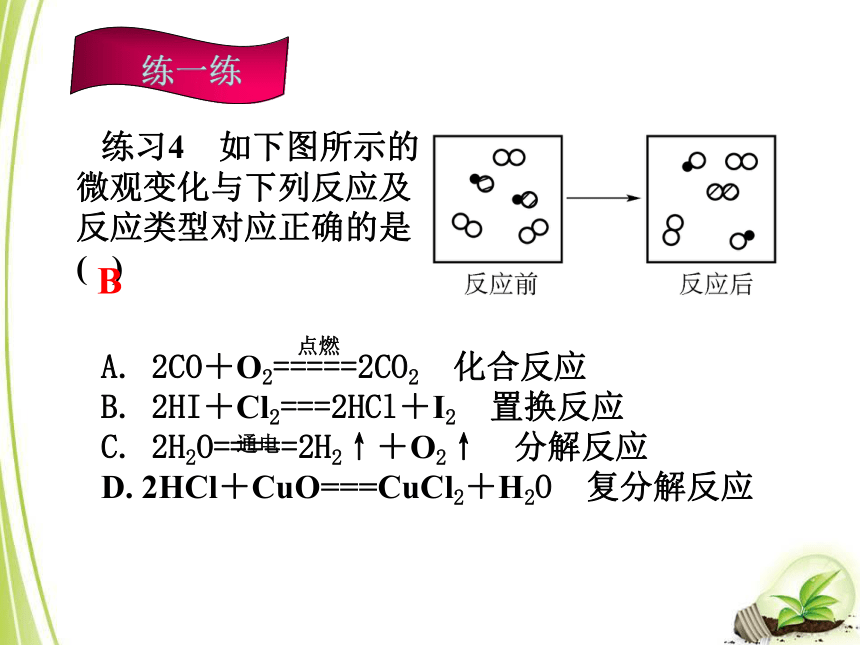
D. 该化学反应属于化合反应B练习4 如下图所示的微观变化与下列反应及反应类型对应正确的是( )A. 2CO+O2=====2CO2 化合反应
B. 2HI+Cl2===2HCl+I2 置换反应
C. 2H2O=====2H2↑+O2↑ 分解反应
D. 2HCl+CuO===CuCl2+H2O 复分解反应B 点燃通电考点二 质量守恒定律1. 描述质量守恒定律(a)
2. 会从分子、原子的角度解释质量守恒定律(b)
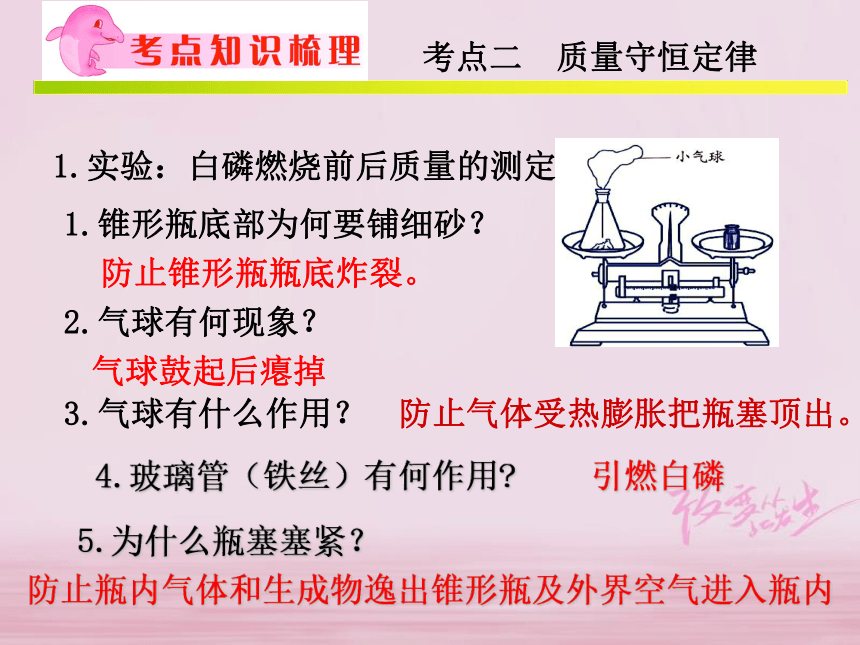
3. 用质量守恒定律分析解释常见的现象(c)1.实验:白磷燃烧前后质量的测定1.锥形瓶底部为何要铺细砂?防止锥形瓶瓶底炸裂。2.气球有何现象?气球鼓起后瘪掉3.气球有什么作用? 防止气体受热膨胀把瓶塞顶出。4.玻璃管(铁丝)有何作用? 引燃白磷5.为什么瓶塞塞紧?防止瓶内气体和生成物逸出锥形瓶及外界空气进入瓶内考点二 质量守恒定律现象: 剧烈燃烧,产生大量白烟,放热,气球鼓起后瘪掉,天平保持平衡结论:反应前后天平保持平衡,
即反应前后物质的质量总和没有变化2.质量守恒定律 在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。1.实验:白磷燃烧前后质量的测定考点二 质量守恒定律思考:下列装置及实验(天平未画出)能用来验证质量守恒定律吗?【注意】当有气体参加或有气体生成,该反应必须在密闭的容器中进行才能验证质量守恒定律。【注意】
没有发生化学反应的“质量不变”不是质量守恒定律考点二 质量守恒定律原子数目原子质量原子种类物质的总质量元素质量元素种类物质的种类分子的种类分子的数目可能改变微观本质原因 在一切化学反应中,反应前后原子种类没有改变,原子数目没有增减,原子质量也就没有变化。考点二 质量守恒定律提醒要点:
1.一切化学反应都遵循质量守恒定律;
2.质量守恒定律只适用于质量守恒,而不是体积或分子数守恒;
3.在反应前的各种物质的质量总和中,不包括过量的反应物质量。考点二 质量守恒定律练习1【2017成都】用右图所示装置验证质量守恒定律,能达到实验目的的物质组合是( )
A.锌和稀硫酸
B.碳酸钠和稀盐酸
C.铁和硫酸铜溶液
D.氯化钠和稀盐酸C 练习2 【2017徐州】甲、乙、丙、丁4种物质在密闭容器中充分反应.测得反应前后各物质的质量如表.下列说法正确的是( )A.甲一定是该反应的催化剂
B.该反应一定是化合反应
C.丙物质一定属于化合物
D.乙、丁在反应中的质量比为5:2CA. 该反应有单质生成
B. 该反应是化合反应
C. 反应前后分子种类不变
D. 参加反应的两种分子个数比为4∶1练习3 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.则该反应( )
B练习4 1.6 g某物质在氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,关于该物质的组成有下列判断:①一定含有C、H元素 ②一定不含O元素 ③可能含O元素 ④一定含O元素 ⑤分子中C、H原子个数之比为1:2 ⑥分子中C、H原子个数之比为1:4;正确的是 ( )
A.①②⑥ B.①②⑤
C.①③⑥ D.①④⑤ A练习5 【2017扬州】某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg,则c等于( )
A.d+b+a B.d-b-a C.d-b+a D.d+b-aD考点三 化学方程式
1. 描述化学方程式表示的意义(a)
2. 正确书写常见的化学方程式(b)?1.化学方程式书写原则:(1).以客观事实为依据,反应是真实存在的
(2).遵循质量守恒定律2.几个注意问题:(1)、切忌遗忘反应条件
点燃(不等于燃烧)、加热? 、高温、
通电(不等于电解)、催化剂...(2)、正确使用“?” “?”考点三 化学方程式(3)注意配平: FeS2 + O2高温 Fe2O3 + SO2
C2H4+ O2 点燃 CO2 + H2O
C6H6 + O2 点燃 CO2 + H2O41128322215126考点三 化学方程式3.化学方程式的读法:宏观上:硫和氧气在点燃条件下反应生成二氧化硫。和条件生成微观上:每一个硫原子和一个氧分子在点燃的条件下反应生成一个二氧化硫分子。
考点三 化学方程式表示反应在什么条件下进行表示各物质之间原子和分子的个数比表示什么物质参加反应,结果生成了什么物质表示反应物、生成物各物质间的质量比4.化学方程式的意义 宏观意义条件意义微观意义质量意义如果反应物都是气体,还能表示它们在反应时的体积比。考点三 化学方程式4P + 5O2 2P2O5
124 160 284点燃1)表示磷和氧气参加反应,结果生成五氧化二磷。3)表示反应物中磷原子、氧分子和生成物中五氧化二磷分子的个数比为4∶5∶2。4)表示每124份质量的磷与160份质量的氧气反应生成284份质量的五氧化二磷。质量比为31∶40∶712)表示反应在点燃的条件下进行4.化学方程式的意义考点三 化学方程式练习1 【2017连云港】我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是4Ag+2H2S+O2═2X+2H2O,下列有关该反应的说法不正确的是( )
A.反应属于氧化反应
B.X的化学式是Ag2S
C.反应前后元素的种类不变
D.反应前后所有元素的化合价都发生了变化D练习2 下列反应方程式及反应类型完全正确的是( )
A.实验室用加热高锰酸钾制取氧气
2KMnO4 K2MnO4+MnO2+O2↑ 分解反应
B.铁丝在氧气中燃烧
4Fe+3O2 2Fe2O3 化合反应C.高炉炼铁原理
Fe2O3+3CO 2Fe+3CO2 复分解反应D.将铁片投入足量的稀盐酸中 2Fe+6HCl=2FeCl3+3H2↑ 置换反应A练习3 (2017?丽水)科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下。有关该反应的说法正确的是( )
A、该反应属于化合反应
B、反应前碳元素的化合价为+2价
C、生成物的化学式可用C2H2O表示
D、参加反应的两物质的质量比为1:1A练习4
(1)FeTiO3中,钛的化合价为+4价,则铁的化合价为 .
(2)将TiCl4再与Na在“一定条件”下反应生成Ti和NaCl.请写出②中反应的化学方程式: 。(3)用二氧化硅和碳在高温下反应得到一氧化碳和硅,写出该反应的化学方程式: .+2
1.B 2.A 3.D 4.A 5.D 6.C
7. (1)焦点(2)+2(3)红色固体消失、管内液面下降 8. (1)2C+SiO2=====Si+2CO↑. (2)物理 (3)SiHCl3+H2=====Si+3HCl
9. (1)防止冷凝水倒流引起试管炸裂(2)m1+m2+m3-m4=ρV(3)少量氯气随氧气排出,使第3步反应没有发生完全。(合理即可)高温高温【专题15 综合训练答案】
1. 知道化合反应、分解反应、置换反应、
复分解反应的特点(a)
2. 辨认具体化学反应的基本类型(a)由两种或两种以上的物质生成一种物质的反应. 多合一A + B= AB由一种物质生成两种或两种 以上物质的反应 一变多AB =A + B单质+化合物→ 新单质+新化合物
A+BC=AC+B两种化合物互相交换成分,生成另外两种化合物的反应AB+CD=AD+CB考点一 化学反应的基本类型2. CO2 + 2Na O H = Na2CO 3 + H 2 O
是复分解反应吗?1.绿色化学:原子利用率可达到100%的反应类型是 。化合反应思考:不是考点一 化学反应的基本类型练习2 下列化学反应属于右边关系图中阴影部分的是( )A. CuO+CO===Cu+CO2
B. 2H2O====2H2↑+O2↑
C. CaO+H2O==Ca(OH)2
D. 2NaOH+H2SO4===Na2SO4+2H2O练习1.钛(Ti)是一种广泛应用于航空、航天等领域的重要金属,工业上制钛的化学方程式为: 该反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
△通电△CA练习3 某化学反应的微观模拟示意图如下,从图中获得的有关信息不正确的是( )A. 反应前物质的组成属于混合物
B. 图中的各物质均属于化合物
C. 该反应的本质是原子的重新组合
D. 该化学反应属于化合反应B练习4 如下图所示的微观变化与下列反应及反应类型对应正确的是( )A. 2CO+O2=====2CO2 化合反应
B. 2HI+Cl2===2HCl+I2 置换反应
C. 2H2O=====2H2↑+O2↑ 分解反应
D. 2HCl+CuO===CuCl2+H2O 复分解反应B 点燃通电考点二 质量守恒定律1. 描述质量守恒定律(a)
2. 会从分子、原子的角度解释质量守恒定律(b)
3. 用质量守恒定律分析解释常见的现象(c)1.实验:白磷燃烧前后质量的测定1.锥形瓶底部为何要铺细砂?防止锥形瓶瓶底炸裂。2.气球有何现象?气球鼓起后瘪掉3.气球有什么作用? 防止气体受热膨胀把瓶塞顶出。4.玻璃管(铁丝)有何作用? 引燃白磷5.为什么瓶塞塞紧?防止瓶内气体和生成物逸出锥形瓶及外界空气进入瓶内考点二 质量守恒定律现象: 剧烈燃烧,产生大量白烟,放热,气球鼓起后瘪掉,天平保持平衡结论:反应前后天平保持平衡,
即反应前后物质的质量总和没有变化2.质量守恒定律 在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。1.实验:白磷燃烧前后质量的测定考点二 质量守恒定律思考:下列装置及实验(天平未画出)能用来验证质量守恒定律吗?【注意】当有气体参加或有气体生成,该反应必须在密闭的容器中进行才能验证质量守恒定律。【注意】
没有发生化学反应的“质量不变”不是质量守恒定律考点二 质量守恒定律原子数目原子质量原子种类物质的总质量元素质量元素种类物质的种类分子的种类分子的数目可能改变微观本质原因 在一切化学反应中,反应前后原子种类没有改变,原子数目没有增减,原子质量也就没有变化。考点二 质量守恒定律提醒要点:
1.一切化学反应都遵循质量守恒定律;
2.质量守恒定律只适用于质量守恒,而不是体积或分子数守恒;
3.在反应前的各种物质的质量总和中,不包括过量的反应物质量。考点二 质量守恒定律练习1【2017成都】用右图所示装置验证质量守恒定律,能达到实验目的的物质组合是( )
A.锌和稀硫酸
B.碳酸钠和稀盐酸
C.铁和硫酸铜溶液
D.氯化钠和稀盐酸C 练习2 【2017徐州】甲、乙、丙、丁4种物质在密闭容器中充分反应.测得反应前后各物质的质量如表.下列说法正确的是( )A.甲一定是该反应的催化剂
B.该反应一定是化合反应
C.丙物质一定属于化合物
D.乙、丁在反应中的质量比为5:2CA. 该反应有单质生成
B. 该反应是化合反应
C. 反应前后分子种类不变
D. 参加反应的两种分子个数比为4∶1练习3 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.则该反应( )
B练习4 1.6 g某物质在氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,关于该物质的组成有下列判断:①一定含有C、H元素 ②一定不含O元素 ③可能含O元素 ④一定含O元素 ⑤分子中C、H原子个数之比为1:2 ⑥分子中C、H原子个数之比为1:4;正确的是 ( )
A.①②⑥ B.①②⑤
C.①③⑥ D.①④⑤ A练习5 【2017扬州】某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg,则c等于( )
A.d+b+a B.d-b-a C.d-b+a D.d+b-aD考点三 化学方程式
1. 描述化学方程式表示的意义(a)
2. 正确书写常见的化学方程式(b)?1.化学方程式书写原则:(1).以客观事实为依据,反应是真实存在的
(2).遵循质量守恒定律2.几个注意问题:(1)、切忌遗忘反应条件
点燃(不等于燃烧)、加热? 、高温、
通电(不等于电解)、催化剂...(2)、正确使用“?” “?”考点三 化学方程式(3)注意配平: FeS2 + O2高温 Fe2O3 + SO2
C2H4+ O2 点燃 CO2 + H2O
C6H6 + O2 点燃 CO2 + H2O41128322215126考点三 化学方程式3.化学方程式的读法:宏观上:硫和氧气在点燃条件下反应生成二氧化硫。和条件生成微观上:每一个硫原子和一个氧分子在点燃的条件下反应生成一个二氧化硫分子。
考点三 化学方程式表示反应在什么条件下进行表示各物质之间原子和分子的个数比表示什么物质参加反应,结果生成了什么物质表示反应物、生成物各物质间的质量比4.化学方程式的意义 宏观意义条件意义微观意义质量意义如果反应物都是气体,还能表示它们在反应时的体积比。考点三 化学方程式4P + 5O2 2P2O5
124 160 284点燃1)表示磷和氧气参加反应,结果生成五氧化二磷。3)表示反应物中磷原子、氧分子和生成物中五氧化二磷分子的个数比为4∶5∶2。4)表示每124份质量的磷与160份质量的氧气反应生成284份质量的五氧化二磷。质量比为31∶40∶712)表示反应在点燃的条件下进行4.化学方程式的意义考点三 化学方程式练习1 【2017连云港】我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是4Ag+2H2S+O2═2X+2H2O,下列有关该反应的说法不正确的是( )
A.反应属于氧化反应
B.X的化学式是Ag2S
C.反应前后元素的种类不变
D.反应前后所有元素的化合价都发生了变化D练习2 下列反应方程式及反应类型完全正确的是( )
A.实验室用加热高锰酸钾制取氧气
2KMnO4 K2MnO4+MnO2+O2↑ 分解反应
B.铁丝在氧气中燃烧
4Fe+3O2 2Fe2O3 化合反应C.高炉炼铁原理
Fe2O3+3CO 2Fe+3CO2 复分解反应D.将铁片投入足量的稀盐酸中 2Fe+6HCl=2FeCl3+3H2↑ 置换反应A练习3 (2017?丽水)科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下。有关该反应的说法正确的是( )
A、该反应属于化合反应
B、反应前碳元素的化合价为+2价
C、生成物的化学式可用C2H2O表示
D、参加反应的两物质的质量比为1:1A练习4
(1)FeTiO3中,钛的化合价为+4价,则铁的化合价为 .
(2)将TiCl4再与Na在“一定条件”下反应生成Ti和NaCl.请写出②中反应的化学方程式: 。(3)用二氧化硅和碳在高温下反应得到一氧化碳和硅,写出该反应的化学方程式: .+2
1.B 2.A 3.D 4.A 5.D 6.C
7. (1)焦点(2)+2(3)红色固体消失、管内液面下降 8. (1)2C+SiO2=====Si+2CO↑. (2)物理 (3)SiHCl3+H2=====Si+3HCl
9. (1)防止冷凝水倒流引起试管炸裂(2)m1+m2+m3-m4=ρV(3)少量氯气随氧气排出,使第3步反应没有发生完全。(合理即可)高温高温【专题15 综合训练答案】
