3.3《共价键》课件2
图片预览







文档简介
课件21张PPT。3.3 共价键1. 共价键的形成过程一、共价键的形成2.概念原子间通过共用电子对而形成的化学键3.形成条件非金属元素之间,一般形成共价键 稀有气体单质中没有共价键非金属单质、非金属氧化物、气态氢化物、酸,大多数有机物一般都含共价键
二、共价分子1、概念共价单质:H2 Cl2 F2 Br2 N2 O2 P4 O3HCl(HX) H2O H2S H2O2 CO2 CH4 CCl4 H2SO4 共价化合物:分子中原子之间全部是共价键
(1)最小单元是分子
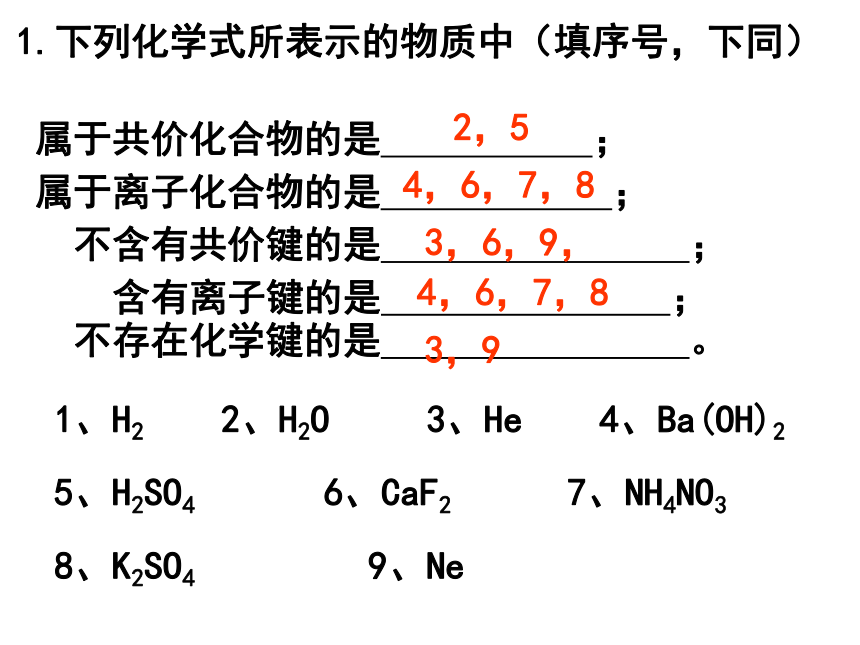
(2)化学式就是分子式 2、电子式和结构式 Cl2 H2O CO2 NH3 形成过程 电子式 结构式 Cl—Cl H—O—H3、结构式离子化合物无结构式用一根短线表示一对共用电子【练习】NH4Cl、NaOH、Ba(OH)2、Na2O2、NaH离子化合物中可以有共价键1.下列化学式所表示的物质中(填序号,下同)
属于共价化合物的是 ;
属于离子化合物的是 ;
不含有共价键的是 ;
含有离子键的是 ;
不存在化学键的是 。
1、H2 2、H2O 3、He 4、Ba(OH)2
5、H2SO4 6、CaF2 7、NH4NO3
8、K2SO4 9、Ne3,6,9,4,6,7,82,54,6,7,83,92、是非题
①含有共价键的化合物一定是共价化合物( )
②只含共价键的物质一定是共价化合物( )
③只含共价键的化合物一定是共价化合物( )
④有离子键的化合物一定是离子化合物( )
⑤离子化合物中只有离子键( )
⑥单质中一定存在共价键( )╳ ╳ ╳ ╳ √√3、指出下列化合物的类型和化学键的类型 离子化合物 离子键、共价键离子化合物 离子键、共价键离子化合物 离子键
H2SO4
NaOH
CCl4
Na2O2
NaH共价化合物 共价键共价化合物 共价键分子间作用力和化学键键能的比较三、分子间作用力(范德华力)分子间作用力(几—几十KJ/mol)远小于
共价键的键能分子间的相互作用卤素单质的相对分子质量和熔、沸点 1.影响范德华力大小的因素——相对分子质量
组成和结构相似的分子,
相对分子质量大,分子间作用力大分子间通过分子间作用力(范德华力)
相结合的晶体 部分非金属单质,部分非金属氧化物,气态氢化物,酸,大多数有机物,稀有气体
五、原子以共价键直接构成物质原子 分子(共价分子)无小分子的固体(原子晶体)共价键原子晶体1.写出下列微粒的电子式
Cl B K Ca
S2- F- Al3+ NH4+
2.写出下列物质的电子式
N2 H2O NaCl NH3
CaCl2 CO2 Na2O2 H2O2
3.用电子式表示下列物质的形成过程
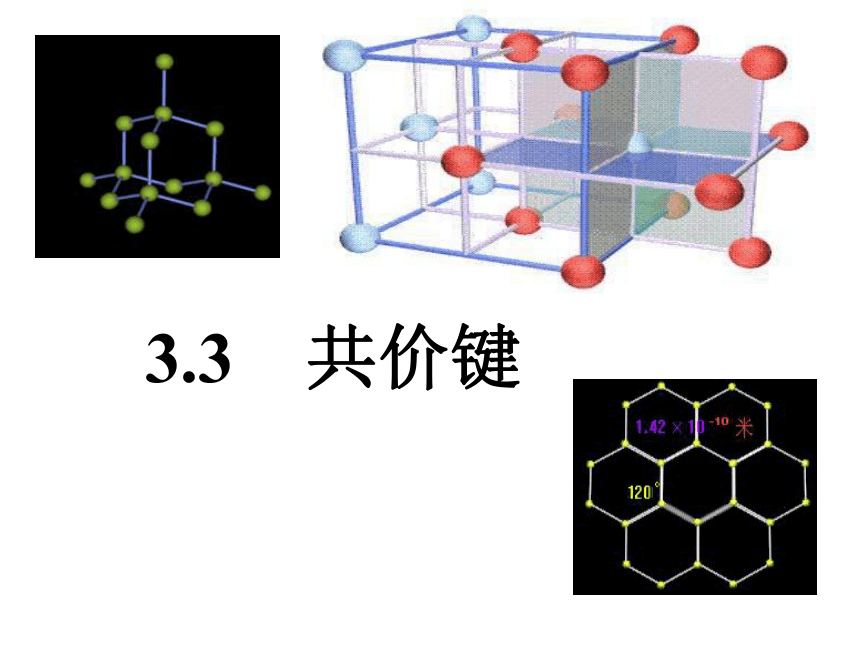
HCl MgO MgF2金刚石每个碳原子以4根共价键与其它4个碳原子连接成正四面体空间网状结构
物理性质:硬度大,熔沸点高共价键强烈、结构高度对称——原子晶体金刚石 的晶体结构模型碳原子晶体硅 的晶体结构模型硅原子Sio二氧化硅 的晶体结构模型2、原子晶体 原子间通过共价键结合的具有空间网状结构的晶体特点:
不存在单个小分子
物理性质:硬度大,熔沸点高
石墨平面正六边形层状结构
层内:共价键
层间:范德华力
物理性质:硬度小(软),
熔沸点高
能导电——混合晶体
(过渡型晶体)晶体类型
离子晶体
分子晶体
原子晶体离子键
范德华力
共价键离子
分子
原子较高
较低
很高NaCl、CsCl
干冰
金刚石微粒结合力熔沸点典型实例六、三种晶体的比较
二、共价分子1、概念共价单质:H2 Cl2 F2 Br2 N2 O2 P4 O3HCl(HX) H2O H2S H2O2 CO2 CH4 CCl4 H2SO4 共价化合物:分子中原子之间全部是共价键
(1)最小单元是分子
(2)化学式就是分子式 2、电子式和结构式 Cl2 H2O CO2 NH3 形成过程 电子式 结构式 Cl—Cl H—O—H3、结构式离子化合物无结构式用一根短线表示一对共用电子【练习】NH4Cl、NaOH、Ba(OH)2、Na2O2、NaH离子化合物中可以有共价键1.下列化学式所表示的物质中(填序号,下同)
属于共价化合物的是 ;
属于离子化合物的是 ;
不含有共价键的是 ;
含有离子键的是 ;
不存在化学键的是 。
1、H2 2、H2O 3、He 4、Ba(OH)2
5、H2SO4 6、CaF2 7、NH4NO3
8、K2SO4 9、Ne3,6,9,4,6,7,82,54,6,7,83,92、是非题
①含有共价键的化合物一定是共价化合物( )
②只含共价键的物质一定是共价化合物( )
③只含共价键的化合物一定是共价化合物( )
④有离子键的化合物一定是离子化合物( )
⑤离子化合物中只有离子键( )
⑥单质中一定存在共价键( )╳ ╳ ╳ ╳ √√3、指出下列化合物的类型和化学键的类型 离子化合物 离子键、共价键离子化合物 离子键、共价键离子化合物 离子键
H2SO4
NaOH
CCl4
Na2O2
NaH共价化合物 共价键共价化合物 共价键分子间作用力和化学键键能的比较三、分子间作用力(范德华力)分子间作用力(几—几十KJ/mol)远小于
共价键的键能分子间的相互作用卤素单质的相对分子质量和熔、沸点 1.影响范德华力大小的因素——相对分子质量
组成和结构相似的分子,
相对分子质量大,分子间作用力大分子间通过分子间作用力(范德华力)
相结合的晶体 部分非金属单质,部分非金属氧化物,气态氢化物,酸,大多数有机物,稀有气体
五、原子以共价键直接构成物质原子 分子(共价分子)无小分子的固体(原子晶体)共价键原子晶体1.写出下列微粒的电子式
Cl B K Ca
S2- F- Al3+ NH4+
2.写出下列物质的电子式
N2 H2O NaCl NH3
CaCl2 CO2 Na2O2 H2O2
3.用电子式表示下列物质的形成过程
HCl MgO MgF2金刚石每个碳原子以4根共价键与其它4个碳原子连接成正四面体空间网状结构
物理性质:硬度大,熔沸点高共价键强烈、结构高度对称——原子晶体金刚石 的晶体结构模型碳原子晶体硅 的晶体结构模型硅原子Sio二氧化硅 的晶体结构模型2、原子晶体 原子间通过共价键结合的具有空间网状结构的晶体特点:
不存在单个小分子
物理性质:硬度大,熔沸点高
石墨平面正六边形层状结构
层内:共价键
层间:范德华力
物理性质:硬度小(软),
熔沸点高
能导电——混合晶体
(过渡型晶体)晶体类型
离子晶体
分子晶体
原子晶体离子键
范德华力
共价键离子
分子
原子较高
较低
很高NaCl、CsCl
干冰
金刚石微粒结合力熔沸点典型实例六、三种晶体的比较
