第三节 溶液的酸碱性 课件(38张PPT)
文档属性
| 名称 | 第三节 溶液的酸碱性 课件(38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-05-31 00:00:00 | ||
图片预览








文档简介
(共38张PPT)
第三节 溶液的酸碱性
虽然在生活中我们可以品尝或接触一些含有酸或碱的物质,但化学上从不用品尝或触摸的方法来确定。那如何识别酸和碱呢?
一、如何检验溶液的酸碱性
酸碱指示剂
有许多物质像石蕊一样,遇到酸或碱时能发生特定的颜色变化,化学上把这类物质叫做酸碱指示剂。
常用的酸碱指示剂有紫色石蕊试液和无色酚酞试液。
酸碱指示剂发现者
清晨,一位花匠走进英国化学家波义耳的书房, 将一篮非常好看的深紫色的紫罗兰摆在屋角。美丽的花朵、诱人的清香,使波义耳心旷神怡。他随手拿了一束花向实验室走去。实验室里,助手正在倒盐酸,波义耳把花放在桌子上。赶紧去给助手帮忙。但不小心将盐酸溅到紫罗兰上,为了洗掉花瓣上的酸,他把花浸泡在水中。过一会儿,紫色花瓣上出现了红点点。波义尔对这一意外的发现,作出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。
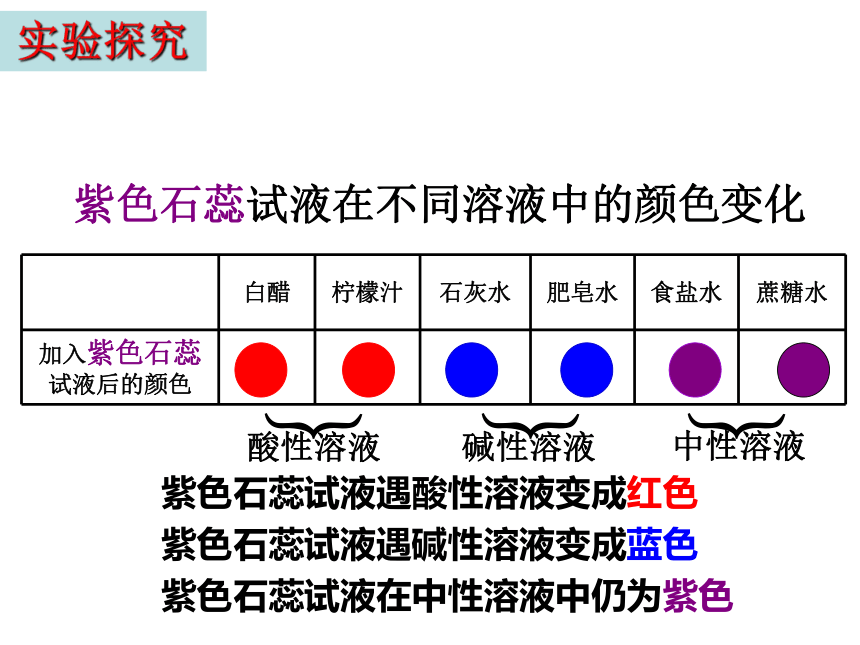
实验探究
紫色石蕊试液在不同溶液中的颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入紫色石蕊试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
紫色石蕊试液遇酸性溶液变成红色
紫色石蕊试液遇碱性溶液变成蓝色
紫色石蕊试液在中性溶液中仍为紫色
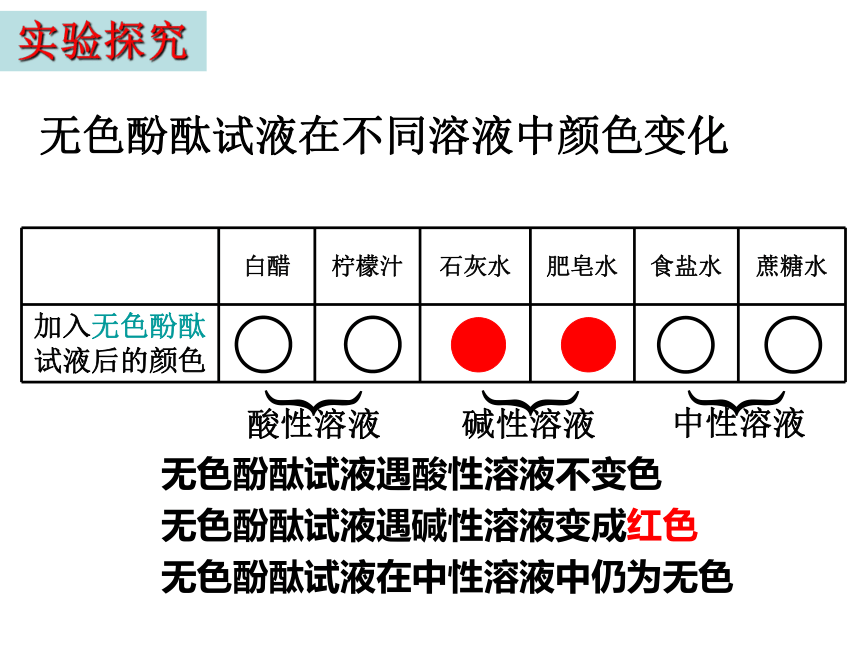
无色酚酞试液在不同溶液中颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入无色酚酞试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
无色酚酞试液遇酸性溶液不变色
无色酚酞试液遇碱性溶液变成红色
无色酚酞试液在中性溶液中仍为无色
实验探究
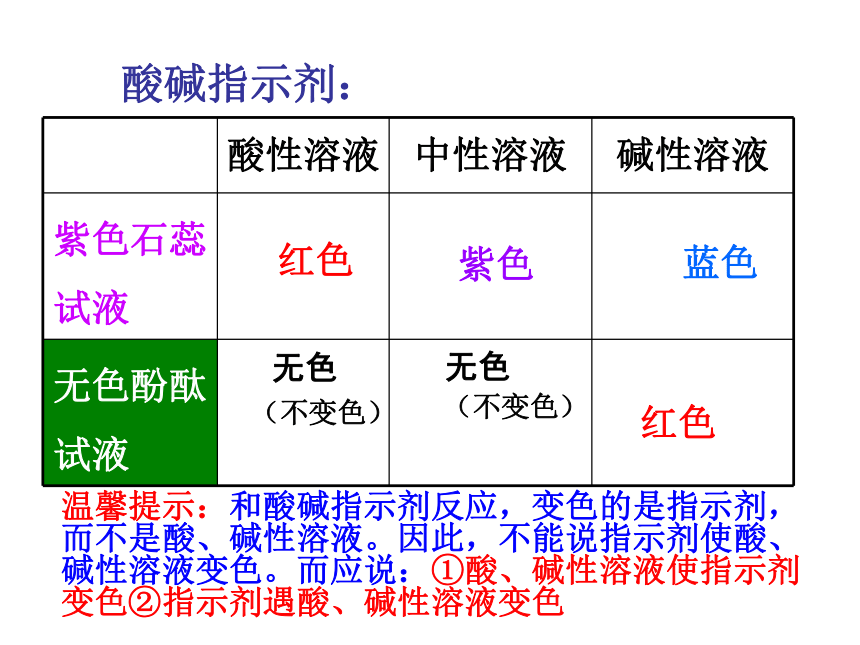
酸碱指示剂:
酸性溶液 中性溶液 碱性溶液
紫色石蕊试液
无色酚酞试液
红色
紫色
蓝色
红色
(不变色)
(不变色)
温馨提示:和酸碱指示剂反应,变色的是指示剂,而不是酸、碱性溶液。因此,不能说指示剂使酸、碱性溶液变色。而应说:①酸、碱性溶液使指示剂变色②指示剂遇酸、碱性溶液变色
无色
无色
现有1瓶失去标签的无色溶液,取出少量滴入紫色石蕊试液后,溶液变成红色,该溶液一定是酸的溶液吗?
思维训练
不一定
H+
OH-
酸溶液
碱溶液
酸性
碱性
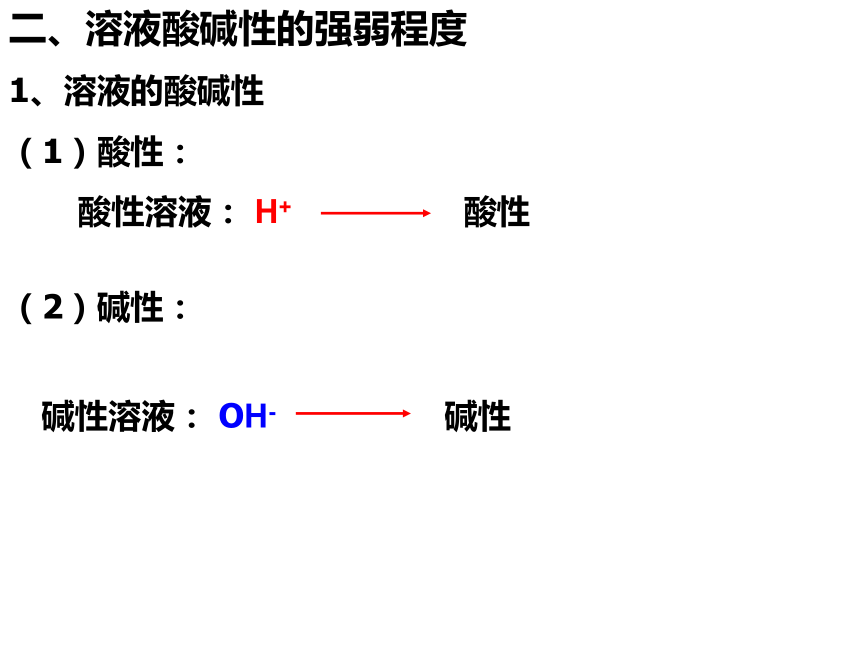
二、溶液酸碱性的强弱程度
1、溶液的酸碱性
(1)酸性:
酸性溶液: H+
酸性
(2)碱性:
碱性溶液: OH-
碱性
一、如何检验溶液的酸碱性
酸溶液(H+)
酸性溶液
一定
酸性溶液(H+)
不一定
酸溶液
碱溶液(OH-)
一定
碱性溶液
碱性溶液(OH-)
不一定
碱溶液
已知:NaHSO4的溶液呈酸性、Na2CO3的溶液呈碱性,它们的在水中解离情况如下:
NaHSO4=Na++H++SO42-
Na2CO3=2Na+ + CO32-
盐溶液
盐溶液
结合实验结果,小组讨论解答下列问题:
(1)上述溶液可分为几种类型?你是依据什么将溶液分类的?
(2)还有什么方法识别酸性或碱性的溶液呢?
分组讨论
水溶液的性质
水溶液的性质可以分为酸性溶液、碱性溶液和中性溶液。
用紫色石蕊试液可以区分酸和碱,但实验较麻烦,还可以用石蕊试纸进行区分。试纸比酸碱指示剂更易于携带,操作较方便。
红色石蕊试纸遇到碱溶液变成蓝色,
蓝色石蕊试纸遇到酸溶液变红色.
石蕊试纸的使用方法:
将石蕊试纸放在表面皿上,用玻璃棒蘸取试样溶液沾在石蕊试纸上,然后观察试纸颜色的变化。
为了使用方便,通常还用蓝色或红色石蕊试纸来检验溶液的酸碱性。
酸性溶液使蓝色石蕊试纸变红;碱性溶液使红色石蕊试纸变蓝.
结论:
【判断抢答】
1.石蕊、酚酞试液遇到酸或碱的溶液时,一定会发生颜色的变化。( )
提示:酚酞试液遇到酸溶液时就不会发生颜色的改变。
2.盐酸能使石蕊试液变红色,故能使石蕊试液变红色的一定是盐酸。( )
提示:酸性溶液都可使石蕊试液变红色。
3.能使酚酞试液变红色的溶液一定是碱溶液。( )
提示:碱性溶液一定能使酚酞试液变红。
×
×
X
在食醋和柠檬汁分别滴加紫色石蕊试液,石蕊试液都变红,说明食醋和柠檬汁都呈酸性,那么你知道谁的酸性强吗,你有方法区分吗?
思考
二、怎样判断溶液酸碱性的强弱
单位体积内含有氢离子的个数越多酸性越强。
单位体积内含有氢氧根离子的个数越多碱性越强。
1.酸碱性
2.酸碱性强弱与氢离子、氢氧根离子的数量关系
酸性溶液中都含有H+,使溶液呈酸性。
碱性溶液中都含有OH-,使溶液呈碱性。
酸碱性是物质的一种重要性质。
3.酸碱性强弱的表示方法——酸碱度pH
pH=7时,溶液呈中性
pH<7时,溶液呈酸性
pH>7时,溶液呈碱性
pH的范围通常在0~14之间:
二、怎样判断溶液酸碱性的强弱
用石蕊或酚酞试液可以检验出某溶液的酸碱性,
用pH来表示溶液的酸碱度:
当pH=7时,溶液呈 性;当 pH<7时,溶液呈 性 ,且pH越小 ;当pH>7时,溶液呈 性,且pH越大, 。
中
酸
酸性越强
碱
碱性越强
酸性溶液中的H+越多,则酸性越强;碱性溶液中的OH-越多,则碱性越强。
用什么来表示溶液的酸碱性的强弱程度呢?
4、pH的测定:
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
活动与探究:
用pH试纸测定溶液的pH
思考:甲同学在测定某碱溶液的pH时,先把pH试纸用水湿润再测,他所得的结果准确吗?
注意:
1.不能直接把试纸浸入试液,否则会污染试液。
2.不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。
(碱性溶液PH偏小,酸性溶液PH偏大,中性溶液PH不变。)
温馨提示
(1)试纸不能放到被测液中。
(2)pH的准确值是整数,及时记录下来 。
(3)要用玻璃棒蘸取另一种待测液时必须要清洗玻璃棒。
pH计
——测定pH的精确方法
讨论:
使用酸碱指示剂、广泛pH试纸判断物质酸碱性的异同点。
酸碱指示剂 pH试纸
共同点
不同点
都能判断物质的酸碱性
不能比较酸碱性强弱
能比较酸碱性强弱
但较粗略
思考
甲同学在测定某碱溶液的pH时,发现他所得结果比正确值小,请帮他分析一下造成这种结果的可能原因?
1、玻璃棒上沾有少量水
2、玻璃棒使用前没有洗干净,之前曾沾有酸性物质
3、读数时有误差
测定生活中一些物质的pH,说明它们的酸碱性:
pH 酸碱性 pH 酸碱性
橘汁 3~4 弱酸性 汽水 3~4 弱酸性
糖水 7 中性 自来水 6~7 弱酸性
牛奶 6~7 弱酸性 唾液 6~7 弱酸性
番茄汁 4~6 弱酸性 草木灰水 8~11 弱碱性
肥皂水 8~10 弱碱性 洗洁精 6~7 弱酸性
酸和碱对生命活动的意义
人运动之后身体会感到酸痛,你知道原因吗?人身体内的体液都显中性吗?为什么植物在盐碱地里生长的不旺盛呢?正常生长的pH范围是多大?
在正常的人体内,酸性与碱性物质总是保持一定的数量和比例,体液的pH总是稳定在一定范围内,这称为酸碱平衡,酸碱平衡失调会影响人的健康。
胃酸(主要成分是盐酸)能帮助消化食物,如果胃酸过多,就会导致胃痛;剧烈运动时,肌肉里产生的乳酸过多,会导致肌肉酸痛。
三、物质的酸碱性对生命活动的意义
1.酸碱性与人体的生理活动
2、酸和碱与人的生理活动密切相关
3、土壤的酸碱性对植物的生长非常重要
人体某些体液的正常pH范围
血液 唾液 胃液 乳汁 尿液
pH 7.35~7.45 6.6~7.1 0.8~1.5 6.4~6.7 5.0~7.0
大多数植物适宜在接近中性的土壤生长
西瓜6.0~7.0
苹果树6.0~8.0
小麦6.0~7.0
1.用石蕊试液和酚酞试液分别滴入同一物质的溶液中,下列现象不可能发生的是( ) A.滴入石蕊试液变红色,滴入酚酞试液不变色 B.滴入石蕊试液不变色,滴入酚酞试液不变色 C.滴入石蕊试液变蓝色,滴入酚酞试液变红色 D.滴入石蕊试液变红色,滴入酚酞试液变红色
D
目标检测
2.(2006,北京)下图是某些食物的近似pH,呈碱性的是( )
A B C D
D
3.(2005,陕西)一些常见食物的近似pH范围如下表:
食物 苹果 鸡蛋清 西红柿 葡萄 牛奶
pH 2.9~3.3 7.6~8.0 4.0~4.4 3.5~4.5 6.3~6.6
下列说法正确的是( ) A.葡萄汁能使酚酞试液变红 B.西红柿的酸性比苹果的酸性强 C.胃酸过多的人应少食苹果 D.牛奶的碱性比鸡蛋清的碱性强
C
4.(2005,太原)鲜肉是日常主要食品之一,新鲜度可以通过测试pH来判断。据资料,pH与肉的新鲜度的关系为:新鲜肉pH5.8~6.2;次鲜肉pH6.3~6.6;变质肉的pH在6.7以上。新鲜肉在变质的过程中,酸性强弱的变化为( )
A.变弱 B.变强 C.不变 D.无法确定
A
1.可以用酸碱指示剂识别酸和碱。
紫色石蕊试液遇到酸变成红色,遇到碱变为蓝色。 无色酚酞试液遇酸不变色,遇碱变成红色。
2.蓝色石蕊试纸遇到酸溶液变为红色,红色石蕊试纸遇到碱变成蓝色。
3.溶液酸碱性的强弱:在一定量的溶液中,氢离子的数量越大,酸性越强;氢氧根离子的数量越大,碱性越强。
pH数值范围:0~14
pH与溶液酸碱性的关系: pH<7 溶液呈酸性;
pH=7 溶液呈中性;
pH>7 溶液呈碱性
4.酸和碱对生命活动的意义非常重要。
第三节 溶液的酸碱性
虽然在生活中我们可以品尝或接触一些含有酸或碱的物质,但化学上从不用品尝或触摸的方法来确定。那如何识别酸和碱呢?
一、如何检验溶液的酸碱性
酸碱指示剂
有许多物质像石蕊一样,遇到酸或碱时能发生特定的颜色变化,化学上把这类物质叫做酸碱指示剂。
常用的酸碱指示剂有紫色石蕊试液和无色酚酞试液。
酸碱指示剂发现者
清晨,一位花匠走进英国化学家波义耳的书房, 将一篮非常好看的深紫色的紫罗兰摆在屋角。美丽的花朵、诱人的清香,使波义耳心旷神怡。他随手拿了一束花向实验室走去。实验室里,助手正在倒盐酸,波义耳把花放在桌子上。赶紧去给助手帮忙。但不小心将盐酸溅到紫罗兰上,为了洗掉花瓣上的酸,他把花浸泡在水中。过一会儿,紫色花瓣上出现了红点点。波义尔对这一意外的发现,作出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。
实验探究
紫色石蕊试液在不同溶液中的颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入紫色石蕊试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
紫色石蕊试液遇酸性溶液变成红色
紫色石蕊试液遇碱性溶液变成蓝色
紫色石蕊试液在中性溶液中仍为紫色
无色酚酞试液在不同溶液中颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入无色酚酞试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
无色酚酞试液遇酸性溶液不变色
无色酚酞试液遇碱性溶液变成红色
无色酚酞试液在中性溶液中仍为无色
实验探究
酸碱指示剂:
酸性溶液 中性溶液 碱性溶液
紫色石蕊试液
无色酚酞试液
红色
紫色
蓝色
红色
(不变色)
(不变色)
温馨提示:和酸碱指示剂反应,变色的是指示剂,而不是酸、碱性溶液。因此,不能说指示剂使酸、碱性溶液变色。而应说:①酸、碱性溶液使指示剂变色②指示剂遇酸、碱性溶液变色
无色
无色
现有1瓶失去标签的无色溶液,取出少量滴入紫色石蕊试液后,溶液变成红色,该溶液一定是酸的溶液吗?
思维训练
不一定
H+
OH-
酸溶液
碱溶液
酸性
碱性
二、溶液酸碱性的强弱程度
1、溶液的酸碱性
(1)酸性:
酸性溶液: H+
酸性
(2)碱性:
碱性溶液: OH-
碱性
一、如何检验溶液的酸碱性
酸溶液(H+)
酸性溶液
一定
酸性溶液(H+)
不一定
酸溶液
碱溶液(OH-)
一定
碱性溶液
碱性溶液(OH-)
不一定
碱溶液
已知:NaHSO4的溶液呈酸性、Na2CO3的溶液呈碱性,它们的在水中解离情况如下:
NaHSO4=Na++H++SO42-
Na2CO3=2Na+ + CO32-
盐溶液
盐溶液
结合实验结果,小组讨论解答下列问题:
(1)上述溶液可分为几种类型?你是依据什么将溶液分类的?
(2)还有什么方法识别酸性或碱性的溶液呢?
分组讨论
水溶液的性质
水溶液的性质可以分为酸性溶液、碱性溶液和中性溶液。
用紫色石蕊试液可以区分酸和碱,但实验较麻烦,还可以用石蕊试纸进行区分。试纸比酸碱指示剂更易于携带,操作较方便。
红色石蕊试纸遇到碱溶液变成蓝色,
蓝色石蕊试纸遇到酸溶液变红色.
石蕊试纸的使用方法:
将石蕊试纸放在表面皿上,用玻璃棒蘸取试样溶液沾在石蕊试纸上,然后观察试纸颜色的变化。
为了使用方便,通常还用蓝色或红色石蕊试纸来检验溶液的酸碱性。
酸性溶液使蓝色石蕊试纸变红;碱性溶液使红色石蕊试纸变蓝.
结论:
【判断抢答】
1.石蕊、酚酞试液遇到酸或碱的溶液时,一定会发生颜色的变化。( )
提示:酚酞试液遇到酸溶液时就不会发生颜色的改变。
2.盐酸能使石蕊试液变红色,故能使石蕊试液变红色的一定是盐酸。( )
提示:酸性溶液都可使石蕊试液变红色。
3.能使酚酞试液变红色的溶液一定是碱溶液。( )
提示:碱性溶液一定能使酚酞试液变红。
×
×
X
在食醋和柠檬汁分别滴加紫色石蕊试液,石蕊试液都变红,说明食醋和柠檬汁都呈酸性,那么你知道谁的酸性强吗,你有方法区分吗?
思考
二、怎样判断溶液酸碱性的强弱
单位体积内含有氢离子的个数越多酸性越强。
单位体积内含有氢氧根离子的个数越多碱性越强。
1.酸碱性
2.酸碱性强弱与氢离子、氢氧根离子的数量关系
酸性溶液中都含有H+,使溶液呈酸性。
碱性溶液中都含有OH-,使溶液呈碱性。
酸碱性是物质的一种重要性质。
3.酸碱性强弱的表示方法——酸碱度pH
pH=7时,溶液呈中性
pH<7时,溶液呈酸性
pH>7时,溶液呈碱性
pH的范围通常在0~14之间:
二、怎样判断溶液酸碱性的强弱
用石蕊或酚酞试液可以检验出某溶液的酸碱性,
用pH来表示溶液的酸碱度:
当pH=7时,溶液呈 性;当 pH<7时,溶液呈 性 ,且pH越小 ;当pH>7时,溶液呈 性,且pH越大, 。
中
酸
酸性越强
碱
碱性越强
酸性溶液中的H+越多,则酸性越强;碱性溶液中的OH-越多,则碱性越强。
用什么来表示溶液的酸碱性的强弱程度呢?
4、pH的测定:
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
活动与探究:
用pH试纸测定溶液的pH
思考:甲同学在测定某碱溶液的pH时,先把pH试纸用水湿润再测,他所得的结果准确吗?
注意:
1.不能直接把试纸浸入试液,否则会污染试液。
2.不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。
(碱性溶液PH偏小,酸性溶液PH偏大,中性溶液PH不变。)
温馨提示
(1)试纸不能放到被测液中。
(2)pH的准确值是整数,及时记录下来 。
(3)要用玻璃棒蘸取另一种待测液时必须要清洗玻璃棒。
pH计
——测定pH的精确方法
讨论:
使用酸碱指示剂、广泛pH试纸判断物质酸碱性的异同点。
酸碱指示剂 pH试纸
共同点
不同点
都能判断物质的酸碱性
不能比较酸碱性强弱
能比较酸碱性强弱
但较粗略
思考
甲同学在测定某碱溶液的pH时,发现他所得结果比正确值小,请帮他分析一下造成这种结果的可能原因?
1、玻璃棒上沾有少量水
2、玻璃棒使用前没有洗干净,之前曾沾有酸性物质
3、读数时有误差
测定生活中一些物质的pH,说明它们的酸碱性:
pH 酸碱性 pH 酸碱性
橘汁 3~4 弱酸性 汽水 3~4 弱酸性
糖水 7 中性 自来水 6~7 弱酸性
牛奶 6~7 弱酸性 唾液 6~7 弱酸性
番茄汁 4~6 弱酸性 草木灰水 8~11 弱碱性
肥皂水 8~10 弱碱性 洗洁精 6~7 弱酸性
酸和碱对生命活动的意义
人运动之后身体会感到酸痛,你知道原因吗?人身体内的体液都显中性吗?为什么植物在盐碱地里生长的不旺盛呢?正常生长的pH范围是多大?
在正常的人体内,酸性与碱性物质总是保持一定的数量和比例,体液的pH总是稳定在一定范围内,这称为酸碱平衡,酸碱平衡失调会影响人的健康。
胃酸(主要成分是盐酸)能帮助消化食物,如果胃酸过多,就会导致胃痛;剧烈运动时,肌肉里产生的乳酸过多,会导致肌肉酸痛。
三、物质的酸碱性对生命活动的意义
1.酸碱性与人体的生理活动
2、酸和碱与人的生理活动密切相关
3、土壤的酸碱性对植物的生长非常重要
人体某些体液的正常pH范围
血液 唾液 胃液 乳汁 尿液
pH 7.35~7.45 6.6~7.1 0.8~1.5 6.4~6.7 5.0~7.0
大多数植物适宜在接近中性的土壤生长
西瓜6.0~7.0
苹果树6.0~8.0
小麦6.0~7.0
1.用石蕊试液和酚酞试液分别滴入同一物质的溶液中,下列现象不可能发生的是( ) A.滴入石蕊试液变红色,滴入酚酞试液不变色 B.滴入石蕊试液不变色,滴入酚酞试液不变色 C.滴入石蕊试液变蓝色,滴入酚酞试液变红色 D.滴入石蕊试液变红色,滴入酚酞试液变红色
D
目标检测
2.(2006,北京)下图是某些食物的近似pH,呈碱性的是( )
A B C D
D
3.(2005,陕西)一些常见食物的近似pH范围如下表:
食物 苹果 鸡蛋清 西红柿 葡萄 牛奶
pH 2.9~3.3 7.6~8.0 4.0~4.4 3.5~4.5 6.3~6.6
下列说法正确的是( ) A.葡萄汁能使酚酞试液变红 B.西红柿的酸性比苹果的酸性强 C.胃酸过多的人应少食苹果 D.牛奶的碱性比鸡蛋清的碱性强
C
4.(2005,太原)鲜肉是日常主要食品之一,新鲜度可以通过测试pH来判断。据资料,pH与肉的新鲜度的关系为:新鲜肉pH5.8~6.2;次鲜肉pH6.3~6.6;变质肉的pH在6.7以上。新鲜肉在变质的过程中,酸性强弱的变化为( )
A.变弱 B.变强 C.不变 D.无法确定
A
1.可以用酸碱指示剂识别酸和碱。
紫色石蕊试液遇到酸变成红色,遇到碱变为蓝色。 无色酚酞试液遇酸不变色,遇碱变成红色。
2.蓝色石蕊试纸遇到酸溶液变为红色,红色石蕊试纸遇到碱变成蓝色。
3.溶液酸碱性的强弱:在一定量的溶液中,氢离子的数量越大,酸性越强;氢氧根离子的数量越大,碱性越强。
pH数值范围:0~14
pH与溶液酸碱性的关系: pH<7 溶液呈酸性;
pH=7 溶液呈中性;
pH>7 溶液呈碱性
4.酸和碱对生命活动的意义非常重要。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
