第一节 酸及其性质 第二课时 课件(22张PPT)
文档属性
| 名称 | 第一节 酸及其性质 第二课时 课件(22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 817.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-05-31 20:20:35 | ||
图片预览







文档简介
课件22张PPT。 第二单元《常见的酸和碱》
第一节 酸及其性质
(第二课时)酸的化学性质鲁教版五四制九年级全一册化学学习目标一、知识与能力目标
1、通过实验探究,认识酸的化学性质及原因;
2、通过动手动脑,培养学生的观察能力,分析能力、解决问题的能力;
3、使学生逐步懂得从个别到一般的认识事物规律的过程。
二、过程与方法目标
1、通过对酸化学性质的探究,熟练书写化学方程式;
2、初步学会运用观察、实验等方法获取信息。
三、情感态度与价值目标
1、培养事实求是的科学探究态度;
2、保持和增强对生活和自然界中化学现象的好奇心和探究欲,提高学习化学的兴趣;
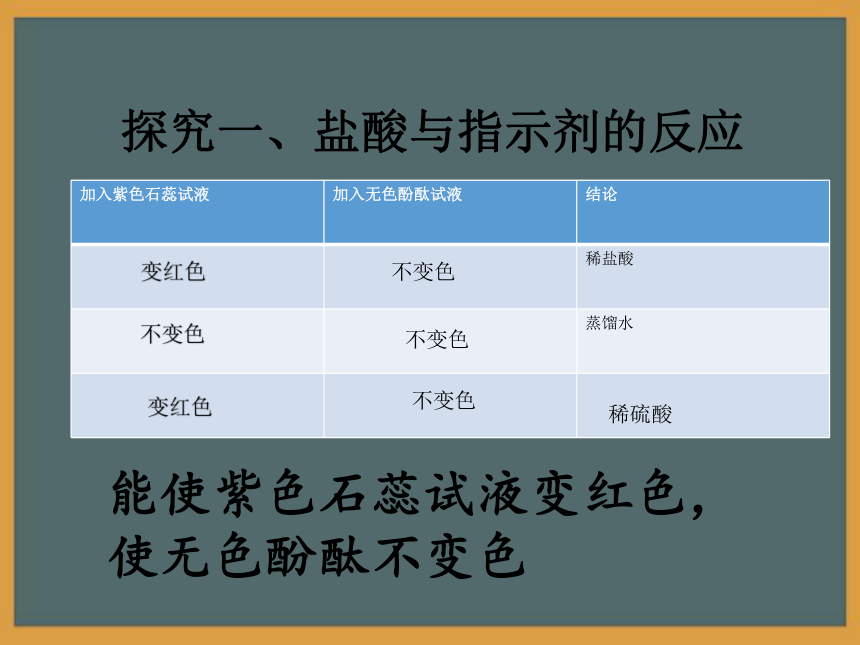
3、培养善于合作、勤于思考、严谨求实、用于探究的科学精神。 慧眼识酸 实验室有两瓶无色标签的液体分别是稀盐酸和蒸馏水。请同学们利用提供的试剂,将这些液体一次性鉴别出来。提供的试剂有:紫色石蕊试液、无色酚酞试液 取少量稀盐酸和蒸馏水分别放入井穴板中,分别加入几滴紫色石蕊试液和无色酚酞,观察现象。探究一、盐酸与指示剂的反应探究一、盐酸与指示剂的反应能使紫色石蕊试液变红色,
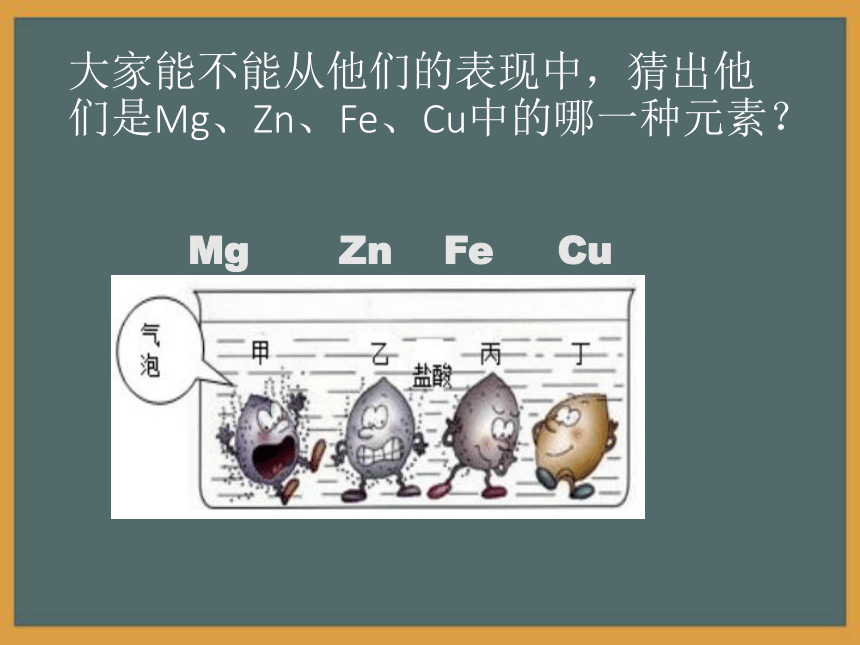
使无色酚酞不变色变红色不变色不变色不变色稀硫酸变红色不变色 “救救”金属金属王国有四位小王子,他们分别是Mg、Zn、Fe、Cu,当他们跌落在稀盐酸中的时候,同学们你先救哪一位呢?大家能不能从他们的表现中,猜出他们是Mg、Zn、Fe、Cu中的哪一种元素?Mg Zn Fe Cu探究二、酸与金属的反应 我、反应非常剧烈,产生气泡
反应速度适中,产生气泡反应比较慢,产生气泡,溶液变为浅绿色无明显变化化学方程式:Mg + 2HCl == MgCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑活泼金属 + 酸 → 盐 + 氢气 什么叫盐? 由金属离子和酸根离子构成的化合物称为盐。
例如:NaCl CaCO3 CuSO4
NH4Cl等
置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物 置换反应是四大基本反应类型之一注:单质铁参与置换反应时显+2价,含Fe2+ 的溶液为浅绿色怎样除去铁锈?工具:砂纸
试剂:生锈的铁钉、稀盐酸
仪器:试管、胶头滴管探究三、酸与金属氧化物的反应 向盛有一枚生锈铁钉的试管中加入稀盐酸,振荡,过一会观察现象。红色固体逐渐消失,溶液由无色变为黄色 Fe2O3 + 6HCl == 2FeCl3+ 3H2O注:含Fe3+的溶液为黄色在试管中加入少量氧化铜,滴入稀硫酸,加热,观察现象。现象:黑色粉末逐渐消失,溶液由无色变为蓝色。CuO+ H2SO4 == CuSO4+H2O 注:含Cu2+ 的溶液为蓝色 Fe2O3 + 6HCl == 2FeCl3+3H2O CuO+ H2SO4 == CuSO4+H2O 金属氧化物 + 酸 → 盐 + 水 1两种化两合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。特点:双交换,价不变复分解反应是四大基本反应类型之一小结 1、酸与指示剂作用
酸溶液能使紫色石蕊试液变红,无色酚酞试液不变色2、酸与金属反应如:Zn + 2HCl == ZnCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2↑3、酸与金属氧化物的反应如: Fe2O3 + 6HCl == 2FeCl3+ 3H2O
CuO+H2SO4 ==CuSO4 + H2O4、酸与盐的反应酸所具有的共同特点:
不同的酸在水溶液中都能电离出相同的氢离子,因此不同的酸溶液会具有许多共同的化学性质。请你回忆有关知识解释:为什么不同酸的水溶液有共同的化学性质? 1、 铁锈的主要成分是 它的颜色是 将一枚生锈的铁钉放入足量的盐酸中,首先观察到的现象是
过一段时间还能观察到的现象是
写出有关反应的化学方程式:氧化铁 红色铁锈逐渐溶解,溶液由无色变为黄色铁钉表面有气泡冒出Fe2O3 + 6HCl == 2FeCl3+ 3H2OFe+ 2HCl == FeCl2 + H2↑
效果检测 通过本节课的学习,还有那些方法可以区别稀盐酸和蒸馏水?2018年9月29日星期六1 想一想 这节课你又学了哪些知识??2018年9月29日星期六1再见!
1、通过实验探究,认识酸的化学性质及原因;
2、通过动手动脑,培养学生的观察能力,分析能力、解决问题的能力;
3、使学生逐步懂得从个别到一般的认识事物规律的过程。
二、过程与方法目标
1、通过对酸化学性质的探究,熟练书写化学方程式;
2、初步学会运用观察、实验等方法获取信息。
三、情感态度与价值目标
1、培养事实求是的科学探究态度;
2、保持和增强对生活和自然界中化学现象的好奇心和探究欲,提高学习化学的兴趣;
3、培养善于合作、勤于思考、严谨求实、用于探究的科学精神。 慧眼识酸 实验室有两瓶无色标签的液体分别是稀盐酸和蒸馏水。请同学们利用提供的试剂,将这些液体一次性鉴别出来。提供的试剂有:紫色石蕊试液、无色酚酞试液 取少量稀盐酸和蒸馏水分别放入井穴板中,分别加入几滴紫色石蕊试液和无色酚酞,观察现象。探究一、盐酸与指示剂的反应探究一、盐酸与指示剂的反应能使紫色石蕊试液变红色,
使无色酚酞不变色变红色不变色不变色不变色稀硫酸变红色不变色 “救救”金属金属王国有四位小王子,他们分别是Mg、Zn、Fe、Cu,当他们跌落在稀盐酸中的时候,同学们你先救哪一位呢?大家能不能从他们的表现中,猜出他们是Mg、Zn、Fe、Cu中的哪一种元素?Mg Zn Fe Cu探究二、酸与金属的反应 我、反应非常剧烈,产生气泡
反应速度适中,产生气泡反应比较慢,产生气泡,溶液变为浅绿色无明显变化化学方程式:Mg + 2HCl == MgCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑活泼金属 + 酸 → 盐 + 氢气 什么叫盐? 由金属离子和酸根离子构成的化合物称为盐。
例如:NaCl CaCO3 CuSO4
NH4Cl等
置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物 置换反应是四大基本反应类型之一注:单质铁参与置换反应时显+2价,含Fe2+ 的溶液为浅绿色怎样除去铁锈?工具:砂纸
试剂:生锈的铁钉、稀盐酸
仪器:试管、胶头滴管探究三、酸与金属氧化物的反应 向盛有一枚生锈铁钉的试管中加入稀盐酸,振荡,过一会观察现象。红色固体逐渐消失,溶液由无色变为黄色 Fe2O3 + 6HCl == 2FeCl3+ 3H2O注:含Fe3+的溶液为黄色在试管中加入少量氧化铜,滴入稀硫酸,加热,观察现象。现象:黑色粉末逐渐消失,溶液由无色变为蓝色。CuO+ H2SO4 == CuSO4+H2O 注:含Cu2+ 的溶液为蓝色 Fe2O3 + 6HCl == 2FeCl3+3H2O CuO+ H2SO4 == CuSO4+H2O 金属氧化物 + 酸 → 盐 + 水 1两种化两合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。特点:双交换,价不变复分解反应是四大基本反应类型之一小结 1、酸与指示剂作用
酸溶液能使紫色石蕊试液变红,无色酚酞试液不变色2、酸与金属反应如:Zn + 2HCl == ZnCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2↑3、酸与金属氧化物的反应如: Fe2O3 + 6HCl == 2FeCl3+ 3H2O
CuO+H2SO4 ==CuSO4 + H2O4、酸与盐的反应酸所具有的共同特点:
不同的酸在水溶液中都能电离出相同的氢离子,因此不同的酸溶液会具有许多共同的化学性质。请你回忆有关知识解释:为什么不同酸的水溶液有共同的化学性质? 1、 铁锈的主要成分是 它的颜色是 将一枚生锈的铁钉放入足量的盐酸中,首先观察到的现象是
过一段时间还能观察到的现象是
写出有关反应的化学方程式:氧化铁 红色铁锈逐渐溶解,溶液由无色变为黄色铁钉表面有气泡冒出Fe2O3 + 6HCl == 2FeCl3+ 3H2OFe+ 2HCl == FeCl2 + H2↑
效果检测 通过本节课的学习,还有那些方法可以区别稀盐酸和蒸馏水?2018年9月29日星期六1 想一想 这节课你又学了哪些知识??2018年9月29日星期六1再见!
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
