第一节 酸及其性质 课件(19张PPT)
文档属性
| 名称 | 第一节 酸及其性质 课件(19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 300.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-05 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
吃过 吗
你
“醋”
甜苦辣咸,五味酸居首。足以说明酸在我们生活中的重要性。你已经知道哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?
你知道吗?
1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、酸雨里含有什么酸?
酸
结论:
1、人的胃液里含有盐酸;
2、汽车电瓶里含有硫酸;
3、食醋里含有醋酸,也叫乙酸;
4、酸雨里含有亚硫酸,也可能含有硝酸。
常见的酸
第一节 酸及其性质
学 习 目 标
重、难点
1、浓硫酸的稀释、吸水性
2、酸的化学性质
1、记住酸的名称和化学式 。
2、通过观察浓硫酸和浓盐酸,记住他们的主要物理性质 。
3、掌握酸的化学性质,熟练书写有关的化学方程式。
常见的酸
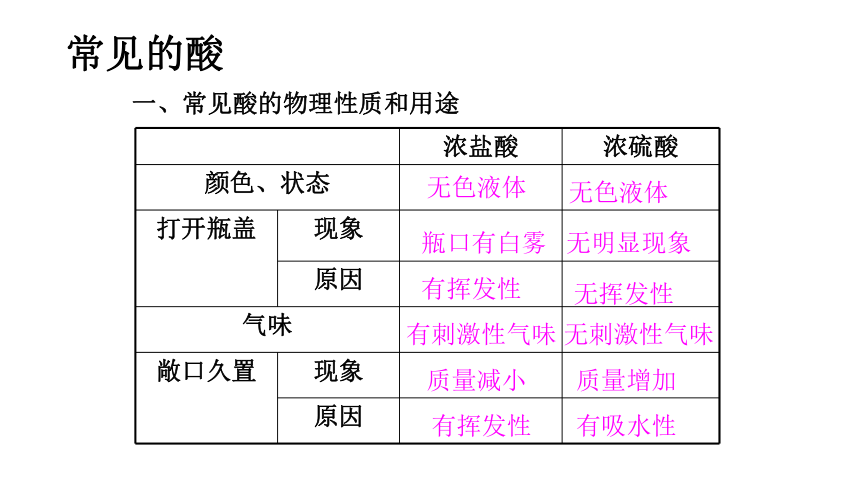
一、常见酸的物理性质和用途
浓盐酸 浓硫酸
颜色、状态
打开瓶盖 现象
原因
气味
敞口久置 现象
原因
无色液体
无色液体
瓶口有白雾
无明显现象
有挥发性
无挥发性
有刺激性气味
无刺激性气味
质量减小
质量增加
有挥发性
有吸水性
讨论: 敞口久置于空气中的浓盐酸和浓硫酸, 各成分怎样变化
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
减少
减少
减少
减少
不变
增加
增加
不变
二、浓硫酸的腐蚀性
实验内容 浓硫酸在纸上写字 用木棍蘸浓硫酸 将浓硫酸滴到布上
一段时间后的现象
结论或原因 启发 纸张的笔画部分变黑
木棒上蘸有浓硫酸的部分变黑
滴到酸的布由黄变黑
浓硫酸有很强的腐蚀性,能使纸张、木条、布甚至皮肤脱水而腐蚀
使用浓硫酸要特别小心
常见浓硫酸的溶质质量分数为98%,密度是1.84g·cm-3。浓硫酸能吸收水蒸气,溶于水放出大量的热量,有很强的吸水性。
浓硫酸的特性
浓硫酸的特性
可以利用浓硫酸的吸水性将其作为干燥剂,干燥一些不与它反应的气体,比如O2、CO2、H2等。浓硫酸滴到纸张、蔗糖上,会使纸张、蔗糖炭化。稀硫酸滴到纸张上,在水分挥发的过程中也会使纸张逐渐炭化。浓硫酸还会腐蚀衣物和皮肤。
你能得出答案吗?
1.下列各物质露置在空气中,一段时间后,物质的总质量会增加的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.醋酸
C
酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。
稀盐酸与指示剂的作用
探究二:
实验内容 现象
将稀盐酸滴入紫色石蕊试液中
将稀盐酸滴入无色酚酞试液中
二、 酸的化学性质
酸能使紫色石蕊试液变红色
酸不能使无色酚酞变色
探究三:稀盐酸的化学性质
实验内容 现象
稀盐酸与镁条的反应
稀盐酸与铁锈(Fe2O3)的反应
稀盐酸与硝酸银溶液的反应
稀盐酸与碳酸钠粉末的反应
稀盐酸与氯化钡溶液的反应
用稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:
总结:
复分解反应:两种化合物相互交换成分,生成另外两种新的化合物的反应。
一、常见的酸
判断反应类型
1、2H20== 2H2↑+O2↑________
2、3Fe+2O2==2Fe3O4________________
3、NaOH+HCl==NaCl+H2O_______
通电
点燃
分解反应
化合反应
复分解反应
盐:由金属阳离子和酸根离子形成的化合物。如:CaCO3、Na2CO3、AgNO3、NaCl等
----
-----
----
---
温故而知新:
1、石灰石的主要成分是什么?请写出稀盐酸与石灰石的主要成分反应的化学方程式。
2、试着写出稀盐酸与碳酸钠(Na2CO3)反应的化学方程式
一、常见的酸
CaCO3 + 2HCl == CaCl2+CO2↑+ H2O
Na2CO3+2HCl==2NaCl+CO2↑+ H2O
总结:酸所具有的共同化学性质
1、酸在水溶液中都能电离出 因此酸溶液会具有许多共同的性质。如:
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:是指示剂变色,而非待测溶液本身变色。
一、常见的酸
氢离子,
物质
纯净物
混合物
化合物
单质
氧
化
物
酸 碱 盐
Mg
Fe2O3
CaCO3、CuCl2、
金属氧化物
非金属氧化物
金属
非金属
物质的分类
常见酸的主要用途及年产量
名称 年产量(万吨) 主要用途
浓硫酸
浓盐酸
浓硝酸
7120
化肥、农药、炸药、医药、染料及冶金,石油化工、轻工纺织等
839
制药、作除锈剂
235
化肥、炸药、染料,医药、橡胶、塑料及冶金、化工等领域
吃过 吗
你
“醋”
甜苦辣咸,五味酸居首。足以说明酸在我们生活中的重要性。你已经知道哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?
你知道吗?
1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、酸雨里含有什么酸?
酸
结论:
1、人的胃液里含有盐酸;
2、汽车电瓶里含有硫酸;
3、食醋里含有醋酸,也叫乙酸;
4、酸雨里含有亚硫酸,也可能含有硝酸。
常见的酸
第一节 酸及其性质
学 习 目 标
重、难点
1、浓硫酸的稀释、吸水性
2、酸的化学性质
1、记住酸的名称和化学式 。
2、通过观察浓硫酸和浓盐酸,记住他们的主要物理性质 。
3、掌握酸的化学性质,熟练书写有关的化学方程式。
常见的酸
一、常见酸的物理性质和用途
浓盐酸 浓硫酸
颜色、状态
打开瓶盖 现象
原因
气味
敞口久置 现象
原因
无色液体
无色液体
瓶口有白雾
无明显现象
有挥发性
无挥发性
有刺激性气味
无刺激性气味
质量减小
质量增加
有挥发性
有吸水性
讨论: 敞口久置于空气中的浓盐酸和浓硫酸, 各成分怎样变化
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
减少
减少
减少
减少
不变
增加
增加
不变
二、浓硫酸的腐蚀性
实验内容 浓硫酸在纸上写字 用木棍蘸浓硫酸 将浓硫酸滴到布上
一段时间后的现象
结论或原因 启发 纸张的笔画部分变黑
木棒上蘸有浓硫酸的部分变黑
滴到酸的布由黄变黑
浓硫酸有很强的腐蚀性,能使纸张、木条、布甚至皮肤脱水而腐蚀
使用浓硫酸要特别小心
常见浓硫酸的溶质质量分数为98%,密度是1.84g·cm-3。浓硫酸能吸收水蒸气,溶于水放出大量的热量,有很强的吸水性。
浓硫酸的特性
浓硫酸的特性
可以利用浓硫酸的吸水性将其作为干燥剂,干燥一些不与它反应的气体,比如O2、CO2、H2等。浓硫酸滴到纸张、蔗糖上,会使纸张、蔗糖炭化。稀硫酸滴到纸张上,在水分挥发的过程中也会使纸张逐渐炭化。浓硫酸还会腐蚀衣物和皮肤。
你能得出答案吗?
1.下列各物质露置在空气中,一段时间后,物质的总质量会增加的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.醋酸
C
酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。
稀盐酸与指示剂的作用
探究二:
实验内容 现象
将稀盐酸滴入紫色石蕊试液中
将稀盐酸滴入无色酚酞试液中
二、 酸的化学性质
酸能使紫色石蕊试液变红色
酸不能使无色酚酞变色
探究三:稀盐酸的化学性质
实验内容 现象
稀盐酸与镁条的反应
稀盐酸与铁锈(Fe2O3)的反应
稀盐酸与硝酸银溶液的反应
稀盐酸与碳酸钠粉末的反应
稀盐酸与氯化钡溶液的反应
用稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:
总结:
复分解反应:两种化合物相互交换成分,生成另外两种新的化合物的反应。
一、常见的酸
判断反应类型
1、2H20== 2H2↑+O2↑________
2、3Fe+2O2==2Fe3O4________________
3、NaOH+HCl==NaCl+H2O_______
通电
点燃
分解反应
化合反应
复分解反应
盐:由金属阳离子和酸根离子形成的化合物。如:CaCO3、Na2CO3、AgNO3、NaCl等
----
-----
----
---
温故而知新:
1、石灰石的主要成分是什么?请写出稀盐酸与石灰石的主要成分反应的化学方程式。
2、试着写出稀盐酸与碳酸钠(Na2CO3)反应的化学方程式
一、常见的酸
CaCO3 + 2HCl == CaCl2+CO2↑+ H2O
Na2CO3+2HCl==2NaCl+CO2↑+ H2O
总结:酸所具有的共同化学性质
1、酸在水溶液中都能电离出 因此酸溶液会具有许多共同的性质。如:
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:是指示剂变色,而非待测溶液本身变色。
一、常见的酸
氢离子,
物质
纯净物
混合物
化合物
单质
氧
化
物
酸 碱 盐
Mg
Fe2O3
CaCO3、CuCl2、
金属氧化物
非金属氧化物
金属
非金属
物质的分类
常见酸的主要用途及年产量
名称 年产量(万吨) 主要用途
浓硫酸
浓盐酸
浓硝酸
7120
化肥、农药、炸药、医药、染料及冶金,石油化工、轻工纺织等
839
制药、作除锈剂
235
化肥、炸药、染料,医药、橡胶、塑料及冶金、化工等领域
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
