第一节 酸及其性质 教学设计 (3)
图片预览

文档简介
《第一节 酸及其性质》教案
一、教材分析
通过学习本节内容,注重发展学生的基本观念,在学习酸的过程中,不断发展和深化化学基本观念,特别是微粒观、变化观、分类观、化学的价值观。21世纪教育网
二、学情分析
学生对酸并不陌生,在日常生活中经常能接触到酸,通过前面的学习,又知道盐酸可以与大理石反应生成二氧化碳,二氧化碳的水溶液叫碳酸,但学生对酸的组成、结构和性质并不清楚,也急于了解,所以要充分利用学生已知的,激发学生对未知的兴趣,引导学生进入酸的世界。21教育网
三、教学方法
本节教学通过学生熟悉的一些生活现象和熟悉的物质创设问题情景,把学生组织起来迅速融入到教学情境中,推动使学生提出问题——实验探究——讨论交流——得出结论。使学生更真切地感受到化学就在自己身边。使学生手、脑、口并用,共同完成教学目标,培养学生对知识进行总结、概括和归纳的能力。21cnjy.com
四、教学目标
(一)、知识与技能:
1、记住酸的物理性质,了解酸的结构、性质与变化,了解酸的通性。
2、学会浓硫酸的稀释方法。
3、会用酸碱指示剂和pH试纸检验溶液的酸碱性。
4、认识复分解反应的特点。
(二)、过程与方法:
1、通过比较盐酸和硫酸的化学性质,学习概括、分类、演绎等科学思维。
2、通过观察实验等方法锻炼学生收集信息的能力。
(三)、情感态度与价值观:
增进学生对科学探究的理解,发展科学探究能力。
五、教学重难点
(一)、重点:
酸类物质的组成与结构特点、化学性质与变化规律。
(二)、难点:
比较盐酸和硫酸的化学性质,从微观粒子氢离子的角度认识溶液呈酸性的原因,建立宏观和微观相联系的思维方式。21·cn·jy·com
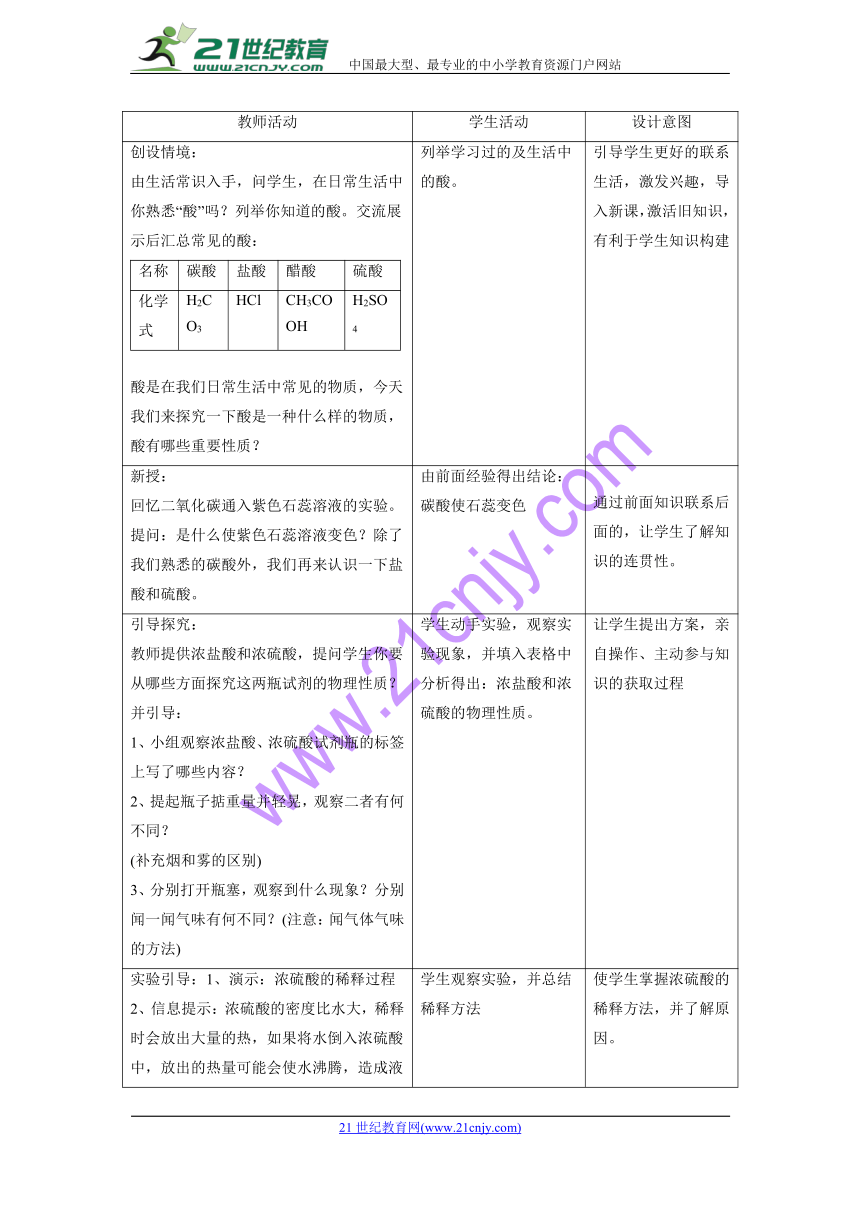
六、教学过程
教师活动
学生活动
设计意图
创设情境:
由生活常识入手,问学生,在日常生活中你熟悉“酸”吗?列举你知道的酸。交流展示后汇总常见的酸:
名称
碳酸
盐酸
醋酸
硫酸
化学式
H2CO3
HCl
CH3COOH
H2SO4
酸是在我们日常生活中常见的物质,今天我们来探究一下酸是一种什么样的物质,酸有哪些重要性质?
列举学习过的及生活中的酸。
引导学生更好的联系生活,激发兴趣,导入新课,激活旧知识,有利于学生知识构建
新授:
回忆二氧化碳通入紫色石蕊溶液的实验。提问:是什么使紫色石蕊溶液变色?除了我们熟悉的碳酸外,我们再来认识一下盐酸和硫酸。
由前面经验得出结论:碳酸使石蕊变色
通过前面知识联系后面的,让学生了解知识的连贯性。
引导探究:
教师提供浓盐酸和浓硫酸,提问学生你要从哪些方面探究这两瓶试剂的物理性质?并引导:
1、小组观察浓盐酸、浓硫酸试剂瓶的标签上写了哪些内容?
2、提起瓶子掂重量并轻晃,观察二者有何不同?
(补充烟和雾的区别)
3、分别打开瓶塞,观察到什么现象?分别闻一闻气味有何不同?(注意:闻气体气味的方法)
学生动手实验,观察实验现象,并填入表格中
分析得出:浓盐酸和浓硫酸的物理性质。
让学生提出方案,亲自操作、主动参与知识的获取过程
实验引导:1、演示:浓硫酸的稀释过程
2、信息提示:浓硫酸的密度比水大,稀释时会放出大量的热,如果将水倒入浓硫酸中,放出的热量可能会使水沸腾,造成液滴飞溅伤人。
学生观察实验,并总结稀释方法
使学生掌握浓硫酸的稀释方法,并了解原因。
拓展应用:
1、通过以上的自主学习,你有哪些方法来区分浓盐酸和浓硫酸?
2、露置于空气中的浓盐酸和浓硫酸的溶质质量分数有什么变化?是什么原因?
小组内交流后展示结果
巩固学生对它们物理性质的理解。
过渡衔接:
通过以上的学习,你对酸有了哪些认识?酸的化学性质有哪些呢,下面我通过实验来探究一下。
上下衔接好
实验探究:
(一)盐酸能与下列这些物质反应吗?
[提出问题]镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液。
[建立假设] 能与盐酸反应, 不能与盐酸反应。
[收集证据]分别向盛有镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液七支试管中加入少量的稀盐酸,观察并记录现象。
[获得结论] 能与盐酸反应, 不能与盐酸反应。
【教师活动】引导学生实验交流,强调注意安全,并引导学生分析参加反应的物质在反应过程中产生的产物,引导学生写出化学方程式。
分组进行实验探究,交流探究结果和实验现象及得到的结论,尝试书写化学方程式。得出盐酸可以使紫色石蕊试液变红、常温下能与镁条、生锈铁钉、碳酸钠、硝酸银溶液、发生反应。
训练学生从观察和实验获取信息的能力。
通过与他人的交流,完善自己的结论。
帮助学生掌握有关化学方程式的书写。
根据问题,分析交流:
1、稀盐酸溶液的主要组成?
2、根据镁原子与氢离子的微观相互作用的过程,分析探究盐酸中的哪种粒子与金属镁发生反应?如何验证生成的气体?
3、根据盐酸与硝酸银溶液反应微观过程,分析盐酸与硝酸银溶液反应实质?
讨论方案,进行交流,实验探究
培养学生设计方案、动手实践的能力。
归纳小结:
1、盐酸与物质反应,实质上都是物质与盐酸电离出的氢离子发生的反应。实验证明,出盐酸可以使紫色石蕊试液变红、常温下能与镁条、生锈铁钉、碳酸钠、硝酸银溶液、发生反应。
2、盐酸与硝酸银溶液的反应,实质上是两种化合物互相交换成分,生成另外两种化合物。这类化学反应叫得分解反应。像Na2CO3 、BaCl2 、MgCl2 、NaCl、FeCl3等均是由金属阳离子和酸根阴离子构成的化合物,化学上把这类化合物合称为盐。
实验探究:
(二)硫酸能与下列这些物质反应吗?
[提出问题]镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液。
[建立假设] 能与硫酸反应, 不能与硫酸酸反应。
[收集证据]分别向盛有镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液七支试管中加入少量的稀硫酸,观察并记录现象。
[获得结论] 能与硫酸反应, 不能与硫酸反应。
【教师活动】
1、引导学生实验交流,强调注意安全,并引导学生分析参加反应的物质在反应过程中产生的产物,引导学生写出化学方程式。
2、投影引导学生纠正错误的化学方程式。
思考、讨论、交流,硫酸溶于水也能电离出氢离子,因此其他酸也应该能发生类似的反应。练习书写化学方程式。指出有关反应的类型。
培养学生由一般到个别的演绎推理的思维方法。
归纳总结:
1、通过探究,你能归纳出酸类物质的共性吗?
2、这种共性的产生原因是什么?
学生思考回答:酸溶液中都有氢离子,酸的性质其实就是H+的性质。
让学生尝试运用完全归纳法得到酸的共性。
拓展提高:
1、日常生活中白醋通常放在什么容器中,能不能用铁桶盛放?为什么?
2、浓硫酸可以盛放在铁桶中,为什么稀硫酸不能?
3、通过上述探究,你认为酸有哪些用途?
回答问题,运用巩固所学新知识。
让学生在解决实际问题的同时体验成功。
交流共享,课堂小结:
在同学们的积极参与下,我们这节课快要结束了,相信同学们这节课一定有很多的收获,下面我们来交流一下吧。
通过交流总结评价自己的学习情况。
培养学生进行自我总结、自我评价的能力,养成良好的学习习惯。
实践作业:
探究酸雨的形成原因及危害。
学生可以通过多种途径查阅资料。
培养学生自己查阅资料的能力,强化学生环保意识。
一、教材分析
通过学习本节内容,注重发展学生的基本观念,在学习酸的过程中,不断发展和深化化学基本观念,特别是微粒观、变化观、分类观、化学的价值观。21世纪教育网
二、学情分析
学生对酸并不陌生,在日常生活中经常能接触到酸,通过前面的学习,又知道盐酸可以与大理石反应生成二氧化碳,二氧化碳的水溶液叫碳酸,但学生对酸的组成、结构和性质并不清楚,也急于了解,所以要充分利用学生已知的,激发学生对未知的兴趣,引导学生进入酸的世界。21教育网
三、教学方法
本节教学通过学生熟悉的一些生活现象和熟悉的物质创设问题情景,把学生组织起来迅速融入到教学情境中,推动使学生提出问题——实验探究——讨论交流——得出结论。使学生更真切地感受到化学就在自己身边。使学生手、脑、口并用,共同完成教学目标,培养学生对知识进行总结、概括和归纳的能力。21cnjy.com
四、教学目标
(一)、知识与技能:
1、记住酸的物理性质,了解酸的结构、性质与变化,了解酸的通性。
2、学会浓硫酸的稀释方法。
3、会用酸碱指示剂和pH试纸检验溶液的酸碱性。
4、认识复分解反应的特点。
(二)、过程与方法:
1、通过比较盐酸和硫酸的化学性质,学习概括、分类、演绎等科学思维。
2、通过观察实验等方法锻炼学生收集信息的能力。
(三)、情感态度与价值观:
增进学生对科学探究的理解,发展科学探究能力。
五、教学重难点
(一)、重点:
酸类物质的组成与结构特点、化学性质与变化规律。
(二)、难点:
比较盐酸和硫酸的化学性质,从微观粒子氢离子的角度认识溶液呈酸性的原因,建立宏观和微观相联系的思维方式。21·cn·jy·com
六、教学过程
教师活动
学生活动
设计意图
创设情境:
由生活常识入手,问学生,在日常生活中你熟悉“酸”吗?列举你知道的酸。交流展示后汇总常见的酸:
名称
碳酸
盐酸
醋酸
硫酸
化学式
H2CO3
HCl
CH3COOH
H2SO4
酸是在我们日常生活中常见的物质,今天我们来探究一下酸是一种什么样的物质,酸有哪些重要性质?
列举学习过的及生活中的酸。
引导学生更好的联系生活,激发兴趣,导入新课,激活旧知识,有利于学生知识构建
新授:
回忆二氧化碳通入紫色石蕊溶液的实验。提问:是什么使紫色石蕊溶液变色?除了我们熟悉的碳酸外,我们再来认识一下盐酸和硫酸。
由前面经验得出结论:碳酸使石蕊变色
通过前面知识联系后面的,让学生了解知识的连贯性。
引导探究:
教师提供浓盐酸和浓硫酸,提问学生你要从哪些方面探究这两瓶试剂的物理性质?并引导:
1、小组观察浓盐酸、浓硫酸试剂瓶的标签上写了哪些内容?
2、提起瓶子掂重量并轻晃,观察二者有何不同?
(补充烟和雾的区别)
3、分别打开瓶塞,观察到什么现象?分别闻一闻气味有何不同?(注意:闻气体气味的方法)
学生动手实验,观察实验现象,并填入表格中
分析得出:浓盐酸和浓硫酸的物理性质。
让学生提出方案,亲自操作、主动参与知识的获取过程
实验引导:1、演示:浓硫酸的稀释过程
2、信息提示:浓硫酸的密度比水大,稀释时会放出大量的热,如果将水倒入浓硫酸中,放出的热量可能会使水沸腾,造成液滴飞溅伤人。
学生观察实验,并总结稀释方法
使学生掌握浓硫酸的稀释方法,并了解原因。
拓展应用:
1、通过以上的自主学习,你有哪些方法来区分浓盐酸和浓硫酸?
2、露置于空气中的浓盐酸和浓硫酸的溶质质量分数有什么变化?是什么原因?
小组内交流后展示结果
巩固学生对它们物理性质的理解。
过渡衔接:
通过以上的学习,你对酸有了哪些认识?酸的化学性质有哪些呢,下面我通过实验来探究一下。
上下衔接好
实验探究:
(一)盐酸能与下列这些物质反应吗?
[提出问题]镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液。
[建立假设] 能与盐酸反应, 不能与盐酸反应。
[收集证据]分别向盛有镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液七支试管中加入少量的稀盐酸,观察并记录现象。
[获得结论] 能与盐酸反应, 不能与盐酸反应。
【教师活动】引导学生实验交流,强调注意安全,并引导学生分析参加反应的物质在反应过程中产生的产物,引导学生写出化学方程式。
分组进行实验探究,交流探究结果和实验现象及得到的结论,尝试书写化学方程式。得出盐酸可以使紫色石蕊试液变红、常温下能与镁条、生锈铁钉、碳酸钠、硝酸银溶液、发生反应。
训练学生从观察和实验获取信息的能力。
通过与他人的交流,完善自己的结论。
帮助学生掌握有关化学方程式的书写。
根据问题,分析交流:
1、稀盐酸溶液的主要组成?
2、根据镁原子与氢离子的微观相互作用的过程,分析探究盐酸中的哪种粒子与金属镁发生反应?如何验证生成的气体?
3、根据盐酸与硝酸银溶液反应微观过程,分析盐酸与硝酸银溶液反应实质?
讨论方案,进行交流,实验探究
培养学生设计方案、动手实践的能力。
归纳小结:
1、盐酸与物质反应,实质上都是物质与盐酸电离出的氢离子发生的反应。实验证明,出盐酸可以使紫色石蕊试液变红、常温下能与镁条、生锈铁钉、碳酸钠、硝酸银溶液、发生反应。
2、盐酸与硝酸银溶液的反应,实质上是两种化合物互相交换成分,生成另外两种化合物。这类化学反应叫得分解反应。像Na2CO3 、BaCl2 、MgCl2 、NaCl、FeCl3等均是由金属阳离子和酸根阴离子构成的化合物,化学上把这类化合物合称为盐。
实验探究:
(二)硫酸能与下列这些物质反应吗?
[提出问题]镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液。
[建立假设] 能与硫酸反应, 不能与硫酸酸反应。
[收集证据]分别向盛有镁条、生锈铁钉、碳酸钠、氯化钡溶液、硝酸银溶液、紫色石蕊试液、酚酞试液七支试管中加入少量的稀硫酸,观察并记录现象。
[获得结论] 能与硫酸反应, 不能与硫酸反应。
【教师活动】
1、引导学生实验交流,强调注意安全,并引导学生分析参加反应的物质在反应过程中产生的产物,引导学生写出化学方程式。
2、投影引导学生纠正错误的化学方程式。
思考、讨论、交流,硫酸溶于水也能电离出氢离子,因此其他酸也应该能发生类似的反应。练习书写化学方程式。指出有关反应的类型。
培养学生由一般到个别的演绎推理的思维方法。
归纳总结:
1、通过探究,你能归纳出酸类物质的共性吗?
2、这种共性的产生原因是什么?
学生思考回答:酸溶液中都有氢离子,酸的性质其实就是H+的性质。
让学生尝试运用完全归纳法得到酸的共性。
拓展提高:
1、日常生活中白醋通常放在什么容器中,能不能用铁桶盛放?为什么?
2、浓硫酸可以盛放在铁桶中,为什么稀硫酸不能?
3、通过上述探究,你认为酸有哪些用途?
回答问题,运用巩固所学新知识。
让学生在解决实际问题的同时体验成功。
交流共享,课堂小结:
在同学们的积极参与下,我们这节课快要结束了,相信同学们这节课一定有很多的收获,下面我们来交流一下吧。
通过交流总结评价自己的学习情况。
培养学生进行自我总结、自我评价的能力,养成良好的学习习惯。
实践作业:
探究酸雨的形成原因及危害。
学生可以通过多种途径查阅资料。
培养学生自己查阅资料的能力,强化学生环保意识。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
