第二节 碱及其性质 课件(24张PPT)
文档属性
| 名称 | 第二节 碱及其性质 课件(24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 774.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-05 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第二节 碱及其性质
1.认识碱的性质,理解碱的化学性质实质是OH-的性质。
2.认识几种重要的碱,掌握使用碱的方法。
3.通过对碱的性质的开放性探究活动,引领学生进一步提高科学探究能力。
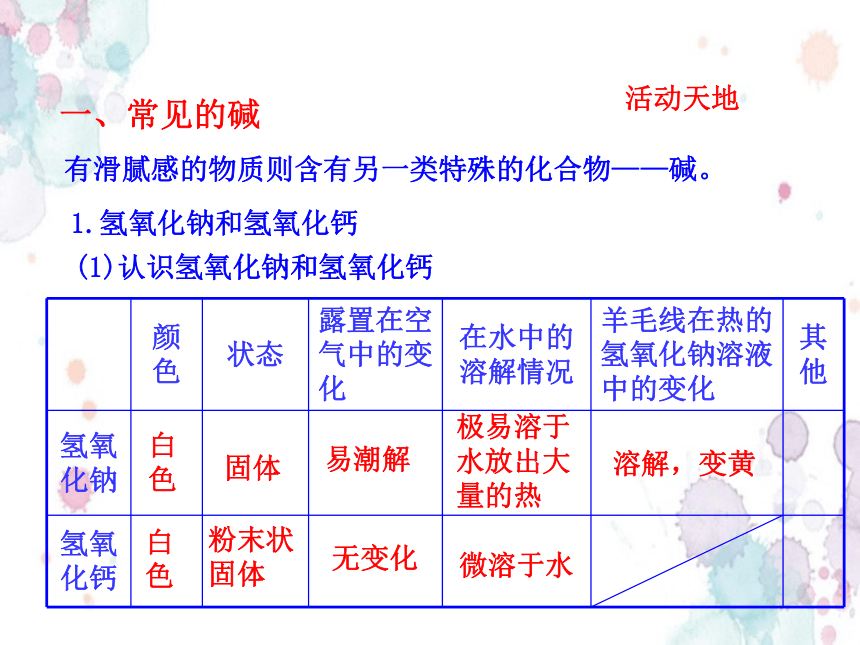
一、常见的碱
1.氢氧化钠和氢氧化钙
(1)认识氢氧化钠和氢氧化钙
活动天地
颜色 状态 露置在空气中的变化 在水中的溶解情况 羊毛线在热的氢氧化钠溶液中的变化 其他
氢氧化钠
氢氧化钙
白色
固体
粉末状
固体
白
色
微溶于水
极易溶于水放出大量的热
易潮解
无变化
溶解,变黄
有滑腻感的物质则含有另一类特殊的化合物——碱。
(3)氢氧化钙[Ca(OH)2]
(2)氢氧化钠(NaOH)
a.俗名:熟石灰、消石灰
①暴露在空气中易吸收空气中的水蒸气而溶解,因此应密封保存。
②俗称苛性钠、火碱或烧碱,有强烈的腐蚀性。若不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上硼酸溶液。
CaO + H2O ==== Ca(OH)2
生石灰 熟石灰
反应的过程中放出大量的热。
b.氢氧化钙的制备
工业上通过高温煅烧石灰石生产生石灰:
CaCO3 ==== CaO+CO2↑
氧化钙俗称生石灰,具有吸水性,常用作干燥剂。
除氢氧化钠( NaOH ) 、氢氧化钙 [Ca(OH)2 ]外,常用
的碱还有氢氧化钾( KOH )、氢氧化钡[Ba(OH)2 ] 等。
ND型气烧石灰窑
高温
俗称 苛性钠、火碱、烧碱
(强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热,溶液有涩味和滑腻感 微溶于水
(溶液俗称石灰水)
其他 易潮解
(做干燥剂) 可由生石灰加水制得(放热)
CaO+H2O====Ca(OH)2
用途 化工原料:肥皂、石油、造纸、纺织、印染等工业 砌砖、抹墙;降低土壤酸性;制波尔多液、制石硫合剂农药
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
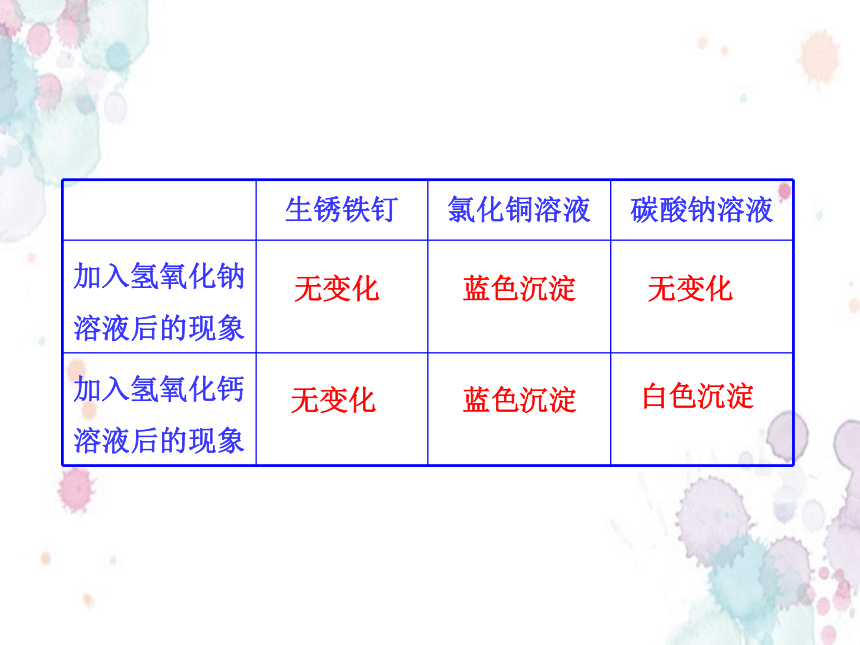
(1)氢氧化钠和氢氧化钙的化学性质的实验探究
①在3支试管中分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量氢氧化钠溶液。观察并记录实验现象。
②另取3支试管,再分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量澄清石灰水。观察并记录实验现象。完成下列表格。
2.碱的化学性质
生锈铁钉 氯化铜溶液 碳酸钠溶液
加入氢氧化钠溶液后的现象
加入氢氧化钙溶液后的现象
无变化
无变化
蓝色沉淀
蓝色沉淀
无变化
白色沉淀
②氢氧化钠和非金属氧化物反应
①氢氧化钠和酸碱指示剂反应
2NaOH+CO2====Na2CO3+H2O
必须密封保存
(隔绝水蒸气和二氧化碳)
(2)氢氧化钠(NaOH)的化学性质
③氢氧化钠和某些盐反应
2NaOH+CuSO4====Na2SO4+Cu(OH)2↓
3NaOH+FeCl3====3NaCl+Fe(OH)3↓
生成蓝色沉淀
生成红褐色沉淀
②氢氧化钙和非金属氧化物反应
③氢氧化钙和某些盐反应
①氢氧化钙和酸碱指示剂反应
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
Ca(OH)2+CO2====CaCO3↓+H2O
鉴别二氧化碳气体
用石灰砂浆砌砖
制造氢氧化钠
(3)氢氧化钙 Ca(OH)2 的化学性质
(4)碱的通性
由于碱溶液中都有OH-,因此它们具有相似的化学性质。
②与某些非金属氧化物反应
碱 + 非金属氧化物→盐 + 水
如:2NaOH + CO2 ==== Na2CO3 + H2O
Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
①与酸碱指示剂的作用
紫色石蕊试液遇到碱溶液变蓝色;
无色酚酞试液遇到碱溶液变红色。
③与某些盐反应
碱 + 盐 → 新碱 + 新盐
如: CuCl2 + 2NaOH ==== 2NaCl + Cu(OH)2↓
Ca(OH)2 + Na2CO3 ==== 2NaOH + CaCO3↓
3.碱的通性与酸的通性对比
b.碱+非金属氧化物→盐+水
c.碱+盐→新盐+新碱
a.碱溶液能和酸碱指示
剂反应
酸的通性
b.酸+金属→盐+氢气
c.酸+金属氧化物→盐+水
d.酸+盐→新盐+新酸
a.酸溶液能和酸碱指示
剂反应
碱的通性
知识点一:碱的化学性质
【典例1】航天员的生命活动和工作能力的必需装备——航天
服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不
可能具有的化学性质是( )
A.与酸碱指示剂反应
B.与二氧化碳反应
C.与氧化铁反应
D.与氯化铜溶液反应
C
知识点二:碱的使用、碱的用途等
【典例2】下列物质敞口放置在空气中一段时间后,发生
质变的是( )
A.浓硫酸 B.浓盐酸
C.氢氧化钠溶液 D.氯化钠溶液
C
1.碱溶液有相似的化学性质的原因是碱溶液中都含有( )
A.氢离子 B.氢氧根离子 C.金属离子 D.酸根离子
B
2.下列物质与盐酸反应后所得的溶液中,加入氢氧化
钠溶液,能产生红褐色沉淀的是( )
A.Fe B.Fe2O3 C.CuO D.FeO
B
3.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂
中的( )
A.水 B.CaCl2溶液
C.CO2气体 D.澄清石灰水
D
4.(双选)下列氧化物中,既不和酸反应,又不和碱反应的是
( )
A.CO2 B.CO
C.Fe2O3 D.H2O
BD
5. (双选)下列关于氢氧化钠的描述中错误的是( )
(提示:牵牛花的变色特点类似紫色石蕊试剂)
A.能去除油污,可做炉具的清洁剂
B.在空气中能与二氧化碳反应生成碳酸钙
C.易溶于水,溶解时放出大量的热
D.水溶液能使牵牛花汁液变红
BD
6.下图广口瓶分别装入下列各组中的气体,滴管分别滴入
各组中的液体
①氢气、浓硫酸 ②氮气、苛性钠溶液
③氯化氢、水 ④二氧化碳、烧碱溶液
(1)玻璃管下端所系气球能鼓起来的是 (填序号)
(2)若发生化学反应,请
写出有关的化学方程式:
_______________________________
a
X
Y
③④
2NaOH+CO2====Na2CO3+H2O
7. 请结合“碱”的有关知识,回答下列问题:
(1)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体
的干燥剂,如:干燥_________________________等气体,
氢氧化钙可由生石灰与水反应制得,化学方程式
为: 。
(2)氢氧化钙变质是由于与空气中的________________ 发生反应的缘故,反应的化学方程式是 ,因此氢氧化钙应
_______保存。
H2(符合要求即可)
Ca(OH)2+CO2=== CaCO3↓+H2O
二氧化碳
CaO+H2O=== Ca(OH)2
密封
1.常见的碱
2.碱的化学性质
(1)紫色石蕊试液遇碱溶液变蓝色;
无色酚酞试液遇碱溶液变红色。
(2)碱 + 非金属氧化物 → 盐 + 水
(3)碱 + 盐 → 新碱 + 新盐
由于碱溶液中都有OH-,因此它们具有相似的化学性质。
再 见
第二节 碱及其性质
1.认识碱的性质,理解碱的化学性质实质是OH-的性质。
2.认识几种重要的碱,掌握使用碱的方法。
3.通过对碱的性质的开放性探究活动,引领学生进一步提高科学探究能力。
一、常见的碱
1.氢氧化钠和氢氧化钙
(1)认识氢氧化钠和氢氧化钙
活动天地
颜色 状态 露置在空气中的变化 在水中的溶解情况 羊毛线在热的氢氧化钠溶液中的变化 其他
氢氧化钠
氢氧化钙
白色
固体
粉末状
固体
白
色
微溶于水
极易溶于水放出大量的热
易潮解
无变化
溶解,变黄
有滑腻感的物质则含有另一类特殊的化合物——碱。
(3)氢氧化钙[Ca(OH)2]
(2)氢氧化钠(NaOH)
a.俗名:熟石灰、消石灰
①暴露在空气中易吸收空气中的水蒸气而溶解,因此应密封保存。
②俗称苛性钠、火碱或烧碱,有强烈的腐蚀性。若不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上硼酸溶液。
CaO + H2O ==== Ca(OH)2
生石灰 熟石灰
反应的过程中放出大量的热。
b.氢氧化钙的制备
工业上通过高温煅烧石灰石生产生石灰:
CaCO3 ==== CaO+CO2↑
氧化钙俗称生石灰,具有吸水性,常用作干燥剂。
除氢氧化钠( NaOH ) 、氢氧化钙 [Ca(OH)2 ]外,常用
的碱还有氢氧化钾( KOH )、氢氧化钡[Ba(OH)2 ] 等。
ND型气烧石灰窑
高温
俗称 苛性钠、火碱、烧碱
(强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热,溶液有涩味和滑腻感 微溶于水
(溶液俗称石灰水)
其他 易潮解
(做干燥剂) 可由生石灰加水制得(放热)
CaO+H2O====Ca(OH)2
用途 化工原料:肥皂、石油、造纸、纺织、印染等工业 砌砖、抹墙;降低土壤酸性;制波尔多液、制石硫合剂农药
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
(1)氢氧化钠和氢氧化钙的化学性质的实验探究
①在3支试管中分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量氢氧化钠溶液。观察并记录实验现象。
②另取3支试管,再分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量澄清石灰水。观察并记录实验现象。完成下列表格。
2.碱的化学性质
生锈铁钉 氯化铜溶液 碳酸钠溶液
加入氢氧化钠溶液后的现象
加入氢氧化钙溶液后的现象
无变化
无变化
蓝色沉淀
蓝色沉淀
无变化
白色沉淀
②氢氧化钠和非金属氧化物反应
①氢氧化钠和酸碱指示剂反应
2NaOH+CO2====Na2CO3+H2O
必须密封保存
(隔绝水蒸气和二氧化碳)
(2)氢氧化钠(NaOH)的化学性质
③氢氧化钠和某些盐反应
2NaOH+CuSO4====Na2SO4+Cu(OH)2↓
3NaOH+FeCl3====3NaCl+Fe(OH)3↓
生成蓝色沉淀
生成红褐色沉淀
②氢氧化钙和非金属氧化物反应
③氢氧化钙和某些盐反应
①氢氧化钙和酸碱指示剂反应
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
Ca(OH)2+CO2====CaCO3↓+H2O
鉴别二氧化碳气体
用石灰砂浆砌砖
制造氢氧化钠
(3)氢氧化钙 Ca(OH)2 的化学性质
(4)碱的通性
由于碱溶液中都有OH-,因此它们具有相似的化学性质。
②与某些非金属氧化物反应
碱 + 非金属氧化物→盐 + 水
如:2NaOH + CO2 ==== Na2CO3 + H2O
Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
①与酸碱指示剂的作用
紫色石蕊试液遇到碱溶液变蓝色;
无色酚酞试液遇到碱溶液变红色。
③与某些盐反应
碱 + 盐 → 新碱 + 新盐
如: CuCl2 + 2NaOH ==== 2NaCl + Cu(OH)2↓
Ca(OH)2 + Na2CO3 ==== 2NaOH + CaCO3↓
3.碱的通性与酸的通性对比
b.碱+非金属氧化物→盐+水
c.碱+盐→新盐+新碱
a.碱溶液能和酸碱指示
剂反应
酸的通性
b.酸+金属→盐+氢气
c.酸+金属氧化物→盐+水
d.酸+盐→新盐+新酸
a.酸溶液能和酸碱指示
剂反应
碱的通性
知识点一:碱的化学性质
【典例1】航天员的生命活动和工作能力的必需装备——航天
服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不
可能具有的化学性质是( )
A.与酸碱指示剂反应
B.与二氧化碳反应
C.与氧化铁反应
D.与氯化铜溶液反应
C
知识点二:碱的使用、碱的用途等
【典例2】下列物质敞口放置在空气中一段时间后,发生
质变的是( )
A.浓硫酸 B.浓盐酸
C.氢氧化钠溶液 D.氯化钠溶液
C
1.碱溶液有相似的化学性质的原因是碱溶液中都含有( )
A.氢离子 B.氢氧根离子 C.金属离子 D.酸根离子
B
2.下列物质与盐酸反应后所得的溶液中,加入氢氧化
钠溶液,能产生红褐色沉淀的是( )
A.Fe B.Fe2O3 C.CuO D.FeO
B
3.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂
中的( )
A.水 B.CaCl2溶液
C.CO2气体 D.澄清石灰水
D
4.(双选)下列氧化物中,既不和酸反应,又不和碱反应的是
( )
A.CO2 B.CO
C.Fe2O3 D.H2O
BD
5. (双选)下列关于氢氧化钠的描述中错误的是( )
(提示:牵牛花的变色特点类似紫色石蕊试剂)
A.能去除油污,可做炉具的清洁剂
B.在空气中能与二氧化碳反应生成碳酸钙
C.易溶于水,溶解时放出大量的热
D.水溶液能使牵牛花汁液变红
BD
6.下图广口瓶分别装入下列各组中的气体,滴管分别滴入
各组中的液体
①氢气、浓硫酸 ②氮气、苛性钠溶液
③氯化氢、水 ④二氧化碳、烧碱溶液
(1)玻璃管下端所系气球能鼓起来的是 (填序号)
(2)若发生化学反应,请
写出有关的化学方程式:
_______________________________
a
X
Y
③④
2NaOH+CO2====Na2CO3+H2O
7. 请结合“碱”的有关知识,回答下列问题:
(1)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体
的干燥剂,如:干燥_________________________等气体,
氢氧化钙可由生石灰与水反应制得,化学方程式
为: 。
(2)氢氧化钙变质是由于与空气中的________________ 发生反应的缘故,反应的化学方程式是 ,因此氢氧化钙应
_______保存。
H2(符合要求即可)
Ca(OH)2+CO2=== CaCO3↓+H2O
二氧化碳
CaO+H2O=== Ca(OH)2
密封
1.常见的碱
2.碱的化学性质
(1)紫色石蕊试液遇碱溶液变蓝色;
无色酚酞试液遇碱溶液变红色。
(2)碱 + 非金属氧化物 → 盐 + 水
(3)碱 + 盐 → 新碱 + 新盐
由于碱溶液中都有OH-,因此它们具有相似的化学性质。
再 见
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
