第二节 海水“晒盐” 课件(40张PPT)
文档属性
| 名称 | 第二节 海水“晒盐” 课件(40张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-06 15:21:56 | ||
图片预览










文档简介
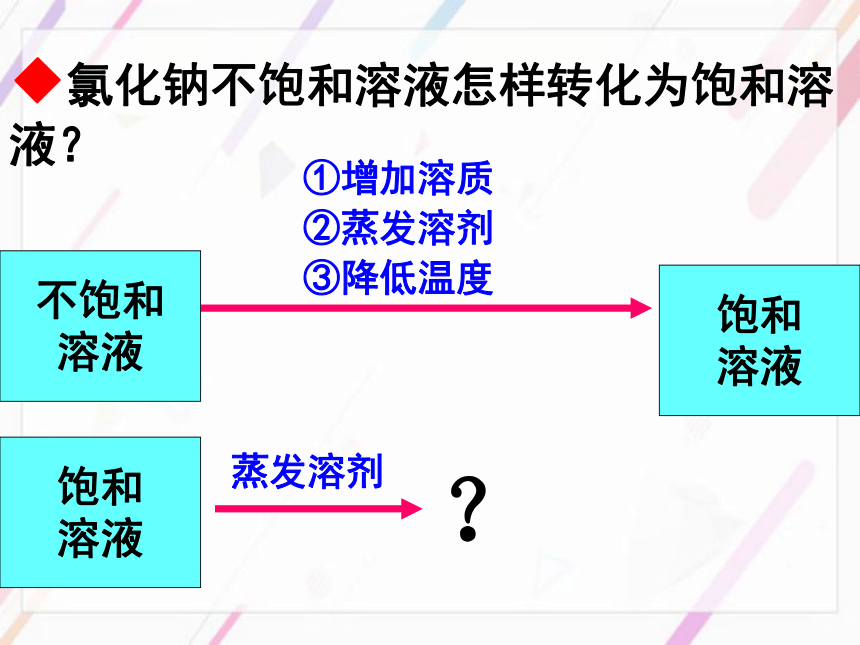
课件40张PPT。第二节 海水“晒盐”◆氯化钠不饱和溶液怎样转化为饱和溶液?饱和
溶液①增加溶质③降低温度②蒸发溶剂不饱和
溶液饱和
溶液蒸发溶剂?☆晶体:具有规则几何外形的固体。结晶 固体物质从它的饱和溶液中以晶
体的形式析出的过程叫做结晶。盐田法
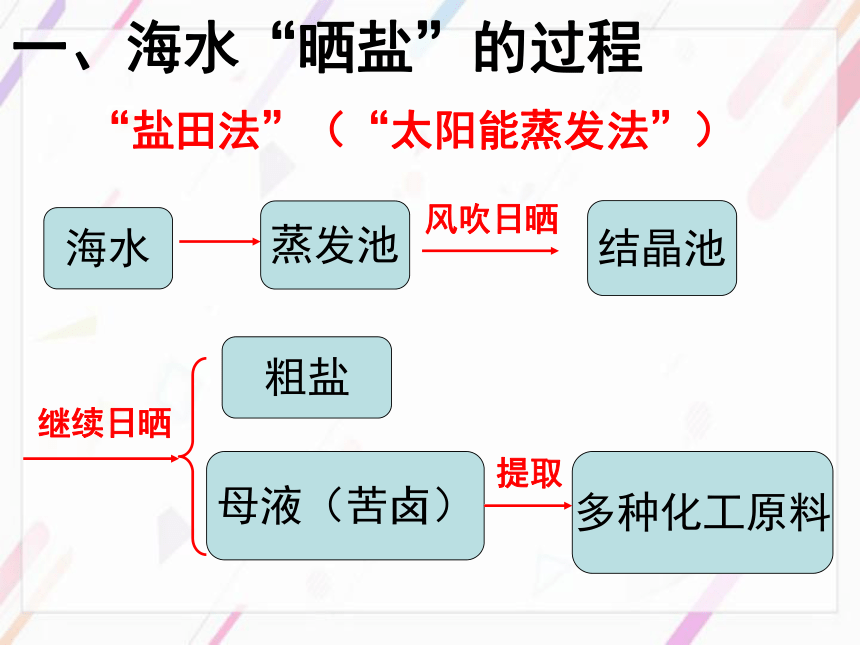
(太阳能蒸发法)盐场:一、海水“晒盐”的过程海水蒸发池结晶池粗盐母液(苦卤)多种化工原料“盐田法”(“太阳能蒸发法”)风吹日晒继续日晒提取议一议1、海水和蒸发池的溶液是氯化钠的饱和溶液吗?结晶池呢?
2、结晶池在蒸发结晶时,水能全部蒸发完吗?为什么?
3、粗盐是纯净的氯化钠晶体吗?为什么?
4、母液是不是氯化钠的饱和溶液?还有哪些物质? 哪些自然条件有利于海水中的食盐蒸发结晶?阳光充足
风力大
雨量少
湿度低等交流共享轻松过关 下列关于海水晒盐原理的分析 ,你认为正确的是 ( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用阳光分解海水得到食盐C轻松过关 关于饱和溶液的说法中不正确的是( )
A.饱和溶液就是不再溶解任何溶质的溶液
B.饱和溶液是有条件的,即一定温度,一定量溶剂
C.饱和溶液和不饱和溶液可以相互转化
D.固体物质从它的饱和溶液中以晶体的形式析出的过程叫做结晶。
A 使一杯接近饱和的硝酸钾溶液变饱和,下列措施中错误的是( )
A.加入适量的硝酸钾固体
B.蒸发掉一部分水
C.降温至有固体析出
D.升高温度D轻松过关实验探究:影响物质溶解性的因素溶解不溶解不溶解溶解1、溶质的种类 2、溶剂的种类 (及物质的性质) 1、不同的溶质在同一种溶剂中溶解性不同。
2、同一种溶质在不同溶剂里溶解性不同。影响物质溶解性的因素3、温度
一般说来,温度越高,物质的溶解性越强。归纳实验结论探究温度对物质溶解性的影响实验步骤:
在一定量的水中加入硝酸钾固体,直至有固体剩余,然后加热,观察现象。
实验现象:
加热后,硝酸钾固体逐渐溶解。溶解度(表示物质的溶解性)(1)定义: 一定温度下,某固体在100g溶剂(通常为水)里达到饱和状态时所溶解的质量。(3)单位是克,符号S。(2)四要素: 一定温度、100g溶剂、饱和状态、单位请你来找茬,看看缺什么
1.20℃时,10g食盐溶解在100g水中,所以20 ℃时,食盐的溶解度是10g。2.100g水中溶解了36g食盐刚好达到饱和,所以食盐的溶解度是36g。3.在20 ℃时,100g水里最多溶解了33.3g氯化铵,所以20℃时氯化铵的溶解度是33.3。
4.在20 ℃时,100g硝酸钾的饱和溶液里含硝酸钾24g,则20 ℃时硝酸钾的溶解度是24g。溶解度定义的应用1、理解溶解度的含义
2、判断物质的溶解性强弱
3、进行有关计算1、20℃时,蔗糖的溶解度为204g的含义是什么?2、20℃时,蔗糖的溶解度为204g。
20℃时,氯化钠的溶解度为36g。
问: 20℃时,哪种物质的溶解性更强?
3、已知:20℃时,氯化钠的溶解度为36g。
问: 20℃时,氯化钠的饱和溶液中溶质质量分数是多少?
4、已知:20℃时,氯化钠的溶解度为36g。
20℃时,把15克氯化钠放入50克水中,溶液饱和吗?溶液质量是多少?溶质质量分数呢?
5、 20℃时,把25克氯化钠放入50克水中,溶液饱和吗?溶液质量是多少?溶质质量分数呢?
硝酸钾在不同温度时的溶解度固体物质的溶解度与温度有关气体物质的溶解度与温度和压强有关。硝酸钾在不同温度时的溶解度:13.331.620.945.863.985.5138168202246硝酸钾的溶解度曲线110.....硝酸钾....0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃熟石灰的溶解度曲线:碳酸氢钠几种物质的溶解度曲线溶解度曲线的意义(2)固体溶解度受温度变化的情况。(1)物质在某一温度时的溶解度数值。(3)交点含义(4)溶液所处的状态。(5)结晶方法。固体物质溶解度受温度变化影响情况:
1、大多数固体物质溶解度随温度升高而增大, 例如 硝酸钾。 2、少数固体物质溶解度受温度影响不大, 例如氯化钠。 3、极少数固体物质溶解度随温度升高反而减小,例如熟石灰。2、曲线上方的点对应溶液为_________溶液,且有_________;
3.曲线下方的点对应溶液为_______溶液。1.曲线上的点对应溶液为_________;
饱和溶液固体剩余 不饱和请你总结饱和溶液溶解度(克)温度(t)1601501401301201101009080706050403020102001901801701010090807060504030200硝酸钾氯化钠固体溶解度曲线从溶解度曲线分析结晶情况1、降温结晶
(又叫冷却热饱和溶液法)2、蒸发结晶适用于溶解度随温度变化较小的物质如:NaCl适用于溶解度随温度变化较大的物质如:KNO3哪种物质适合用降温的方法结晶,为什么?0.100.200 20 40 60 80 100温度/℃熟石灰的溶解度曲线:(1)给熟石灰的饱和溶液升高温度会有什么现象?
为什么?变浑浊,因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出3、升温结晶溶解度溶解度与溶解性之间的关系溶解性溶解度20℃大于10g1-10g0.01-1g小于0.01g易溶可溶微溶难(不)溶三、粗盐的提纯1、除去不溶性杂质(泥沙)
2、除去可溶性杂质(氯化镁等)(1)流程:溶解 →过滤 →蒸发思考:怎样除去粗盐中的泥沙,最后得到氯化钠晶体?需要经过哪些步骤?溶解时水加入多少?
玻璃棒的作用?过滤
1、所需仪器
2、过滤器的制作
3、一贴二低三靠
4、玻璃棒的作用
5、操作方法蒸发
1、所需仪器
2、玻璃棒搅拌的目的
3、加热时是否把水蒸
干?
使受热均匀,防止液滴飞溅。待蒸发皿中出现大量晶体时,停止加热,用余热烘干。(2)流程中的每一步玻璃棒作用①溶解②过滤③蒸发加速氯化钠溶解引流均匀受热,防止液体飞溅请你归纳:本实验中涉及的分离混合物的方法有哪些?你还知道哪些?过滤、蒸发结晶蒸馏、吸附、降温结晶等
溶液①增加溶质③降低温度②蒸发溶剂不饱和
溶液饱和
溶液蒸发溶剂?☆晶体:具有规则几何外形的固体。结晶 固体物质从它的饱和溶液中以晶
体的形式析出的过程叫做结晶。盐田法
(太阳能蒸发法)盐场:一、海水“晒盐”的过程海水蒸发池结晶池粗盐母液(苦卤)多种化工原料“盐田法”(“太阳能蒸发法”)风吹日晒继续日晒提取议一议1、海水和蒸发池的溶液是氯化钠的饱和溶液吗?结晶池呢?
2、结晶池在蒸发结晶时,水能全部蒸发完吗?为什么?
3、粗盐是纯净的氯化钠晶体吗?为什么?
4、母液是不是氯化钠的饱和溶液?还有哪些物质? 哪些自然条件有利于海水中的食盐蒸发结晶?阳光充足
风力大
雨量少
湿度低等交流共享轻松过关 下列关于海水晒盐原理的分析 ,你认为正确的是 ( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用阳光分解海水得到食盐C轻松过关 关于饱和溶液的说法中不正确的是( )
A.饱和溶液就是不再溶解任何溶质的溶液
B.饱和溶液是有条件的,即一定温度,一定量溶剂
C.饱和溶液和不饱和溶液可以相互转化
D.固体物质从它的饱和溶液中以晶体的形式析出的过程叫做结晶。
A 使一杯接近饱和的硝酸钾溶液变饱和,下列措施中错误的是( )
A.加入适量的硝酸钾固体
B.蒸发掉一部分水
C.降温至有固体析出
D.升高温度D轻松过关实验探究:影响物质溶解性的因素溶解不溶解不溶解溶解1、溶质的种类 2、溶剂的种类 (及物质的性质) 1、不同的溶质在同一种溶剂中溶解性不同。
2、同一种溶质在不同溶剂里溶解性不同。影响物质溶解性的因素3、温度
一般说来,温度越高,物质的溶解性越强。归纳实验结论探究温度对物质溶解性的影响实验步骤:
在一定量的水中加入硝酸钾固体,直至有固体剩余,然后加热,观察现象。
实验现象:
加热后,硝酸钾固体逐渐溶解。溶解度(表示物质的溶解性)(1)定义: 一定温度下,某固体在100g溶剂(通常为水)里达到饱和状态时所溶解的质量。(3)单位是克,符号S。(2)四要素: 一定温度、100g溶剂、饱和状态、单位请你来找茬,看看缺什么
1.20℃时,10g食盐溶解在100g水中,所以20 ℃时,食盐的溶解度是10g。2.100g水中溶解了36g食盐刚好达到饱和,所以食盐的溶解度是36g。3.在20 ℃时,100g水里最多溶解了33.3g氯化铵,所以20℃时氯化铵的溶解度是33.3。
4.在20 ℃时,100g硝酸钾的饱和溶液里含硝酸钾24g,则20 ℃时硝酸钾的溶解度是24g。溶解度定义的应用1、理解溶解度的含义
2、判断物质的溶解性强弱
3、进行有关计算1、20℃时,蔗糖的溶解度为204g的含义是什么?2、20℃时,蔗糖的溶解度为204g。
20℃时,氯化钠的溶解度为36g。
问: 20℃时,哪种物质的溶解性更强?
3、已知:20℃时,氯化钠的溶解度为36g。
问: 20℃时,氯化钠的饱和溶液中溶质质量分数是多少?
4、已知:20℃时,氯化钠的溶解度为36g。
20℃时,把15克氯化钠放入50克水中,溶液饱和吗?溶液质量是多少?溶质质量分数呢?
5、 20℃时,把25克氯化钠放入50克水中,溶液饱和吗?溶液质量是多少?溶质质量分数呢?
硝酸钾在不同温度时的溶解度固体物质的溶解度与温度有关气体物质的溶解度与温度和压强有关。硝酸钾在不同温度时的溶解度:13.331.620.945.863.985.5138168202246硝酸钾的溶解度曲线110.....硝酸钾....0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃熟石灰的溶解度曲线:碳酸氢钠几种物质的溶解度曲线溶解度曲线的意义(2)固体溶解度受温度变化的情况。(1)物质在某一温度时的溶解度数值。(3)交点含义(4)溶液所处的状态。(5)结晶方法。固体物质溶解度受温度变化影响情况:
1、大多数固体物质溶解度随温度升高而增大, 例如 硝酸钾。 2、少数固体物质溶解度受温度影响不大, 例如氯化钠。 3、极少数固体物质溶解度随温度升高反而减小,例如熟石灰。2、曲线上方的点对应溶液为_________溶液,且有_________;
3.曲线下方的点对应溶液为_______溶液。1.曲线上的点对应溶液为_________;
饱和溶液固体剩余 不饱和请你总结饱和溶液溶解度(克)温度(t)1601501401301201101009080706050403020102001901801701010090807060504030200硝酸钾氯化钠固体溶解度曲线从溶解度曲线分析结晶情况1、降温结晶
(又叫冷却热饱和溶液法)2、蒸发结晶适用于溶解度随温度变化较小的物质如:NaCl适用于溶解度随温度变化较大的物质如:KNO3哪种物质适合用降温的方法结晶,为什么?0.100.200 20 40 60 80 100温度/℃熟石灰的溶解度曲线:(1)给熟石灰的饱和溶液升高温度会有什么现象?
为什么?变浑浊,因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出3、升温结晶溶解度溶解度与溶解性之间的关系溶解性溶解度20℃大于10g1-10g0.01-1g小于0.01g易溶可溶微溶难(不)溶三、粗盐的提纯1、除去不溶性杂质(泥沙)
2、除去可溶性杂质(氯化镁等)(1)流程:溶解 →过滤 →蒸发思考:怎样除去粗盐中的泥沙,最后得到氯化钠晶体?需要经过哪些步骤?溶解时水加入多少?
玻璃棒的作用?过滤
1、所需仪器
2、过滤器的制作
3、一贴二低三靠
4、玻璃棒的作用
5、操作方法蒸发
1、所需仪器
2、玻璃棒搅拌的目的
3、加热时是否把水蒸
干?
使受热均匀,防止液滴飞溅。待蒸发皿中出现大量晶体时,停止加热,用余热烘干。(2)流程中的每一步玻璃棒作用①溶解②过滤③蒸发加速氯化钠溶解引流均匀受热,防止液体飞溅请你归纳:本实验中涉及的分离混合物的方法有哪些?你还知道哪些?过滤、蒸发结晶蒸馏、吸附、降温结晶等
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
