第四节 酸碱中和反应 课件(20张PPT)
文档属性
| 名称 | 第四节 酸碱中和反应 课件(20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 858.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-06 15:45:02 | ||
图片预览






文档简介
课件20张PPT。第四节 酸和碱的中和反应第七单元 常见的酸和碱一、温过而知新我们学过的常见酸和碱有哪些?常见的酸:盐酸(HCl)、硫酸(H2SO4)、碳酸(H2CO3)、硝酸(HNO3 )等。常见的碱:想一想:酸和碱是否会发生化学反应?酸的构成= H+ + 酸根离子碱的构成=OH- + 金属离子 氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钾KOH、氨水NH3.H2O等。二、讨论并设计实验 现有药品:酚酞溶液、氢氧化钠、盐酸、氯化钠、氢氧化钙、稀硫酸、紫色石蕊溶液。请同学们选取以上三种实验药品验证酸和碱能否发生化学反应。
方案一:选取氢氧化钠,往其中加入酚酞,酚酞遇碱变红,接着滴入稀盐酸,观察现象,若酚酞由红色变成无色,则说明酸和碱能够发生反应。方案二:选取氢氧化钙,往其中加入紫色石蕊溶液,紫色石蕊遇碱变蓝,接着滴入稀硫酸,观察现象。若石蕊溶液由蓝色变成紫色,则说明酸和碱能够发生反应。
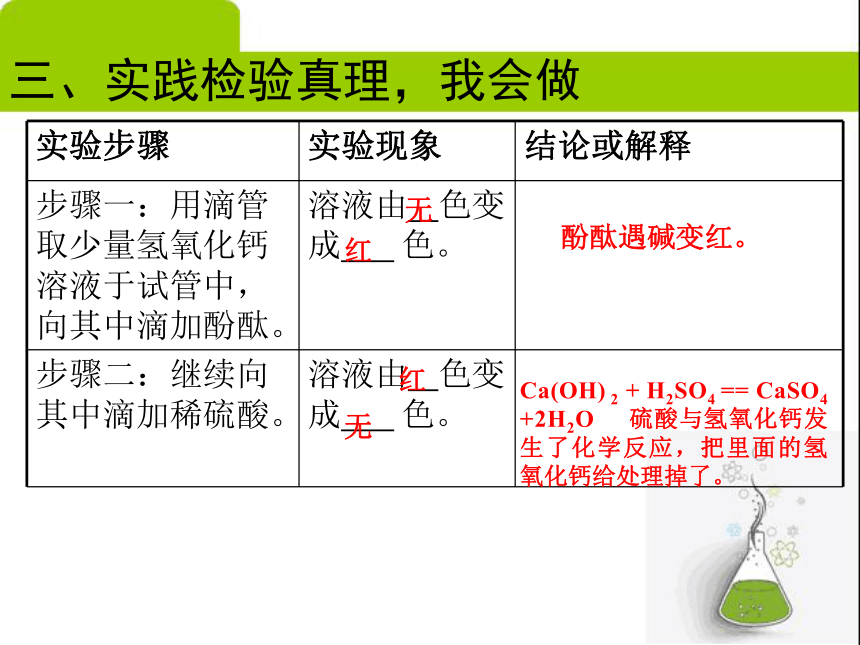
三、实践检验真理,我会做无红酚酞遇碱变红。NaOH + HCl == NaCl +H2O 盐酸与氢氧化钠发生了化学反应,把里面的氢氧化钠给处理掉了。红无无红红无Ca(OH) 2 + H2SO4 == CaSO4 +2H2O 硫酸与氢氧化钙发生了化学反应,把里面的氢氧化钙给处理掉了。酚酞遇碱变红。三、实践检验真理,我会做HCl→H+ + Cl—
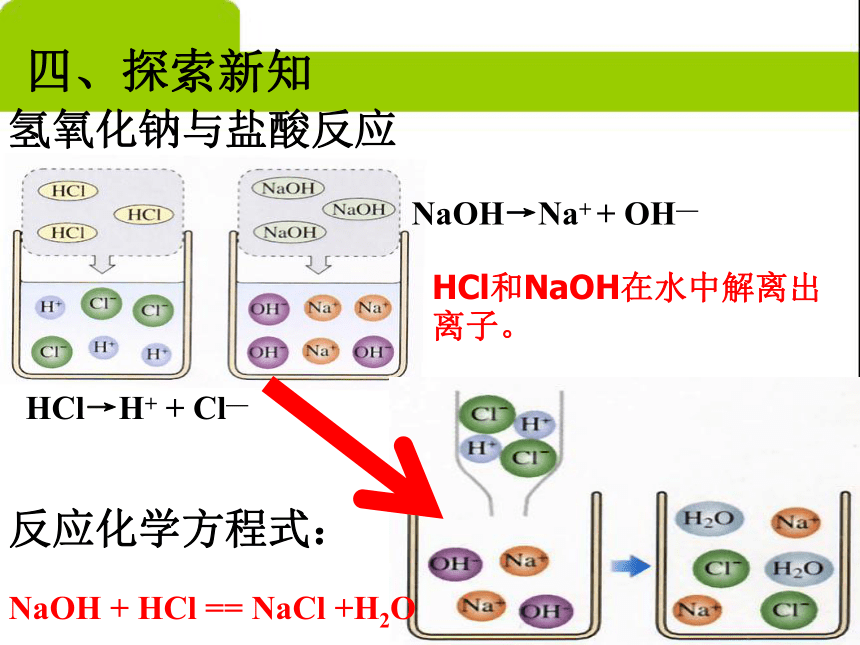
NaOH→Na+ + OH— HCl和NaOH在水中解离出离子。氢氧化钠与盐酸反应四、探索新知反应化学方程式:NaOH + HCl == NaCl +H2O
观察方程式,找规律。NaOH + HCl == NaCl + H2O
Ca(OH)2 +H2SO4 == CaSO4 +2H2O
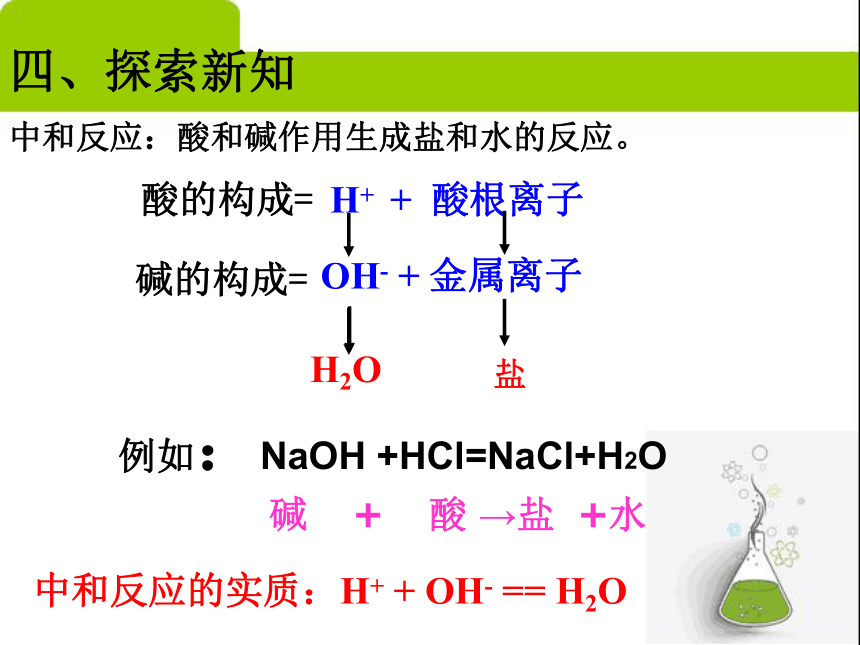
1.思考与观察: NaCl、 CaSO4这两种物质在组成上有什么共同点?2.反应物和生成物有什么共同点?答:都是由金属离子和酸根离子构成的化合物。答:反应物中都有酸和碱参与,生成物中都有盐和水。定义一:我们把由金属离子和酸根离子构成的化合物称之为盐。定义二:我们把酸和碱反应生成盐和水的反应叫作中和反应。酸的构成= H+ + 酸根离子碱的构成= OH- + 金属离子 H2O盐 碱 + 酸 →盐 +水例如:NaOH +HCl=NaCl+H2O四、探索新知 中和反应的实质:H+ + OH- == H2O中和反应:酸和碱作用生成盐和水的反应。五、中和反应的注意事项任意酸与碱都能发生中和反应,都生成盐和水。
中和反应是放热反应。
中和反应生成盐和水,但生成盐和水的反应不一定是中和反应。
例如: 2NaOH + CO2 = Na2CO3 + H2O
六、中和反应在实际中的应用 中和反应与我们的关系非常密切,生产生活中,中和反应的例子比比皆是,请同学们开脑筋想一想有哪些例子?制成含碱性物质的药水,防蚊虫叮咬中和胃酸。。。。处理工业废水改变土壤的酸碱性六、中和反应在实际中的应用 在农业生产中,农作物生长对土壤的酸碱性有一定的要求。根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。(一)改变土壤的酸碱性六、中和反应在实际中的应用 工厂生产过程中的污水,需进行一系列的处理。例如,硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理。(二)处理工业废水六、中和反应在实际中的应用 人的胃液里含有适量盐酸(HCl),可以帮助消化。但是如果饮食过量时,胃会分泌大量胃酸,造成胃部不适以致消化不良。在这种情况下,可以服用某些含有碱性物质的药物(如氢氧化铝),以中和过多的胃酸。
(三)用于医药
◆中和胃酸 人被有些蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处很快肿成大包而痛痒。如果涂一些含有碱性物质的溶液,就可减轻痛痒。 ◆制成含碱性物质的药水,防蚊虫叮咬。(三)用于医药
六、中和反应在实际中的应用1.盐:由金属离子和酸根离子组成的化合物。
2.中和反应:酸和碱作用生成盐和水的反应。
3.中和反应的实质:H+ + OH- == H2O
4.中和反应的应用●改变土壤的酸碱性●处理工厂的废水●用于医药 七、我会做小结八、连线中考NaNaOHHclKOHH2SO42、A3 C1.下列没有运用中和反应原理的是( )
A.服用含氢氧化镁的药物,可以治疗胃酸过多症 B.用熟石灰改良酸性土壤
C.蚊虫叮咬处涂上肥皂水,可减轻痛痒 D.用生石灰作干燥剂2. CaCl2 溶液中含少量的HCl,若不用指示剂,要除去HCl且使溶液的pH=7,选用的试剂 ( )
A.Ca(OH)2 B.CaO C .KCO3 D.CaCO3 3下列反应属于中和反应的是( )
A.CO2 +2NaOH===Na2CO3 +H2O B.CuO+ H2SO4 === CuSO4 十H2O
C.KOH+ HNO3 === KNO3 + H2O D.Fe+2HCl-=== FeCl2 + H2 ↑1、D八、连线中考八、连线中考4.某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验:
(1)甲同学实验操作如右图:
在烧杯中加入约5mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈 色接着用滴管滴入一定量的稀盐酸,再用玻璃棒 ,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为 .
(2)乙同学对甲同学的结论提出了质凝,并对反应后溶液中的溶质成分进行探究.
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl 猜想二:NaCl和HCl 猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是 .
为了验证另外两种猜想,乙同学设计如下实验方案:
【反思交流】
实验结束后,废液处理方法正确的是 (填序号).
A.倒入下水道 B.倒入废液回收处 C.带出实验室.红搅拌NaOH + HCl == NaCl +H2O猜想三有气泡产生BThank you!
方案一:选取氢氧化钠,往其中加入酚酞,酚酞遇碱变红,接着滴入稀盐酸,观察现象,若酚酞由红色变成无色,则说明酸和碱能够发生反应。方案二:选取氢氧化钙,往其中加入紫色石蕊溶液,紫色石蕊遇碱变蓝,接着滴入稀硫酸,观察现象。若石蕊溶液由蓝色变成紫色,则说明酸和碱能够发生反应。
三、实践检验真理,我会做无红酚酞遇碱变红。NaOH + HCl == NaCl +H2O 盐酸与氢氧化钠发生了化学反应,把里面的氢氧化钠给处理掉了。红无无红红无Ca(OH) 2 + H2SO4 == CaSO4 +2H2O 硫酸与氢氧化钙发生了化学反应,把里面的氢氧化钙给处理掉了。酚酞遇碱变红。三、实践检验真理,我会做HCl→H+ + Cl—
NaOH→Na+ + OH— HCl和NaOH在水中解离出离子。氢氧化钠与盐酸反应四、探索新知反应化学方程式:NaOH + HCl == NaCl +H2O
观察方程式,找规律。NaOH + HCl == NaCl + H2O
Ca(OH)2 +H2SO4 == CaSO4 +2H2O
1.思考与观察: NaCl、 CaSO4这两种物质在组成上有什么共同点?2.反应物和生成物有什么共同点?答:都是由金属离子和酸根离子构成的化合物。答:反应物中都有酸和碱参与,生成物中都有盐和水。定义一:我们把由金属离子和酸根离子构成的化合物称之为盐。定义二:我们把酸和碱反应生成盐和水的反应叫作中和反应。酸的构成= H+ + 酸根离子碱的构成= OH- + 金属离子 H2O盐 碱 + 酸 →盐 +水例如:NaOH +HCl=NaCl+H2O四、探索新知 中和反应的实质:H+ + OH- == H2O中和反应:酸和碱作用生成盐和水的反应。五、中和反应的注意事项任意酸与碱都能发生中和反应,都生成盐和水。
中和反应是放热反应。
中和反应生成盐和水,但生成盐和水的反应不一定是中和反应。
例如: 2NaOH + CO2 = Na2CO3 + H2O
六、中和反应在实际中的应用 中和反应与我们的关系非常密切,生产生活中,中和反应的例子比比皆是,请同学们开脑筋想一想有哪些例子?制成含碱性物质的药水,防蚊虫叮咬中和胃酸。。。。处理工业废水改变土壤的酸碱性六、中和反应在实际中的应用 在农业生产中,农作物生长对土壤的酸碱性有一定的要求。根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。(一)改变土壤的酸碱性六、中和反应在实际中的应用 工厂生产过程中的污水,需进行一系列的处理。例如,硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理。(二)处理工业废水六、中和反应在实际中的应用 人的胃液里含有适量盐酸(HCl),可以帮助消化。但是如果饮食过量时,胃会分泌大量胃酸,造成胃部不适以致消化不良。在这种情况下,可以服用某些含有碱性物质的药物(如氢氧化铝),以中和过多的胃酸。
(三)用于医药
◆中和胃酸 人被有些蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处很快肿成大包而痛痒。如果涂一些含有碱性物质的溶液,就可减轻痛痒。 ◆制成含碱性物质的药水,防蚊虫叮咬。(三)用于医药
六、中和反应在实际中的应用1.盐:由金属离子和酸根离子组成的化合物。
2.中和反应:酸和碱作用生成盐和水的反应。
3.中和反应的实质:H+ + OH- == H2O
4.中和反应的应用●改变土壤的酸碱性●处理工厂的废水●用于医药 七、我会做小结八、连线中考NaNaOHHclKOHH2SO42、A3 C1.下列没有运用中和反应原理的是( )
A.服用含氢氧化镁的药物,可以治疗胃酸过多症 B.用熟石灰改良酸性土壤
C.蚊虫叮咬处涂上肥皂水,可减轻痛痒 D.用生石灰作干燥剂2. CaCl2 溶液中含少量的HCl,若不用指示剂,要除去HCl且使溶液的pH=7,选用的试剂 ( )
A.Ca(OH)2 B.CaO C .KCO3 D.CaCO3 3下列反应属于中和反应的是( )
A.CO2 +2NaOH===Na2CO3 +H2O B.CuO+ H2SO4 === CuSO4 十H2O
C.KOH+ HNO3 === KNO3 + H2O D.Fe+2HCl-=== FeCl2 + H2 ↑1、D八、连线中考八、连线中考4.某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验:
(1)甲同学实验操作如右图:
在烧杯中加入约5mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈 色接着用滴管滴入一定量的稀盐酸,再用玻璃棒 ,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为 .
(2)乙同学对甲同学的结论提出了质凝,并对反应后溶液中的溶质成分进行探究.
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl 猜想二:NaCl和HCl 猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是 .
为了验证另外两种猜想,乙同学设计如下实验方案:
【反思交流】
实验结束后,废液处理方法正确的是 (填序号).
A.倒入下水道 B.倒入废液回收处 C.带出实验室.红搅拌NaOH + HCl == NaCl +H2O猜想三有气泡产生BThank you!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
