第一节 常见的金属材料 课件(21张PPT)
文档属性
| 名称 | 第一节 常见的金属材料 课件(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-06 17:13:43 | ||
图片预览





文档简介
课件21张PPT。第1课时 鲁教版 九年级下册第九单元 金属第二节 金属的化学性质 1.认识镁、铝、铁、铜等常见金属与氧气的反应。
2.认识常见金属与盐酸、硫酸的置换反应。
3.能说出常见金属的活动性顺序,并能利用该规律判断置换反应。 1.通过常见金属与氧气、与酸的反应判断金属的活动性
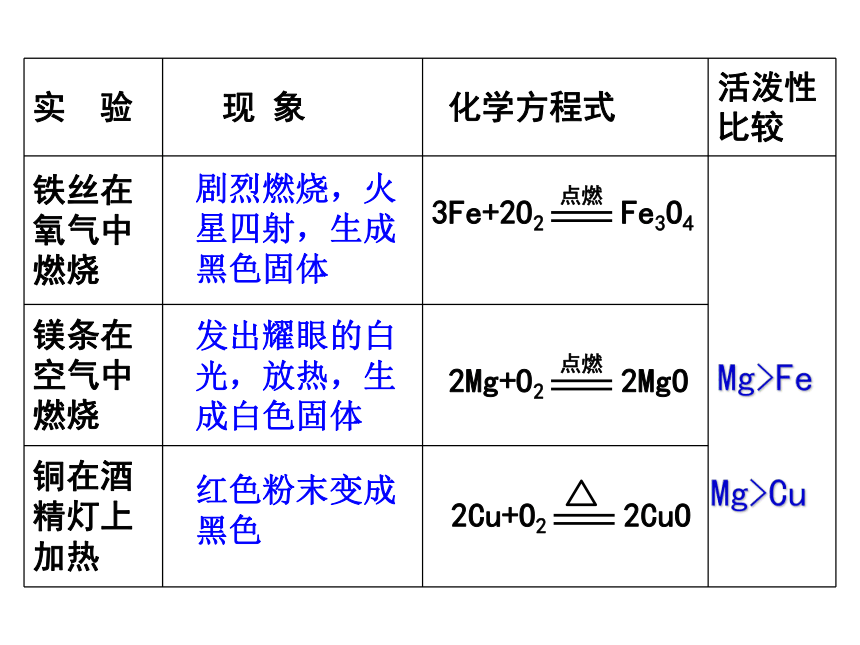
2.利用金属的活动性顺序判断置换反应 你学过哪些金属与氧气的反应?能否说出这些反应的现象并写出反应的方程式?Mg>Fe
Mg>Cu
剧烈燃烧,火星四射,生成黑色固体发出耀眼的白光,放热,生成白色固体红色粉末变成黑色 铝粉在氧气中剧烈燃烧,生成氧化铝4Al+3O2==2Al2O3实验探究9-2思考:1.为什么铝具有优良的抗腐蚀性能?2.分析“真金不怕火炼”蕴含的化学原理。实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应, 但在高温时能与氧气反应。
金即使在高温时不能与氧气反应。
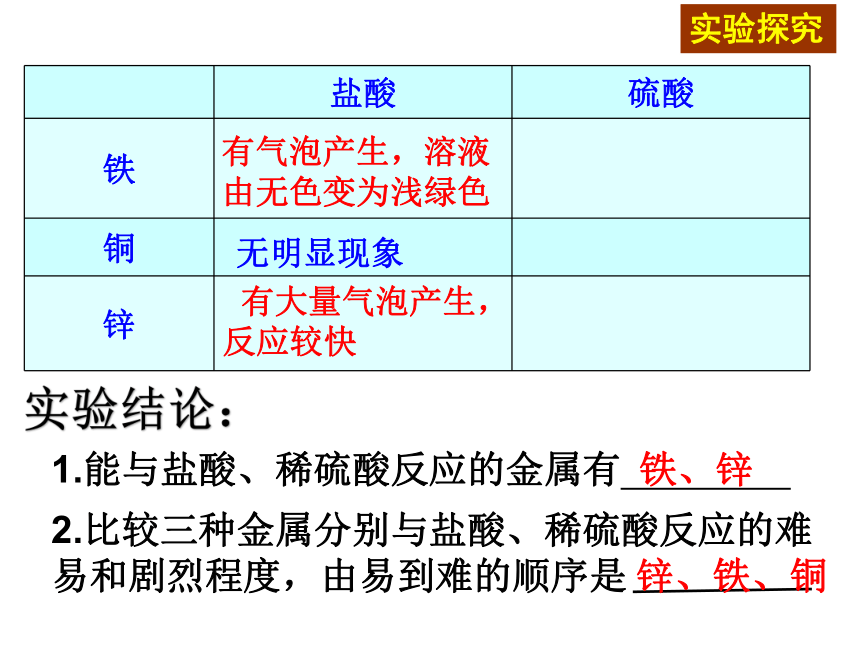
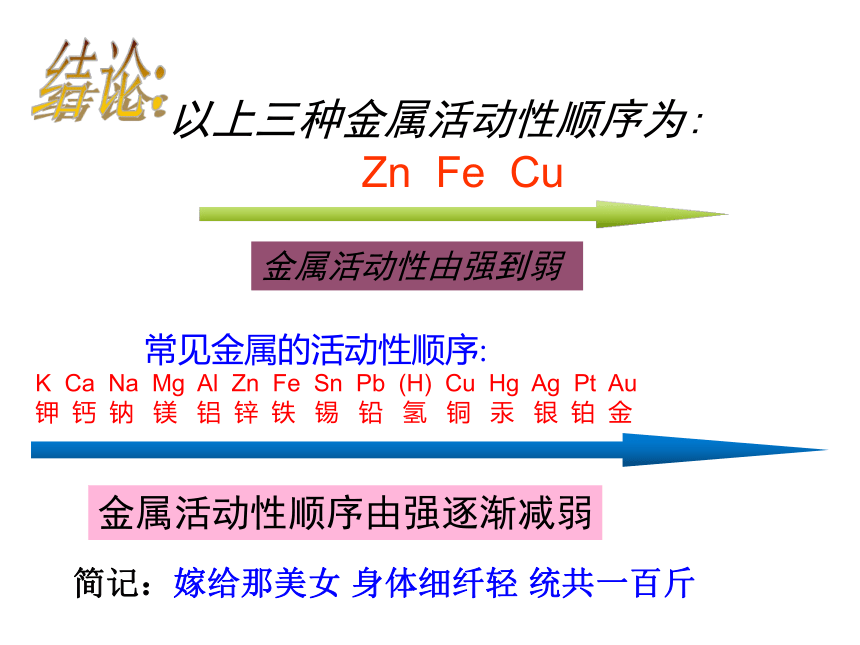
活动性:镁、铝 > 铁、铜 > 金动手实验 二.金属与酸的反应金属与盐酸、稀硫酸的反应实验探究9-3 有大量气泡产生,反应较快无明显现象有气泡产生,溶液由无色变为浅绿色实验探究实验结论:1.能与盐酸、稀硫酸反应的金属有 铁、锌锌、铁、铜以上三种金属活动性顺序为:
Zn Fe Cu 金属活动性由强到弱 常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金金属活动性顺序由强逐渐减弱结论:简记:嫁给那美女 身体细纤轻 统共一百斤 常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序由强逐渐减弱稀盐酸的化学性质(1)稀盐酸和镁条(Mg)反应 Na2CO3 + 2 HCl =2NaCl + H2O + CO2↑Mg + 2HCl = MgCl2 + H2↑Fe+ 2HCl = FeCl2 + H2↑ Fe2O3+ 6HCl = 2FeCl3 +3H2O 稀盐酸和铁(Fe)反应(2)稀盐酸和铁锈(主要成分Fe2O3)反应(3)稀盐酸和碳酸钠(Na2CO3)反应注意:单质的铁和酸反应只能生成+2价的亚铁
化合物的铁和酸反应,反应前后铁元素的化合价不变复分解反应如果把上述实验中的稀盐酸换成稀硫酸,
你认为是否会产生类似的实验现象? 请试着写出这些反应的化学方程式。
Mg + H2SO4 =
Fe + H2SO4 =
Fe2O3 + H2SO4 =
Na2CO3 + H2SO4= MgSO4 + H2↑
FeSO4 + H2↑
3 Fe2(SO4)3 + 3H2O
Na2SO4 + H2O + CO2↑盐Mg + 2HCl = MgCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3+ 3H2O
Na2CO3 + 2HCl =2NaCl + H2O + CO2↑
Na2CO3 + H2SO4 =Na2SO4+ H2O + CO2↑
AgNO3 + HCl = AgCl ↓ +HNO3
BaCl2 + H2SO4 = BaSO4↓+ 2HCl2、酸+金属 →盐 + 氢气3、酸+金属氧化物→ 盐 + 水 4、酸+某些盐 →新酸 + 新盐分析上述有关酸的反应的化学方程式,从组成上看,酸可以与哪些类别的物质反应?1、与酸碱指示剂反应酸的化学性质
① 与酸碱指示剂所用
② 酸与金属单质反应生成盐和H2
③ 酸与金属氧化物反应生成盐和H2O
④ 酸与某些盐反应生成新盐和新酸 因为稀盐酸和稀硫酸中都含有H+
由于不同酸的酸根不同所以其性质也存在差异稀盐酸和稀硫酸具有相似的化学性质的原因1、铁制品电镀前放在盐酸池中
2、向酸性土壤中撒熟石灰3、实验室制取氢气4、用醋酸浸泡除去水壶中的水垢稀硫酸锌粒 水垢的主要成分:CaCO3除去铁锈 (主要成分Fe2O3)1、稀释浓硫酸时,一定要把 沿器壁
慢慢注入 里,并不断搅拌。
2、下列物质暴露在空气中,质量会增加的
是
A. 浓硫酸 B. 酒精 C. 浓盐酸 浓硫酸水A3、下列物质能和盐酸反应生成黄色溶液的是
A. Fe B. Fe2O3 C. Mg D.CaCO3B4、酸的溶液具有相似的化学性质,是因为酸溶液
里都含有
A.氢原子 B.氢离子 C. 氢分子 D.酸根离子 B1、下列说法不正确的是
A.不能用铁制容器盛放稀盐酸和稀硫酸
B.用稀盐酸可以除去热水瓶中的水垢主要成分
CaCO3和 Mg(OH)2
C.用含Al(OH)3的药物胃舒平可治疗胃酸过多
D.铁制零件在电镀前,放在盐酸池中浸泡时间越长
越好
D2、用化学方程式解释:
① 铁制零件在电镀前,要放在盐酸池中浸泡。
② 用铁锅炒菜可补铁。
③ 用适量的稀盐酸可除出热水瓶胆壁上的水垢。
水垢的主要成分是CaCO3和Mg(OH)2Fe2O3 + 6HCl = 2FeCl3 + 3H2OFe + 2CH3COOH = Fe(CH3COO)2 + H2↑CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O实验室里的一瓶蒸馏水和一瓶稀盐酸丢失了标签,你能帮老师把它们鉴别出来吗?你有哪些好方法?1.用镁条(或其它活泼金属)2.用生锈铁钉3.用碳酸钙思考
2.认识常见金属与盐酸、硫酸的置换反应。
3.能说出常见金属的活动性顺序,并能利用该规律判断置换反应。 1.通过常见金属与氧气、与酸的反应判断金属的活动性
2.利用金属的活动性顺序判断置换反应 你学过哪些金属与氧气的反应?能否说出这些反应的现象并写出反应的方程式?Mg>Fe
Mg>Cu
剧烈燃烧,火星四射,生成黑色固体发出耀眼的白光,放热,生成白色固体红色粉末变成黑色 铝粉在氧气中剧烈燃烧,生成氧化铝4Al+3O2==2Al2O3实验探究9-2思考:1.为什么铝具有优良的抗腐蚀性能?2.分析“真金不怕火炼”蕴含的化学原理。实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应, 但在高温时能与氧气反应。
金即使在高温时不能与氧气反应。
活动性:镁、铝 > 铁、铜 > 金动手实验 二.金属与酸的反应金属与盐酸、稀硫酸的反应实验探究9-3 有大量气泡产生,反应较快无明显现象有气泡产生,溶液由无色变为浅绿色实验探究实验结论:1.能与盐酸、稀硫酸反应的金属有 铁、锌锌、铁、铜以上三种金属活动性顺序为:
Zn Fe Cu 金属活动性由强到弱 常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金金属活动性顺序由强逐渐减弱结论:简记:嫁给那美女 身体细纤轻 统共一百斤 常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序由强逐渐减弱稀盐酸的化学性质(1)稀盐酸和镁条(Mg)反应 Na2CO3 + 2 HCl =2NaCl + H2O + CO2↑Mg + 2HCl = MgCl2 + H2↑Fe+ 2HCl = FeCl2 + H2↑ Fe2O3+ 6HCl = 2FeCl3 +3H2O 稀盐酸和铁(Fe)反应(2)稀盐酸和铁锈(主要成分Fe2O3)反应(3)稀盐酸和碳酸钠(Na2CO3)反应注意:单质的铁和酸反应只能生成+2价的亚铁
化合物的铁和酸反应,反应前后铁元素的化合价不变复分解反应如果把上述实验中的稀盐酸换成稀硫酸,
你认为是否会产生类似的实验现象? 请试着写出这些反应的化学方程式。
Mg + H2SO4 =
Fe + H2SO4 =
Fe2O3 + H2SO4 =
Na2CO3 + H2SO4= MgSO4 + H2↑
FeSO4 + H2↑
3 Fe2(SO4)3 + 3H2O
Na2SO4 + H2O + CO2↑盐Mg + 2HCl = MgCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3+ 3H2O
Na2CO3 + 2HCl =2NaCl + H2O + CO2↑
Na2CO3 + H2SO4 =Na2SO4+ H2O + CO2↑
AgNO3 + HCl = AgCl ↓ +HNO3
BaCl2 + H2SO4 = BaSO4↓+ 2HCl2、酸+金属 →盐 + 氢气3、酸+金属氧化物→ 盐 + 水 4、酸+某些盐 →新酸 + 新盐分析上述有关酸的反应的化学方程式,从组成上看,酸可以与哪些类别的物质反应?1、与酸碱指示剂反应酸的化学性质
① 与酸碱指示剂所用
② 酸与金属单质反应生成盐和H2
③ 酸与金属氧化物反应生成盐和H2O
④ 酸与某些盐反应生成新盐和新酸 因为稀盐酸和稀硫酸中都含有H+
由于不同酸的酸根不同所以其性质也存在差异稀盐酸和稀硫酸具有相似的化学性质的原因1、铁制品电镀前放在盐酸池中
2、向酸性土壤中撒熟石灰3、实验室制取氢气4、用醋酸浸泡除去水壶中的水垢稀硫酸锌粒 水垢的主要成分:CaCO3除去铁锈 (主要成分Fe2O3)1、稀释浓硫酸时,一定要把 沿器壁
慢慢注入 里,并不断搅拌。
2、下列物质暴露在空气中,质量会增加的
是
A. 浓硫酸 B. 酒精 C. 浓盐酸 浓硫酸水A3、下列物质能和盐酸反应生成黄色溶液的是
A. Fe B. Fe2O3 C. Mg D.CaCO3B4、酸的溶液具有相似的化学性质,是因为酸溶液
里都含有
A.氢原子 B.氢离子 C. 氢分子 D.酸根离子 B1、下列说法不正确的是
A.不能用铁制容器盛放稀盐酸和稀硫酸
B.用稀盐酸可以除去热水瓶中的水垢主要成分
CaCO3和 Mg(OH)2
C.用含Al(OH)3的药物胃舒平可治疗胃酸过多
D.铁制零件在电镀前,放在盐酸池中浸泡时间越长
越好
D2、用化学方程式解释:
① 铁制零件在电镀前,要放在盐酸池中浸泡。
② 用铁锅炒菜可补铁。
③ 用适量的稀盐酸可除出热水瓶胆壁上的水垢。
水垢的主要成分是CaCO3和Mg(OH)2Fe2O3 + 6HCl = 2FeCl3 + 3H2OFe + 2CH3COOH = Fe(CH3COO)2 + H2↑CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O实验室里的一瓶蒸馏水和一瓶稀盐酸丢失了标签,你能帮老师把它们鉴别出来吗?你有哪些好方法?1.用镁条(或其它活泼金属)2.用生锈铁钉3.用碳酸钙思考
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
