课题2 原子的结构(共24张ppt)
图片预览







文档简介
课件24张PPT。第三单元 物质构成的奥秘课题2 原子的结构(1) 道尔顿原子模型 1803年追溯原子结构模型的变迁史观点:
1.原子都是不能再分的粒子 2.同种类元素的原子各种性质和质量都相同 3.原子是微小的实心球体
英国科学家道尔顿 (J.Dalton , 1766~1844)模型:
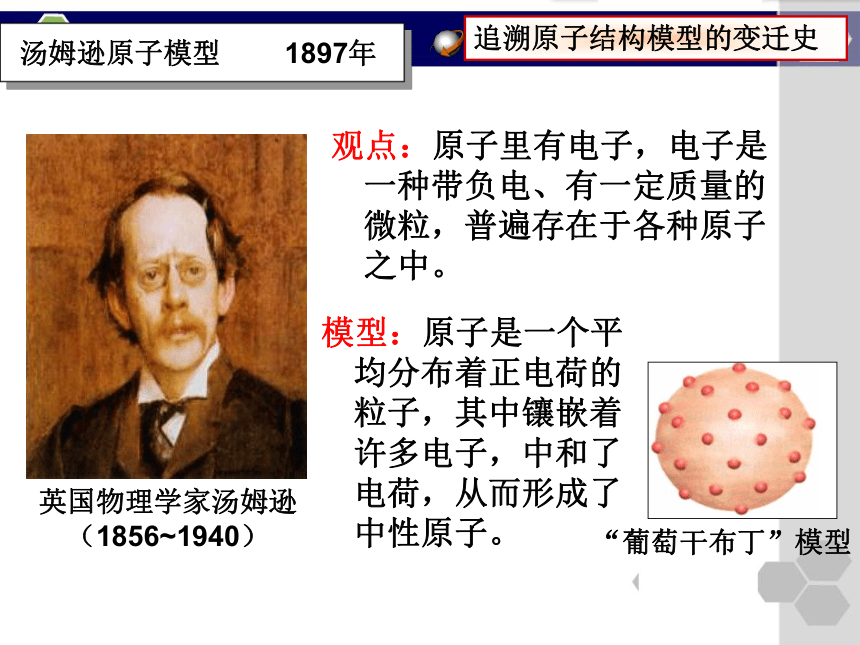
原子是坚实的、不可再分的实心球。汤姆逊原子模型 1897年观点:原子里有电子,电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。英国物理学家汤姆逊
(1856~1940)模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。追溯原子结构模型的变迁史卢瑟福原子模型 1911年英国科学家卢瑟福
(1871~1937)模型:
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。观点:
1.大部分粒子毫无阻挡的穿过了金箔;
2.少数粒子发生了偏转;
3.极少数粒子被反弹回来。 原子结构探究之旅追溯原子结构模型的变迁史玻尔原子模型 1913年丹麦物理学家玻尔
(N.Bohr,1885~1962)玻尔原子模型 : 当原子只有一个电子时,电子沿特定球形轨道运转;当原子中有多个电子时,它们将分布在多个球壳中绕核运动。追溯原子结构模型的变迁史 1964年,科学家们发现:质子是由夸克构成的。 物质具有无限可分性追溯原子结构模型的变迁史第三单元 物质构成的奥秘课题2 原子的结构(1) 如东县实验中学 刘广斌学习目标 1.知道原子的构成以及构成粒子之间的关系。
2.了解原子核外电子的分层排布、原子结构示意图,初步
学会从微观的角度认识原子化学性质与结构的关系。
3.了解有关探索原子结构的科学史实,培养大胆猜想、勇
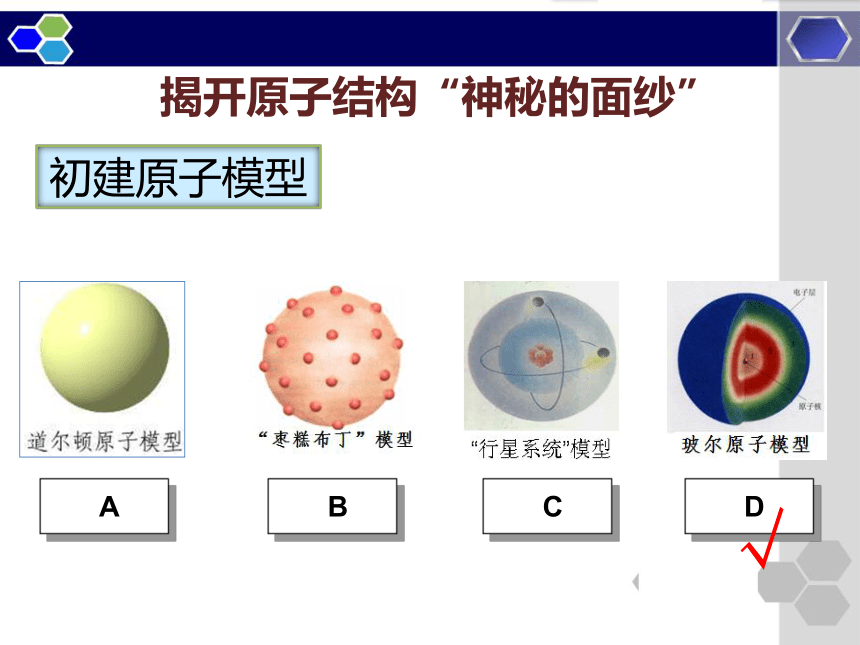
于探索的科学精神。初建原子模型揭开原子结构“神秘的面纱”√道尔顿原子模型 1803年观点:
1.原子都是不能再分的粒子 2.同种类元素的原子各种性质和质量都相同 3.原子是微小的实心球体
模型:
原子是坚实的、不可再分的实心球。揭开原子结构“神秘的面纱”汤姆逊原子模型 1897年观点:
原子里有电子,电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。模型:
原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。揭开原子结构“神秘的面纱”卢瑟福原子模型 1911年实验现象:
1.大部分粒子毫无阻挡穿过了金箔;
2.少数粒子发生了偏转;
3.极少数粒子被反弹回来。 模型:原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。揭开原子结构“神秘的面纱”玻尔原子模型 1913年观点:
当原子只有一个电子时,电子沿特定球形轨道运转;当原子中有多个电子时,它们将分布在多个球壳中绕核运动。玻尔原子模型 :揭开原子结构“神秘的面纱”1.说说你想象中的原子,是什么样儿?2.根据图3-9,你又获得什么信息?友情提醒:遇到疑难可相互讨论!揭开原子结构“神秘的面纱”带正电不带电质子中子(中心,带正电)(核外,带负电)原子核核外电子一、原子的构成1.用第一人称描述原子的构成。
(如:“我是某原子,我是由……。”)
2.不同种类的原子,质子数__________
(填“相同”或“不相同”)
3.在原子中的各粒子间的数目关系怎样呢? ________________________________;
________________________________;
________________________________。不同种类的原子质子数不同原子中:质子数=核电荷数=核外电子数质子数不一定等于中子数能 量
离核远近电 子 层1 2 3 4 5 6 71.核外电子运动有哪些特点?2.如何表示核外电子的分层排布?3.核外电子排布有怎样的特征?(阅读课本从54页至55页第一段)电子层该电子层上的电子数为6氧原子核及核内有8个质子数 氧原子的结构示意图探寻电子的“神秘行踪”探寻电子的排布规律1 2 3 4 5 6 7 8第一层最多容纳 ,第二层最多容纳 ,最外层最多容纳 。 2个 8个 8个1.每一横行原子核外电子排布有何共同特征?有什么递变规律 ?
2.每一纵行原子核外电子排布有何共同特征?有什么递变规律?认识电子在化学变化中的作用结构不稳定探寻电子的“神秘行踪”稳定不易得失相对
稳定不稳定不稳定不稳定不稳定 失去电子得到电子8(He为2 )一般少于4个一般多于4个本节课你有哪些收获呢?【盘点收获】 1. 以“我是某(氢、碳、氧、钠)原
子”为题,写一篇科普习作。
2. 想象当钠原子与氯原子相遇后,
会……
课后思考谢谢同学们!
同学们再见!88
1.原子都是不能再分的粒子 2.同种类元素的原子各种性质和质量都相同 3.原子是微小的实心球体
英国科学家道尔顿 (J.Dalton , 1766~1844)模型:
原子是坚实的、不可再分的实心球。汤姆逊原子模型 1897年观点:原子里有电子,电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。英国物理学家汤姆逊
(1856~1940)模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。追溯原子结构模型的变迁史卢瑟福原子模型 1911年英国科学家卢瑟福
(1871~1937)模型:
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。观点:
1.大部分粒子毫无阻挡的穿过了金箔;
2.少数粒子发生了偏转;
3.极少数粒子被反弹回来。 原子结构探究之旅追溯原子结构模型的变迁史玻尔原子模型 1913年丹麦物理学家玻尔
(N.Bohr,1885~1962)玻尔原子模型 : 当原子只有一个电子时,电子沿特定球形轨道运转;当原子中有多个电子时,它们将分布在多个球壳中绕核运动。追溯原子结构模型的变迁史 1964年,科学家们发现:质子是由夸克构成的。 物质具有无限可分性追溯原子结构模型的变迁史第三单元 物质构成的奥秘课题2 原子的结构(1) 如东县实验中学 刘广斌学习目标 1.知道原子的构成以及构成粒子之间的关系。
2.了解原子核外电子的分层排布、原子结构示意图,初步
学会从微观的角度认识原子化学性质与结构的关系。
3.了解有关探索原子结构的科学史实,培养大胆猜想、勇
于探索的科学精神。初建原子模型揭开原子结构“神秘的面纱”√道尔顿原子模型 1803年观点:
1.原子都是不能再分的粒子 2.同种类元素的原子各种性质和质量都相同 3.原子是微小的实心球体
模型:
原子是坚实的、不可再分的实心球。揭开原子结构“神秘的面纱”汤姆逊原子模型 1897年观点:
原子里有电子,电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。模型:
原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。揭开原子结构“神秘的面纱”卢瑟福原子模型 1911年实验现象:
1.大部分粒子毫无阻挡穿过了金箔;
2.少数粒子发生了偏转;
3.极少数粒子被反弹回来。 模型:原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。揭开原子结构“神秘的面纱”玻尔原子模型 1913年观点:
当原子只有一个电子时,电子沿特定球形轨道运转;当原子中有多个电子时,它们将分布在多个球壳中绕核运动。玻尔原子模型 :揭开原子结构“神秘的面纱”1.说说你想象中的原子,是什么样儿?2.根据图3-9,你又获得什么信息?友情提醒:遇到疑难可相互讨论!揭开原子结构“神秘的面纱”带正电不带电质子中子(中心,带正电)(核外,带负电)原子核核外电子一、原子的构成1.用第一人称描述原子的构成。
(如:“我是某原子,我是由……。”)
2.不同种类的原子,质子数__________
(填“相同”或“不相同”)
3.在原子中的各粒子间的数目关系怎样呢? ________________________________;
________________________________;
________________________________。不同种类的原子质子数不同原子中:质子数=核电荷数=核外电子数质子数不一定等于中子数能 量
离核远近电 子 层1 2 3 4 5 6 71.核外电子运动有哪些特点?2.如何表示核外电子的分层排布?3.核外电子排布有怎样的特征?(阅读课本从54页至55页第一段)电子层该电子层上的电子数为6氧原子核及核内有8个质子数 氧原子的结构示意图探寻电子的“神秘行踪”探寻电子的排布规律1 2 3 4 5 6 7 8第一层最多容纳 ,第二层最多容纳 ,最外层最多容纳 。 2个 8个 8个1.每一横行原子核外电子排布有何共同特征?有什么递变规律 ?
2.每一纵行原子核外电子排布有何共同特征?有什么递变规律?认识电子在化学变化中的作用结构不稳定探寻电子的“神秘行踪”稳定不易得失相对
稳定不稳定不稳定不稳定不稳定 失去电子得到电子8(He为2 )一般少于4个一般多于4个本节课你有哪些收获呢?【盘点收获】 1. 以“我是某(氢、碳、氧、钠)原
子”为题,写一篇科普习作。
2. 想象当钠原子与氯原子相遇后,
会……
课后思考谢谢同学们!
同学们再见!88
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
