人教版九年级上册第三单元课题2 原子的结构第3课时 相对原子质量(共33张ppt)
文档属性
| 名称 | 人教版九年级上册第三单元课题2 原子的结构第3课时 相对原子质量(共33张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-17 08:44:01 | ||
图片预览










文档简介
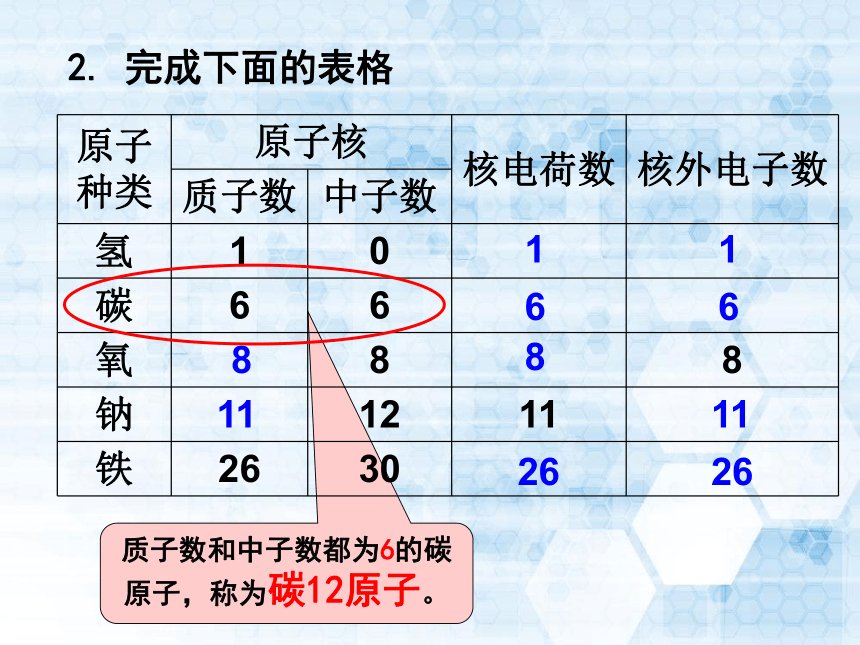
课件33张PPT。牛郎织女 相隔约16光年银河第三单元 物质构成的奥秘课题2 原子的结构人教2011课标版九年级化学上册第3课时 相对原子质量原子核原子核外电子质子中子(带正电)(带一个单位的负电荷)(不带电)(带一个单位的正电荷)1. 原子中微粒有哪些?它们的电量及电性情况如何?知识回顾质子数和中子数都为6的碳原子,称为碳12原子。2. 完成下面的表格11668811112626经测定,几种原子的质量:一个氧原子的质量=2.657×10-26kg一个钠原子的质量=3.818×10-26kg一个氢原子的质量
0.000 000 000 000 000 000 000 000 001674kg=1.674×10-27kg一个碳原子的质量
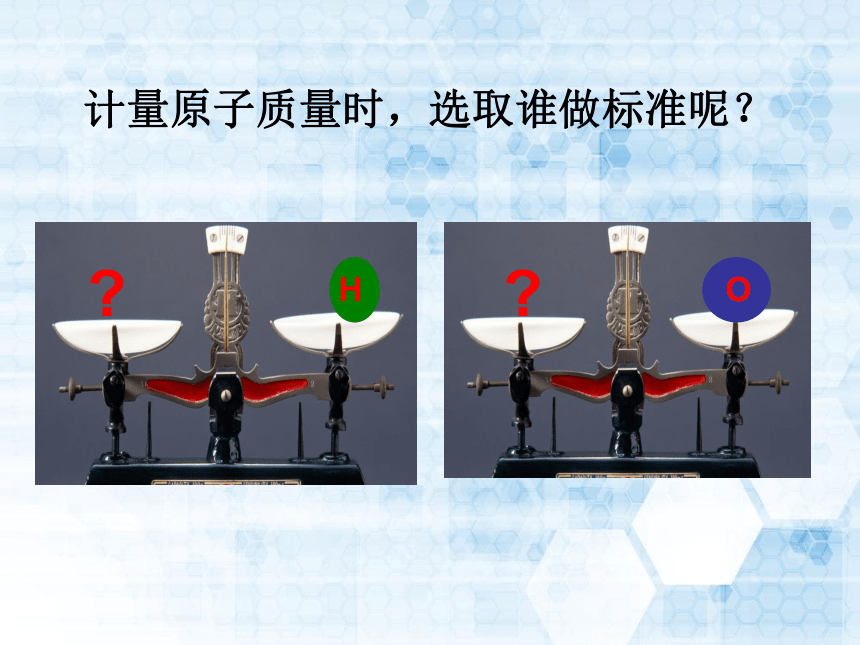
0.000 000 000 000 000 000 000 000 01993kg=1.993×10-26kg0.000 000 000 000 000 000 000 000 02657kg0.000 000 000 000 000 000 000 000 03818kg课堂探究把一个苹果作为参照物,计其相对质量为1类比分析 计量原子质量时,选取谁做标准呢?HO?? 相对原子质量史话 英国 道尔顿:
化学史上测定相对原子质量的第一人 ,以氢原子的质量为标准,规定为1,测定其他原子的相对原子质量。1803年10月21日,道尔顿在曼彻斯特的“文学和哲学学会”上阐述他的原子论观点时,第一次公布了6种元素的相对原子质量。
相对原子质量史话 瑞典 贝采尼乌斯:
认为选择氧比选择氢作为相对原子质量标准更合适,以氧为标准,规定为100,通过实验的分析和测定于在1814~1826年的12年里连续发表了三张相对原子质量表,所列元素多达49种 比利时 斯达
美国 理查兹: 相对原子质量史话 在1860年提出采用氧为16的相对原子质量基准。测定了多种元素的精确相对原子质量,其精度可达小数点后4位数字,与现在相对原子质量相当接近。 美国 尼尔
厄兰得:
1957年提出以碳12原子的1/12为基准的方案。这一方案得到德国著名质谱学家马陶赫的支持。 1960年国际纯粹与应用化学联合会接受了这项建议,于是一个为世界公认的新相对原子质量准诞生了。 相对原子质量史话 相对原子质量史话 中国 张青莲:
中国科学院院士,于1983年当选为国际原子量委员会委员。主持测定了铟、铱、铕、铈、铒、锗、锌、镝几种元素相对原子质量的新值,被国际原子量 采用为国际新标准。 国际上统一:
以碳12原子质量的1/12作为标准。HO碳12原子 以一个碳-12原子(其中含6个质子和6个中子)质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。(符号为Ar)碳12原子的质量= 1.993×10-26Kg氢的相对原子质量==1氢原子质量标准相对原子质量Ar(x)=mxmc×表达式Ar(x) 表示某原子的相对原子质量;
mx 表示某原子的实际质量;
mc 表示碳12原子的实际质量。 相对原子质量是一个比值,单位为“1”,省略不写。已知一个氢原子的质量
为1.674×10-27kg,求其
相对原子质量。已知一个碳原子的质量为1.993×10-26kg,求其相对原子质量。请列出计算式:=1=12 相对原子质量的计算 碳12原子质量的1/12为1.664×10-27kg结果四舍五入后取整数已知一个钠原子的质量为3.818×10-26kg,求其相对原子质量。已知一个氧原子的质量
为2.657×10-26kg,求其
相对原子质量。请列出计算式:=16=23 相对原子质量的计算 碳12原子质量的1/12为1.664×10-27kg结果四舍五入后取整数已知一个氢原子的质量
为1.674×10-27kg,求其
相对原子质量。已知一个碳原子的质量
为1.993×10-26kg,求其
相对原子质量。请列出计算式:你能快速计算出碳原子是氢原子质量的几倍吗? 相对原子质量的计算 Ar(C)Ar(H)=== mAmc×Ar(A)Ar(B)==mBmc× 相对原子质量的计算 原子实际质量之比等于相对原子质量之比即:思考讨论问题:现有相同质量的铜片和铁片,哪个含有的原子数目更多? 相对原子质量: Cu—64 Fe—56铜的相对原子质量大于铁的相对原子质量,所以铜原子实际质量也大于铁原子实际质量。 铁片含有的原子数目更多!1、下列叙述中,正确的是( )
A.相对原子质量就是原子质量的简称
B.相对原子质量可以用克或千克作单位
C.相对原子质量是一个比值,单位为“1”
D.计算相对原子质量是以氢原子质量为标准计算2、氮原子的相对原子质量为14,表示的意义是( )
A.氮原子核中有14个质子
B.一个氮原子的质量为14g
C.一个氮原子的质量是一个碳12原子质量的1/12的14倍
D.一个氮原子的质量是一个碳12原子质量的14倍学以致用CC3、已知碳12原子的质量为m kg,一个钼原子的质量为8m kg,则钼原子的相对原子质量为( )
A. 96 B. 72 C. 48 D.36A4、甲、乙两种原子的质量之比是2︰3,若甲的相对原子质量为12,则乙的相对原子质量为( )
A、18 B、9 C、27 D、24A5、一种碳原子和镁原子的相对原子质量分别12和24,则碳原子和镁原子的质量比是( )
A、2∶1 B、1∶2
C、1∶24 D、24∶1B6、已知1个碳12原子的质量为 a kg,则实际质量为
b kg的另一种原子的相对原子质量为( )
A.12b/a kg B.12b/a
C.12a/b D.12a/b kgB+=+=+=+= 相对原子质量=质子数+中子数我的发现16811?问题1:决定原子质量大小的主要微粒是?碳12原子质量的1/12为1.664×10-27kg问题2:质子和中子的质量跟相对原子质量标准相比较,均约等于? 均约等于1思考讨论由于电子的质量很小,所以原子的质量主要集中在原子核上(即质子和中子)Ar(x)=mxmc×≈m质子mc×n质子×+n中子×m中子 因为质子和中子的质量都约等于碳12原子质量的1/12≈n质子n中子+Ar问题3:为什么相对原子质量等于质子数加中子数? 相对原子质量=质子数+中子数 电子的质量忽略不计D7、钠原子有11个质子和12个中子,下列说法不正确的是( )
A、钠原子的相对原子质量为23
B、钠原子的核外有11个电子
C、钠原子不显电性
D、钠原子的相对原子质量为23g8、某原子的核电荷数为18,中子数比电子数多4,则该原子的相对原子质量是( )
A、42 B、40 C、44 D、22B9、阳离子R2+中含有18个电子,R的相对原子质量为40,则一个R原子中所含中子数为( )
A.40 B.22 C.20 D.18C学以致用11、已知某原子中的电子、质子、中子等粒子数之和为40,其中14个粒子不带电,则该原子的相对原子质量为 。10、1991年,我国著名化学家张青莲与另一位科学家合作,测定了铟(In)元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为 ,中子数为 。49662712、已知碳12原子的质量为1.993×10-26 Kg,A原子的质量为5.146×10-26Kg,若A原子核内质子数比中子数少一个,求:
(1)A原子的相对原子质量(四舍五入后取整数)
(2)A原子的核外电子数5.146×10-26kg1.993×10-27kg×Ar(A)=≈31(1)(2)设质子数为X,则中子数为X+1Ar(A)= X+X+1=31X=15核外电子数 = 质子数 = 15查找相对原子质量查找相对原子质量相对原子质量1、定义:以一个碳12原子质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。
2、符号:Ar 单位:“1”省略不写
3、表达式:
4、原子的质量比等于相对原子质量之比
5、相对原子质量=质子数+中子数
Ar(x)=mxmc×课堂小结同学们,在本堂课中,你收获到了什么?还有什么疑惑?谢谢大家!
化学史上测定相对原子质量的第一人 ,以氢原子的质量为标准,规定为1,测定其他原子的相对原子质量。1803年10月21日,道尔顿在曼彻斯特的“文学和哲学学会”上阐述他的原子论观点时,第一次公布了6种元素的相对原子质量。
相对原子质量史话 瑞典 贝采尼乌斯:
认为选择氧比选择氢作为相对原子质量标准更合适,以氧为标准,规定为100,通过实验的分析和测定于在1814~1826年的12年里连续发表了三张相对原子质量表,所列元素多达49种 比利时 斯达
美国 理查兹: 相对原子质量史话 在1860年提出采用氧为16的相对原子质量基准。测定了多种元素的精确相对原子质量,其精度可达小数点后4位数字,与现在相对原子质量相当接近。 美国 尼尔
厄兰得:
1957年提出以碳12原子的1/12为基准的方案。这一方案得到德国著名质谱学家马陶赫的支持。 1960年国际纯粹与应用化学联合会接受了这项建议,于是一个为世界公认的新相对原子质量准诞生了。 相对原子质量史话 相对原子质量史话 中国 张青莲:
中国科学院院士,于1983年当选为国际原子量委员会委员。主持测定了铟、铱、铕、铈、铒、锗、锌、镝几种元素相对原子质量的新值,被国际原子量 采用为国际新标准。 国际上统一:
以碳12原子质量的1/12作为标准。HO碳12原子 以一个碳-12原子(其中含6个质子和6个中子)质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。(符号为Ar)碳12原子的质量= 1.993×10-26Kg氢的相对原子质量==1氢原子质量标准相对原子质量Ar(x)=mxmc×表达式Ar(x) 表示某原子的相对原子质量;
mx 表示某原子的实际质量;
mc 表示碳12原子的实际质量。 相对原子质量是一个比值,单位为“1”,省略不写。已知一个氢原子的质量
为1.674×10-27kg,求其
相对原子质量。已知一个碳原子的质量为1.993×10-26kg,求其相对原子质量。请列出计算式:=1=12 相对原子质量的计算 碳12原子质量的1/12为1.664×10-27kg结果四舍五入后取整数已知一个钠原子的质量为3.818×10-26kg,求其相对原子质量。已知一个氧原子的质量
为2.657×10-26kg,求其
相对原子质量。请列出计算式:=16=23 相对原子质量的计算 碳12原子质量的1/12为1.664×10-27kg结果四舍五入后取整数已知一个氢原子的质量
为1.674×10-27kg,求其
相对原子质量。已知一个碳原子的质量
为1.993×10-26kg,求其
相对原子质量。请列出计算式:你能快速计算出碳原子是氢原子质量的几倍吗? 相对原子质量的计算 Ar(C)Ar(H)=== mAmc×Ar(A)Ar(B)==mBmc× 相对原子质量的计算 原子实际质量之比等于相对原子质量之比即:思考讨论问题:现有相同质量的铜片和铁片,哪个含有的原子数目更多? 相对原子质量: Cu—64 Fe—56铜的相对原子质量大于铁的相对原子质量,所以铜原子实际质量也大于铁原子实际质量。 铁片含有的原子数目更多!1、下列叙述中,正确的是( )
A.相对原子质量就是原子质量的简称
B.相对原子质量可以用克或千克作单位
C.相对原子质量是一个比值,单位为“1”
D.计算相对原子质量是以氢原子质量为标准计算2、氮原子的相对原子质量为14,表示的意义是( )
A.氮原子核中有14个质子
B.一个氮原子的质量为14g
C.一个氮原子的质量是一个碳12原子质量的1/12的14倍
D.一个氮原子的质量是一个碳12原子质量的14倍学以致用CC3、已知碳12原子的质量为m kg,一个钼原子的质量为8m kg,则钼原子的相对原子质量为( )
A. 96 B. 72 C. 48 D.36A4、甲、乙两种原子的质量之比是2︰3,若甲的相对原子质量为12,则乙的相对原子质量为( )
A、18 B、9 C、27 D、24A5、一种碳原子和镁原子的相对原子质量分别12和24,则碳原子和镁原子的质量比是( )
A、2∶1 B、1∶2
C、1∶24 D、24∶1B6、已知1个碳12原子的质量为 a kg,则实际质量为
b kg的另一种原子的相对原子质量为( )
A.12b/a kg B.12b/a
C.12a/b D.12a/b kgB+=+=+=+= 相对原子质量=质子数+中子数我的发现16811?问题1:决定原子质量大小的主要微粒是?碳12原子质量的1/12为1.664×10-27kg问题2:质子和中子的质量跟相对原子质量标准相比较,均约等于? 均约等于1思考讨论由于电子的质量很小,所以原子的质量主要集中在原子核上(即质子和中子)Ar(x)=mxmc×≈m质子mc×n质子×+n中子×m中子 因为质子和中子的质量都约等于碳12原子质量的1/12≈n质子n中子+Ar问题3:为什么相对原子质量等于质子数加中子数? 相对原子质量=质子数+中子数 电子的质量忽略不计D7、钠原子有11个质子和12个中子,下列说法不正确的是( )
A、钠原子的相对原子质量为23
B、钠原子的核外有11个电子
C、钠原子不显电性
D、钠原子的相对原子质量为23g8、某原子的核电荷数为18,中子数比电子数多4,则该原子的相对原子质量是( )
A、42 B、40 C、44 D、22B9、阳离子R2+中含有18个电子,R的相对原子质量为40,则一个R原子中所含中子数为( )
A.40 B.22 C.20 D.18C学以致用11、已知某原子中的电子、质子、中子等粒子数之和为40,其中14个粒子不带电,则该原子的相对原子质量为 。10、1991年,我国著名化学家张青莲与另一位科学家合作,测定了铟(In)元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为 ,中子数为 。49662712、已知碳12原子的质量为1.993×10-26 Kg,A原子的质量为5.146×10-26Kg,若A原子核内质子数比中子数少一个,求:
(1)A原子的相对原子质量(四舍五入后取整数)
(2)A原子的核外电子数5.146×10-26kg1.993×10-27kg×Ar(A)=≈31(1)(2)设质子数为X,则中子数为X+1Ar(A)= X+X+1=31X=15核外电子数 = 质子数 = 15查找相对原子质量查找相对原子质量相对原子质量1、定义:以一个碳12原子质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。
2、符号:Ar 单位:“1”省略不写
3、表达式:
4、原子的质量比等于相对原子质量之比
5、相对原子质量=质子数+中子数
Ar(x)=mxmc×课堂小结同学们,在本堂课中,你收获到了什么?还有什么疑惑?谢谢大家!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
