人教版九年级上册第三单元课题3 元素第二课时 - 元 素 周 期 表(共31张ppt)
文档属性
| 名称 | 人教版九年级上册第三单元课题3 元素第二课时 - 元 素 周 期 表(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-17 08:50:29 | ||
图片预览








文档简介
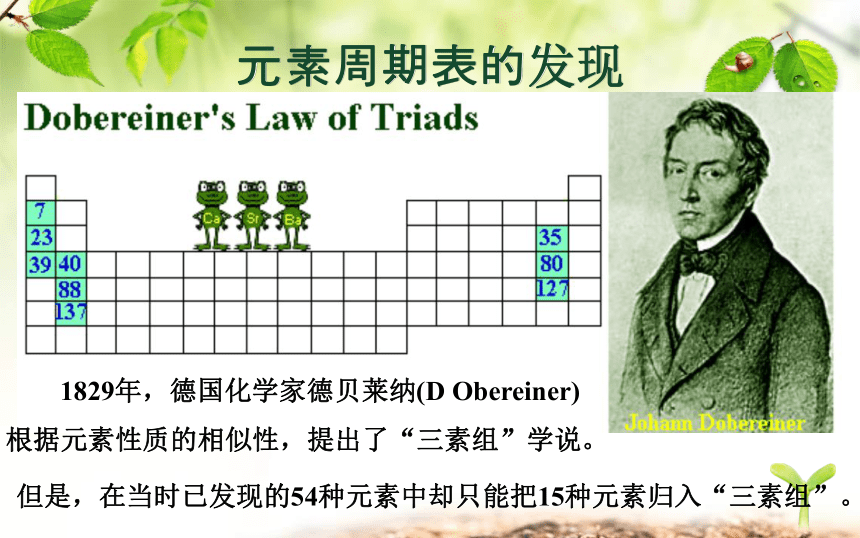
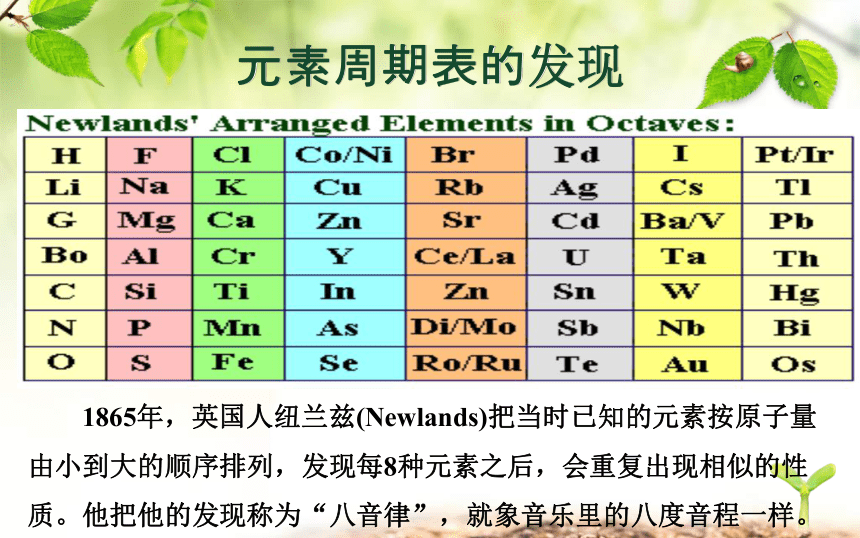
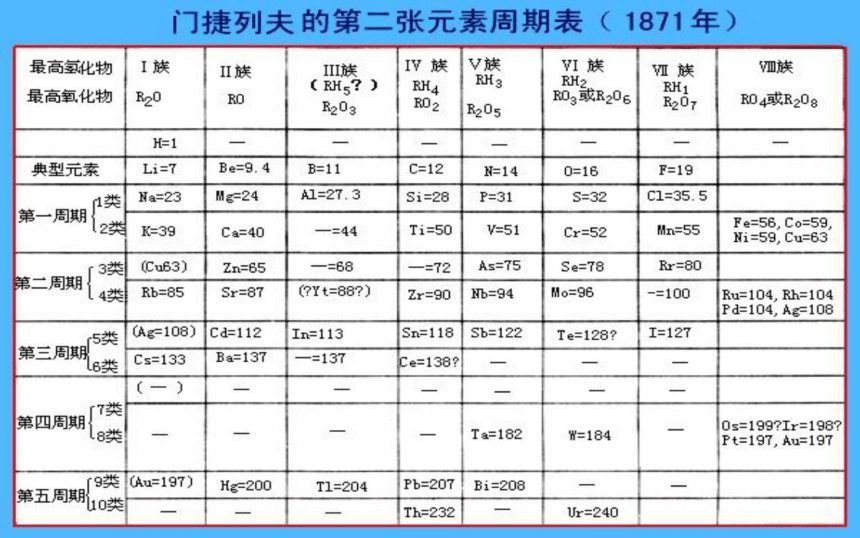
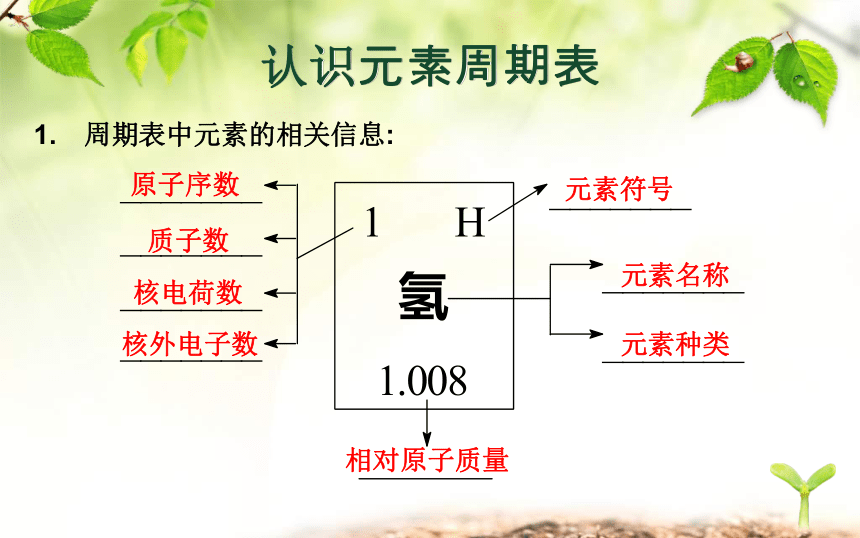
课件31张PPT。元 素 周 期 表元素周期表的发现画出下列元素的原子结构示意图元素周期表的发现 1829年,德国化学家德贝莱纳(D Obereiner)根据元素性质的相似性,提出了“三素组”学说。 但是,在当时已发现的54种元素中却只能把15种元素归入“三素组”。元素周期表的发现 1865年,英国人纽兰兹(Newlands)把当时已知的元素按原子量由小到大的顺序排列,发现每8种元素之后,会重复出现相似的性质。他把他的发现称为“八音律”,就象音乐里的八度音程一样。1869年门捷列夫绘制的第一张元素周期表。一、认识元素周期表元素周期表的发现画出下列元素的原子结构示意图认识元素周期表1. 周期表中元素的相关信息:原子序数质子数核电荷数核外电子数元素符号元素名称元素种类相对原子质量认识元素周期表(2014南京)8.在元素周期表中锡元素的某些信息如图所示,下列有关锡的说法正确的是( )
A. 属于非金属元素
B. 原子序数为50
C. 相对原子质量是118.7 g
D. 原子核内中子数为50B2.元素周期表的结构
(1)周期:
①个数:元素周期表中有 个周期。
②特点:同周期中元素的 相同;周期序= 。7电子层数电子层数(2)族:
①个数:元素周期表中有 个纵行,但只有 个族。
②特点:主族元素的原子族序数= 。1816最外层电子数(3)从元素种类看,从第二周期开始,每一横行从左到右由
元素过渡到 元素,并以 元素结尾。金属非金属稀有气体(4)从原子结构上看,同一横行的元素的原子具有相同的
数,我们把每一横行称为一个 ,同一纵行具有相同的 数,我们把每一纵行称为一个 。电子层周期最外层电子族(5)在化学变化中,第1纵行的元素Li,,Na的原子比较容易 电子,第6纵行的元素O,S的原子比较容易 电子,通常达到8个电子的稳定结构。由此可见元素的性质与原子的 关系密切。失得最外层电子数二、元素周期表的应用元素周期表的应用(1)表中不同种元素最本质的区别是 。
(2)用符号表示带一个单位正电荷且质子数为11的离子:
, 。Na+质子数不同NH4+元素周期表的应用(3)第16号元素位于第 周期,第 族,属于 (填“金属”或“非金属”)元素,它在化学反应中容易 (填“得”或“失”)电子。三VIA非金属得元素周期表的应用(4)化学反应中,第I纵行的元素原子比较容易 电子;第VI纵行的元素原子比较容易 电子,都通常达到稳定结构。可见元素的化学性质主要决定于原子的 。所以与氯(Cl)元素化学性质相似的元素为 。失最外层电子数得F处于同一纵行(同一族)的元素元素周期表的应用(5)一般地说,电子层数相同的原子(稀有气体除外),原子的半径随原子序数的递增而减小;最外层电子数相同的原子,原子的半径随电子层数的增加而增大。请比较:磷原子的半径 (填“>”或“<”,下同)氮原子的半径;氟原子的半径 氮原子的半径。><元素周期表的应用(6)研究表明:同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强。由此推断:第三周期中得电子能力最强的是 原子;失电子能力最强的是 原子;它们形成的化合物的化学式为 ,该物质由 构成。ClNaNaCl离子元素周期表的应用(7)通过分析可发现同一周期之间的排列有一定的规律,那么每一周期元素的原子结构从左到右排列所遵循的规律有
, 。原子电子层数相同原子的质子数(核电荷数)依次递增原子的电子数,最外层电子数依次递增元素周期表的应用在同一族中,各元素的原子结构呈现的规律有
, 。电子层数从上到下依次递增最外层电子数相同直 通 中 考(2016南京中考)在元素周期表中硅元素的某些信息如右图所示,下列有关硅的说法不正确的是( )
A.属于金属元素
B.元素符号为Si
C.原子核内质子数为14
D.相对原子质量是28.09
A直 通 中 考(2011成都中考)下图为元素周期表的一部分.下列叙述错误的是( )
A.钙的核电荷数是20
B.镁在化学反应中较易失去电子
C.硫离子的结构示意图是
D.每个周期结尾元素的化学性质比较稳定C直 通 中 考(2012 湛江中考)元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获得信息填空。
(1)氮原子的质子数是 。
(2)氮元素的原子结构示意图是 (填字母)。
(3)氮元素的最高正价 ,最低负价为 。
(4)氮元素是 元素(填“金属”或“非金属”)。
(5)已知镁元素的化合价为+2,氮化镁的化学式为 。7A. B. C. D. B+5-3非金属最外层电子数8-最外层电子数直 通 中 考(2013南京中考) 26.(7分)核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:(1)在第三周期中,各原子结构的共同之处是 ,
该周期中,各原子核外电子排布的变化规律是
, 都有3个电子层最外层电子数从左到右依次递增直 通 中 考(2)在第三周期中,元素类型的变化情况是:从左到右由 元素过渡到 元素,并以稀有气体元素结尾。金属非金属直 通 中 考(3)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:
阳离子 ,阴离子 。Na+Mg2+Al3+F-O2-N3-
A. 属于非金属元素
B. 原子序数为50
C. 相对原子质量是118.7 g
D. 原子核内中子数为50B2.元素周期表的结构
(1)周期:
①个数:元素周期表中有 个周期。
②特点:同周期中元素的 相同;周期序= 。7电子层数电子层数(2)族:
①个数:元素周期表中有 个纵行,但只有 个族。
②特点:主族元素的原子族序数= 。1816最外层电子数(3)从元素种类看,从第二周期开始,每一横行从左到右由
元素过渡到 元素,并以 元素结尾。金属非金属稀有气体(4)从原子结构上看,同一横行的元素的原子具有相同的
数,我们把每一横行称为一个 ,同一纵行具有相同的 数,我们把每一纵行称为一个 。电子层周期最外层电子族(5)在化学变化中,第1纵行的元素Li,,Na的原子比较容易 电子,第6纵行的元素O,S的原子比较容易 电子,通常达到8个电子的稳定结构。由此可见元素的性质与原子的 关系密切。失得最外层电子数二、元素周期表的应用元素周期表的应用(1)表中不同种元素最本质的区别是 。
(2)用符号表示带一个单位正电荷且质子数为11的离子:
, 。Na+质子数不同NH4+元素周期表的应用(3)第16号元素位于第 周期,第 族,属于 (填“金属”或“非金属”)元素,它在化学反应中容易 (填“得”或“失”)电子。三VIA非金属得元素周期表的应用(4)化学反应中,第I纵行的元素原子比较容易 电子;第VI纵行的元素原子比较容易 电子,都通常达到稳定结构。可见元素的化学性质主要决定于原子的 。所以与氯(Cl)元素化学性质相似的元素为 。失最外层电子数得F处于同一纵行(同一族)的元素元素周期表的应用(5)一般地说,电子层数相同的原子(稀有气体除外),原子的半径随原子序数的递增而减小;最外层电子数相同的原子,原子的半径随电子层数的增加而增大。请比较:磷原子的半径 (填“>”或“<”,下同)氮原子的半径;氟原子的半径 氮原子的半径。><元素周期表的应用(6)研究表明:同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强。由此推断:第三周期中得电子能力最强的是 原子;失电子能力最强的是 原子;它们形成的化合物的化学式为 ,该物质由 构成。ClNaNaCl离子元素周期表的应用(7)通过分析可发现同一周期之间的排列有一定的规律,那么每一周期元素的原子结构从左到右排列所遵循的规律有
, 。原子电子层数相同原子的质子数(核电荷数)依次递增原子的电子数,最外层电子数依次递增元素周期表的应用在同一族中,各元素的原子结构呈现的规律有
, 。电子层数从上到下依次递增最外层电子数相同直 通 中 考(2016南京中考)在元素周期表中硅元素的某些信息如右图所示,下列有关硅的说法不正确的是( )
A.属于金属元素
B.元素符号为Si
C.原子核内质子数为14
D.相对原子质量是28.09
A直 通 中 考(2011成都中考)下图为元素周期表的一部分.下列叙述错误的是( )
A.钙的核电荷数是20
B.镁在化学反应中较易失去电子
C.硫离子的结构示意图是
D.每个周期结尾元素的化学性质比较稳定C直 通 中 考(2012 湛江中考)元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获得信息填空。
(1)氮原子的质子数是 。
(2)氮元素的原子结构示意图是 (填字母)。
(3)氮元素的最高正价 ,最低负价为 。
(4)氮元素是 元素(填“金属”或“非金属”)。
(5)已知镁元素的化合价为+2,氮化镁的化学式为 。7A. B. C. D. B+5-3非金属最外层电子数8-最外层电子数直 通 中 考(2013南京中考) 26.(7分)核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:(1)在第三周期中,各原子结构的共同之处是 ,
该周期中,各原子核外电子排布的变化规律是
, 都有3个电子层最外层电子数从左到右依次递增直 通 中 考(2)在第三周期中,元素类型的变化情况是:从左到右由 元素过渡到 元素,并以稀有气体元素结尾。金属非金属直 通 中 考(3)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:
阳离子 ,阴离子 。Na+Mg2+Al3+F-O2-N3-
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
