第04章章末检测-试题同步练习2017-2018学年高一化学人教版(必修2)(解析版)
文档属性
| 名称 | 第04章章末检测-试题同步练习2017-2018学年高一化学人教版(必修2)(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 233.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-17 19:11:20 | ||
图片预览




文档简介
第四章 化学与自然资源的开发利用
章末检测
(时间:70分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 S 32
一、选择题:本题包括16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,主要是为了防止白色污染和节约资源
2.2017年11月21日,长征六号运载火箭将三颗视频卫星成功送入太空轨道,火箭的动力系统采用的是新一代大推力液氧煤油发动机。下列说法错误的是
A.液氧煤油发动机排出的气体无毒无污染
B.煤油是由多种碳氢化合物组成的混合物
C.箭体采用铝合金和碳/环氧复合材料是为了美观
D.卫星上的计算机芯片使用的是高纯单质硅
3.海洋是资源丰富的宝藏,据探测,海洋中含盐3%。海水中含量最多的盐是
A.NaCl B.MgCl2 C.Na2SO4 D.NaBr
4.下列有关自然资源的开发利用的叙述正确的是
A.通过催化重整,可从石油中获取环状烃
B.金属铝的冶炼可采取电解熔融氯化铝的方法
C.石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化
D.煤中含有的苯、甲苯、二甲苯等有机物,可通过煤的干馏来获得
5.下表中金属的冶炼原理与方法不完全正确的是
选项
冶炼原理
方法
A
2HgO2Hg+O2↑
热分解法
B
2Al2O3(熔融) 4Al+3O2↑
电解法
C
Cu2S+O22Cu+SO2
热分解法
D
Fe2O3+2Al2Fe+Al2O3
热还原法
6.不能用铝热反应制备的金属是
A.Cr B.Mg C.Mn D.Fe
7.能通过置换反应得到金属铁的是
A.Na与FeSO4溶液常温混合
B.CO通过灼热的Fe2O3
C.H2通入FeSO4溶液
D.Al和Fe3O4混合加热至高温
8.下列有关物质制备的说法正确的是
A.电解饱和食盐水可以得到金属钠、氢气和氯气
B.工业上将氯气通入澄清石灰水中制取漂白粉
C.用焦炭在高温下还原二氧化硅可得到粗硅
D.高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
9.从海带中提取碘的工业生产过程如下:
下列说法不正确的是
A.为保证I完全被氧化,应通入过量很多的Cl2
B.试剂R可以为NaOH溶液
C.H2SO4溶液作用之一是使滤液酸化
D.提纯晶体碘采用升华法
10.下列说法错误的是
A.从海水中提取食盐可采用结晶的方法
B.从海水中提取溴时,需控制海水呈酸性
C.饱和溴水中通入空气,溴水的浓度减小
D.实验室用石灰石和浓盐酸反应制备CO2
11.由海水提取溴的反应流程如下,下列说法正确的是
NaBrBr2HBrBr2
A.反应①为置换反应 B.反应②中生成S和HBr
C.氧化性:Cl2<Br2 D.反应③生成的Br2可以用乙醇萃取
12.海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是
A.步骤①中,除去粗盐中的、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B.步骤②中反应利用的原理:相同条件下NaHCO3的溶解度比NaCl小
C.步骤③在工业上通过向母液中加NaOH固体实现
D.步骤④利用了Br2的挥发性、还原性,该步的作用是富集
13.食品保鲜膜的材质有聚乙烯(PE)、聚氯乙烯(PVC)等种类。下列叙述错误的是
A.等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等
B.废弃的PE和PVC均可回收利用以减少白色污染
C.将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红
D.PVC的单体可由PE的单体与氯化氢加成制得
14.关于石油和石油化工的说法错误的是
A.石油的主要成分是碳氢化合物
B.石油分馏得到的各馏分仍是混合物
C.石油裂解气的主要成分是甲烷
D.石油裂化的目的是为了提高轻质油的产量
15.下列说法正确的是
A.多糖、蛋白质都是高分子化合物,一定条件下都能水解
B.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分开
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.尼龙绳、羊绒衫和棉衬衣等生活用品都是由合成纤维制造的
16.聚丙烯酸酯的结构简式可表示为,由丙烯酸酯加聚得到。下列关于聚丙烯酸酯的说法不正确的是
A.属于高分子化合物,是混合物
B.链节为—CH2—CH—
C.单体为CH2=CH—COOR
D.n为聚合度
二、非选择题:本题包括第17题~第20题4个大题,共52分。
17.(13分)迄今为止, 化石燃料仍是人类使用的主要能源, 同时也是重要的化工原料。
(1)化石燃料包括煤、石油和_______。化石燃料燃烧时容易引起的环境问题是_______、_______等, 解决这些问题是现今面临的重要挑战。
(2)请将对化石燃料进行综合利用的方法名称填入下表。
序号
原料
产品
方法
①
煤
煤气、煤焦油和焦炭
_________________
②
原油
汽油
_________________
③
重油
煤油
_________________
(3)由 辛 烷 可 制 得 一 系 列 产 品 : C8H8C4H8+X, 则X 是____________; X 在催化剂、加热、加压的条件下可生成乙烯和乙烷, 该反应的化学方程式是_______________。
(4)碳与水蒸气反应生成水煤气(CO和H2),反应的化学方程式是_________________;在此基础上,由水煤气可进一步合成甲醇( CH3OH),则合成甲醇所需的CO 和H2 的体积比是____________。
18.(11分)镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用_________。
(2)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为__________________。
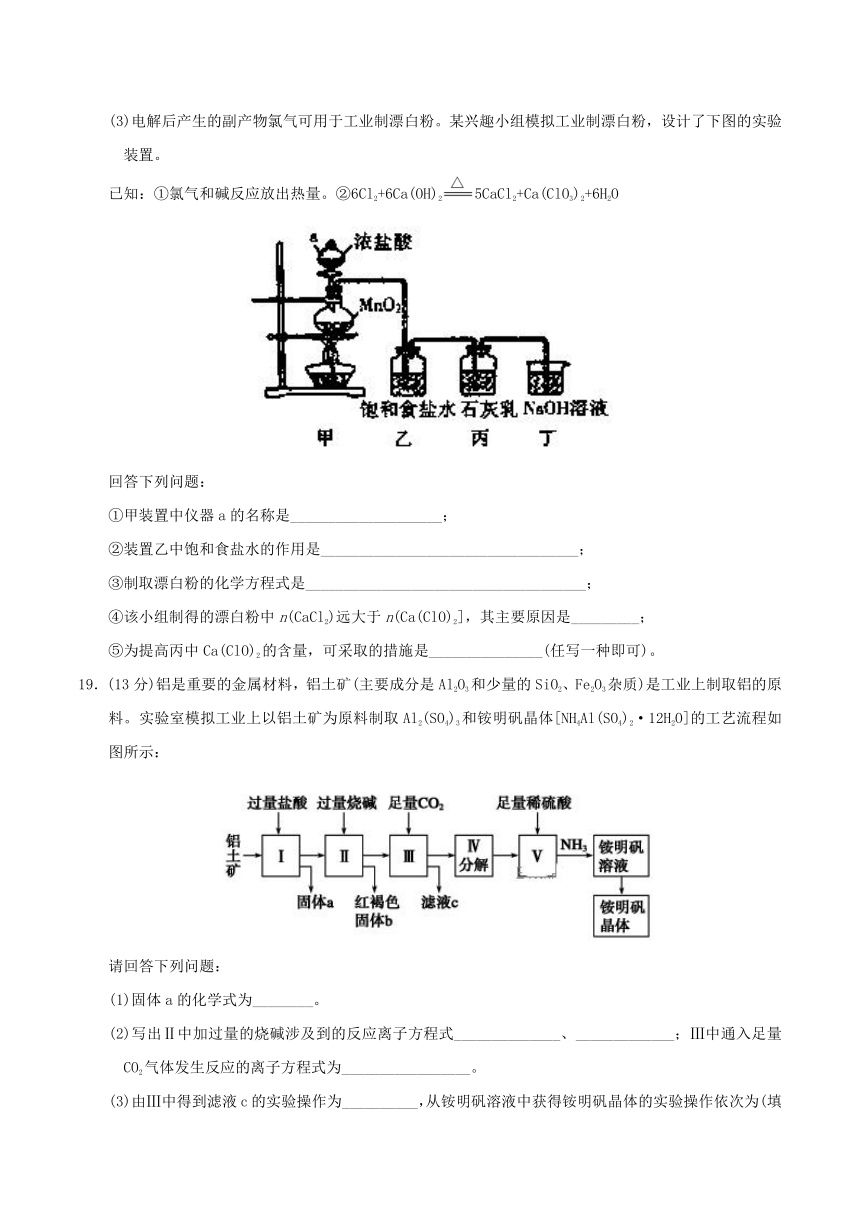
(3)电解后产生的副产物氯气可用于工业制漂白粉。某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。
已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O
回答下列问题:
①甲装置中仪器a的名称是____________________;
②装置乙中饱和食盐水的作用是__________________________________;
③制取漂白粉的化学方程式是_____________________________________;
④该小组制得的漂白粉中n(CaCl2)远大于n(Ca(ClO)2],其主要原因是_________;
⑤为提高丙中Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
19.(13分)铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
20.(15分)海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
(1)灼烧海带时需要用到的实验仪器是_____(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.蒸发皿 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①___________,③___________。
(3)过程②中充入适量Cl2的目的是________________________________,反应的离子方程式为_________________________________。
(4)操作③中所用的有机试剂可以是_____________________(只填一种)。
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
①上述G步操作的目的是_________________________________;
②最后碘的有机溶液是通过___________获得(填“漏斗上口”或“漏斗下口”)。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___________________。
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察下图所示实验装置,指出其错误之处并加以改正:_________________________________。
(8)进行上述蒸馏操作时,使用水浴的原因是________________,最后晶态碘在__________里聚集。
1.【答案】B
2.【答案】C
【解析】A.液氧煤油发动机排出的气体为二氧化碳和水,无毒无污染,故A正确;B.煤油的主要成分是烃,是由多种碳氢化合物组成的混合物,故B正确;C.箭体采用铝合金和碳/环氧复合材料的主要原因是铝合金和碳/环氧复合材料抗腐蚀性好,密度小,目的是减轻箭体的质量和和提高箭体的结构强度,故C错误;D.硅是半导体材料,常用作计算机芯片制作,故D正确;故选C。
3.【答案】A
【解析】海水中的含水量是96.5%,其余的为盐,其中氯化钠是含量最高的盐。答案选A。
4.【答案】A
【解析】A.通过催化重整,可从石油中获取环状烃,如芳香烃,A正确;B.熔融的氯化铝不导电,金属铝的冶炼可采取电解熔融氧化铝的方法,B错误;C.石油的裂化和裂解、煤的液化和气化均属于化学变化,C错误;D.煤干馏得到煤焦油中含有芳香烃,可用分馏的方法从煤焦油中获得芳香烃,但煤中不含有苯、甲苯、二甲苯等有机物,D错误;答案选A。
5.【答案】C
【解析】活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用热还原法冶炼,不活泼金属Hg、Ag利用热分解法冶炼,故A、B、D正确,C错误。
6.【答案】B
【解析】铝热反应用来冶炼金属性弱于铝的金属。Cr、Mn、Fe均可以通过铝热反应进行冶炼。Mg的金属性强于铝,不能通过铝热反应冶炼,可通过电解熔融的氯化镁原理,答案选B。
7.【答案】D
【解析】A、Na先与水反应生成NaOH和H2,NaOH再与FeSO4发生复分解反应生成Fe(OH)2沉淀,得不到Fe单质,相关的化学方程式为:2Na+2H2O===2NaOH+H2↑,2NaOH+FeSO4===Fe(OH)2↓+Na2SO4,A错误;B、3CO+ Fe2O32Fe+3CO2,该反应不是置换反应,属于氧化还原反应,B错误;C、H2与FeSO4溶液不反应,C错误;D、4Al+3Fe3O49Fe+2Al2O3是置换反应,D正确。正确答案为D。
8.【答案】C
9.【答案】A
【解析】A、为保证I完全被氧化,应通入稍过量Cl2,但如果Cl2过量较多,将会继续氧化I2,A错误;B、NaOH可以与海带中的I2发生发应:3I2+6OH?===5I?+IO3?+3H2O,使碘元素更多的转移入溶液中,提高碘的吸收率,B正确;C、加入硫酸使溶液呈酸性,使I?与IO3?在酸性下发生归中反应生成I2,C正确;D、碘单质易升华,提纯碘单质可以采取升华法,D正确。正确答案为A。
10.【答案】D
【解析】A.从海水中提取食盐可采用蒸发结晶的方法,故A正确;B.溴能够与碱性物质反应,因此从海水中提取溴时,需控制海水呈酸性,故B正确;C.饱和溴水中通入空气,溴被空气带出,使得溴水的浓度减小,故C正确;D.实验室用石灰石和浓盐酸反应制备CO2,会使得二氧化碳中混有氯化氢气体,应该使用稀盐酸,故D错误;故选D。
11.【答案】A
【解析】A项,流程中反应①为Cl2+2Br?===2Cl?+Br2,该反应属于置换反应,故A正确;B项,反应②为Br2+SO2+H2O===H2SO4+2HBr,故B错误;C项,反应Cl2+2Br?===2Cl?+Br2中氧化剂的氧化性>氧化产物的氧化性,所以氧化性:Cl2>Br2,故C错误;D项,乙醇与水互相溶解,无法将Br2从水溶液中萃取出来,故D错误。
12.【答案】B
【解析】A.应该先过滤出沉淀,再加盐酸,除去碳酸钠和氢氧化钠等物质,A.错误;B.溶解度大的盐变为溶解度小的盐,该反应能够发生,B正确;C.工业上加入熟石灰,成本低,C错误;D.利用溴的氧化性,而非挥发性,D错误;答案选B。
13.【答案】D
14.【答案】C
【解析】石油是多种烃的混合物,故A正确;石油分馏得到的汽油、煤油、柴油等仍是混合物,故B正确;石油裂解气的主要成分是乙烯、丙烯等,故C错误;石油裂化的目的是为了提高汽油等轻质油的产量,故D正确。
15.【答案】A
【解析】A.多糖属于天然高分子化合物,可水解成为很多单位单糖,蛋白质是生物体内重要的高分子化合物,在酶的作用下水解为氨基酸,A正确;B.煤中不含苯和甲苯,煤干馏后从煤焦油中能分离出来苯和甲苯,B错误;C.干馏一般是煤的干馏,将煤隔绝空气加强热使其分解的过程,又叫煤的焦化,有化学变化,C错误;D.羊绒衫的成分为蛋白质,尼龙绳是合成高分子纤维,棉衬衣原材料是天然高分子纤维,D错误。故选择A。
16.【答案】B
【解析】依据高分子化合物聚丙烯酸酯的结构简式可确定其链节为,单体为,n为聚合度,因n值不确定,高分子化合物均是混合物,A、C、D均正确,B不正确,答案选B。
17.【答案】(13分,除标明外,每空1分)
(1)天然气 温室效应 酸雨
(2)煤的干馏 石油的分馏 裂化
(3)C4H10 C4H10C2H4+C2H6(2分)
(4)C+H2OCO+H2(2分) 1∶2(2分)
【解析】(1)化石燃料包括煤、石油和天然气。化石燃料燃烧时容易引起的环境问题是温室效应、 酸雨等,解决这些问题是现今面临的重要挑战。
(2)①通过煤的干馏可以得到煤焦油等;②通过石油分馏得到汽油;③通过重油裂化可以得到煤油。
(3)根据原子守恒可知X的化学式是C4H10;X在催化剂、加热、加压的条件下可生成乙烯和乙烷,该反应的化学方程式是C4H10C2H4+C2H6。
(4)碳与水蒸气反应生成水煤气(CO和H2),反应的化学方程式是C+H2OCO+H2;在此基础上,由水煤气可进一步合成甲醇( CH3OH),反应的方程式为CO+2H2→CH3OH,则合成甲醇所需的CO和H2的体积比是1∶2。
18.【答案】(11分)
(1)NaOH溶液(1分)
(2)MgCl2(熔融)Mg+Cl2↑(2分)
(3)①分液漏斗(1分)
②除去氯气中混有的氯化氢(1分)
③2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(2分)
④氯气和碱反应会放出热量,导致温度升高,发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O(2分,其它合理答案也给分)
⑤将丙装置浸在盛有冷水的水槽中或控制氯气产生速率(2分,其它合理答案也给分)
19.【答案】(13分)
(1)SiO2(1分)
(2)Al3+ +4OH?===+2H2O(2分) Fe3+ + 3OH?===Fe(OH)3↓(2分)
+CO2+2H2O===+Al(OH)3↓(2分)
(3)过滤(1分) 蒸发浓缩(1分)
(4)碱(1分) 发酵粉(1分,合理即给分)
(5)3∶10(2分)
(1)根据上述分析,固体a为难溶于盐酸的二氧化硅,固体a的化学式为SiO2。
(2)Ⅱ中加入过量的烧碱涉及到的反应离子方程式为Al3++4OH?===+2H2O、Fe3++3OH?===Fe(OH)3↓。Ⅲ中通入足量CO2气体发生反应的化学方程式为CO2+NaAlO2+2H2O===Al(OH)3↓+NaHCO3,离子方程式为CO2++2H2O===Al(OH)3↓+。
(3)Ⅲ中反应得到难溶于水的Al(OH)3和NaHCO3溶液,得到滤液c的实验操作为过滤。从铵明矾溶液中获得NH4Al(SO4)2·12H2O的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤。
(4)滤液c为NaHCO3溶液,NaHCO3溶液呈碱性。日常生活中常用NaHCO3作发酵粉等。
(5)铵明矾与硫酸铝物质的量之比为1∶1,则n(Al3+)∶n()=3∶5,Al3+全部来自铝土矿中的Al2O3,全部来自H2SO4,根据Al和守恒,投料时铝土矿中的Al2O3和H2SO4物质的量之比为∶5=3∶10。
20.【答案】(15分)
(1)BDE(2分)
(2)过滤(1分) 萃取(1分)
(3)使I?转化为I2(1分) 2I?+Cl2===2Cl?+I2(2分)
(4)CCl4(1分)
(5)①平衡压力便于液体流出(1分) ②漏斗下口(1分)
(6)取提取碘后的水溶液于试管中,加入淀粉溶液,不变蓝,说明没有I2剩余(1分)
(7)没有用石棉网,温度计应该插到支管口略靠下位置,冷却水方向应该是下进上出(2分)
(8)控制温度,使蒸馏烧瓶内液体受热均匀(1分) 蒸馏烧瓶(1分)
②四氯化碳密度比水大,应从分液漏斗下口流出。
(6)碘单质遇淀粉变蓝色,则检验提取碘后的水溶液中是否还含有单质碘的简单方法是:取提取碘后的水溶液于试管中,加入淀粉溶液,不变蓝,说明没有碘单质剩余。
(7)由图可知,该装置的错误主要有:温度计水银球位置错误,温度计水银球应与蒸馏烧瓶支管口相平或略靠下位置;冷却水水流方向错误,冷却水方向应该是下进上出;烧杯加热时应垫上石棉网。
(8)进行蒸馏操作时,使用水浴加热便于控制温度,同时还能使蒸馏烧瓶内液体受热均匀;四氯化碳沸点低于碘单质沸点,所以最后晶态碘在蒸馏烧瓶里聚集。
章末检测
(时间:70分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 S 32
一、选择题:本题包括16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,主要是为了防止白色污染和节约资源
2.2017年11月21日,长征六号运载火箭将三颗视频卫星成功送入太空轨道,火箭的动力系统采用的是新一代大推力液氧煤油发动机。下列说法错误的是
A.液氧煤油发动机排出的气体无毒无污染
B.煤油是由多种碳氢化合物组成的混合物
C.箭体采用铝合金和碳/环氧复合材料是为了美观
D.卫星上的计算机芯片使用的是高纯单质硅
3.海洋是资源丰富的宝藏,据探测,海洋中含盐3%。海水中含量最多的盐是
A.NaCl B.MgCl2 C.Na2SO4 D.NaBr
4.下列有关自然资源的开发利用的叙述正确的是
A.通过催化重整,可从石油中获取环状烃
B.金属铝的冶炼可采取电解熔融氯化铝的方法
C.石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化
D.煤中含有的苯、甲苯、二甲苯等有机物,可通过煤的干馏来获得
5.下表中金属的冶炼原理与方法不完全正确的是
选项
冶炼原理
方法
A
2HgO2Hg+O2↑
热分解法
B
2Al2O3(熔融) 4Al+3O2↑
电解法
C
Cu2S+O22Cu+SO2
热分解法
D
Fe2O3+2Al2Fe+Al2O3
热还原法
6.不能用铝热反应制备的金属是
A.Cr B.Mg C.Mn D.Fe
7.能通过置换反应得到金属铁的是
A.Na与FeSO4溶液常温混合
B.CO通过灼热的Fe2O3
C.H2通入FeSO4溶液
D.Al和Fe3O4混合加热至高温
8.下列有关物质制备的说法正确的是
A.电解饱和食盐水可以得到金属钠、氢气和氯气
B.工业上将氯气通入澄清石灰水中制取漂白粉
C.用焦炭在高温下还原二氧化硅可得到粗硅
D.高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
9.从海带中提取碘的工业生产过程如下:
下列说法不正确的是
A.为保证I完全被氧化,应通入过量很多的Cl2
B.试剂R可以为NaOH溶液
C.H2SO4溶液作用之一是使滤液酸化
D.提纯晶体碘采用升华法
10.下列说法错误的是
A.从海水中提取食盐可采用结晶的方法
B.从海水中提取溴时,需控制海水呈酸性
C.饱和溴水中通入空气,溴水的浓度减小
D.实验室用石灰石和浓盐酸反应制备CO2
11.由海水提取溴的反应流程如下,下列说法正确的是
NaBrBr2HBrBr2
A.反应①为置换反应 B.反应②中生成S和HBr
C.氧化性:Cl2<Br2 D.反应③生成的Br2可以用乙醇萃取
12.海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是
A.步骤①中,除去粗盐中的、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B.步骤②中反应利用的原理:相同条件下NaHCO3的溶解度比NaCl小
C.步骤③在工业上通过向母液中加NaOH固体实现
D.步骤④利用了Br2的挥发性、还原性,该步的作用是富集
13.食品保鲜膜的材质有聚乙烯(PE)、聚氯乙烯(PVC)等种类。下列叙述错误的是
A.等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等
B.废弃的PE和PVC均可回收利用以减少白色污染
C.将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红
D.PVC的单体可由PE的单体与氯化氢加成制得
14.关于石油和石油化工的说法错误的是
A.石油的主要成分是碳氢化合物
B.石油分馏得到的各馏分仍是混合物
C.石油裂解气的主要成分是甲烷
D.石油裂化的目的是为了提高轻质油的产量
15.下列说法正确的是
A.多糖、蛋白质都是高分子化合物,一定条件下都能水解
B.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分开
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.尼龙绳、羊绒衫和棉衬衣等生活用品都是由合成纤维制造的
16.聚丙烯酸酯的结构简式可表示为,由丙烯酸酯加聚得到。下列关于聚丙烯酸酯的说法不正确的是
A.属于高分子化合物,是混合物
B.链节为—CH2—CH—
C.单体为CH2=CH—COOR
D.n为聚合度
二、非选择题:本题包括第17题~第20题4个大题,共52分。
17.(13分)迄今为止, 化石燃料仍是人类使用的主要能源, 同时也是重要的化工原料。
(1)化石燃料包括煤、石油和_______。化石燃料燃烧时容易引起的环境问题是_______、_______等, 解决这些问题是现今面临的重要挑战。
(2)请将对化石燃料进行综合利用的方法名称填入下表。
序号
原料
产品
方法
①
煤
煤气、煤焦油和焦炭
_________________
②
原油
汽油
_________________
③
重油
煤油
_________________
(3)由 辛 烷 可 制 得 一 系 列 产 品 : C8H8C4H8+X, 则X 是____________; X 在催化剂、加热、加压的条件下可生成乙烯和乙烷, 该反应的化学方程式是_______________。
(4)碳与水蒸气反应生成水煤气(CO和H2),反应的化学方程式是_________________;在此基础上,由水煤气可进一步合成甲醇( CH3OH),则合成甲醇所需的CO 和H2 的体积比是____________。
18.(11分)镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用_________。
(2)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为__________________。
(3)电解后产生的副产物氯气可用于工业制漂白粉。某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。
已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O
回答下列问题:
①甲装置中仪器a的名称是____________________;
②装置乙中饱和食盐水的作用是__________________________________;
③制取漂白粉的化学方程式是_____________________________________;
④该小组制得的漂白粉中n(CaCl2)远大于n(Ca(ClO)2],其主要原因是_________;
⑤为提高丙中Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
19.(13分)铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
20.(15分)海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
(1)灼烧海带时需要用到的实验仪器是_____(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.蒸发皿 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①___________,③___________。
(3)过程②中充入适量Cl2的目的是________________________________,反应的离子方程式为_________________________________。
(4)操作③中所用的有机试剂可以是_____________________(只填一种)。
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
①上述G步操作的目的是_________________________________;
②最后碘的有机溶液是通过___________获得(填“漏斗上口”或“漏斗下口”)。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___________________。
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察下图所示实验装置,指出其错误之处并加以改正:_________________________________。
(8)进行上述蒸馏操作时,使用水浴的原因是________________,最后晶态碘在__________里聚集。
1.【答案】B
2.【答案】C
【解析】A.液氧煤油发动机排出的气体为二氧化碳和水,无毒无污染,故A正确;B.煤油的主要成分是烃,是由多种碳氢化合物组成的混合物,故B正确;C.箭体采用铝合金和碳/环氧复合材料的主要原因是铝合金和碳/环氧复合材料抗腐蚀性好,密度小,目的是减轻箭体的质量和和提高箭体的结构强度,故C错误;D.硅是半导体材料,常用作计算机芯片制作,故D正确;故选C。
3.【答案】A
【解析】海水中的含水量是96.5%,其余的为盐,其中氯化钠是含量最高的盐。答案选A。
4.【答案】A
【解析】A.通过催化重整,可从石油中获取环状烃,如芳香烃,A正确;B.熔融的氯化铝不导电,金属铝的冶炼可采取电解熔融氧化铝的方法,B错误;C.石油的裂化和裂解、煤的液化和气化均属于化学变化,C错误;D.煤干馏得到煤焦油中含有芳香烃,可用分馏的方法从煤焦油中获得芳香烃,但煤中不含有苯、甲苯、二甲苯等有机物,D错误;答案选A。
5.【答案】C
【解析】活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用热还原法冶炼,不活泼金属Hg、Ag利用热分解法冶炼,故A、B、D正确,C错误。
6.【答案】B
【解析】铝热反应用来冶炼金属性弱于铝的金属。Cr、Mn、Fe均可以通过铝热反应进行冶炼。Mg的金属性强于铝,不能通过铝热反应冶炼,可通过电解熔融的氯化镁原理,答案选B。
7.【答案】D
【解析】A、Na先与水反应生成NaOH和H2,NaOH再与FeSO4发生复分解反应生成Fe(OH)2沉淀,得不到Fe单质,相关的化学方程式为:2Na+2H2O===2NaOH+H2↑,2NaOH+FeSO4===Fe(OH)2↓+Na2SO4,A错误;B、3CO+ Fe2O32Fe+3CO2,该反应不是置换反应,属于氧化还原反应,B错误;C、H2与FeSO4溶液不反应,C错误;D、4Al+3Fe3O49Fe+2Al2O3是置换反应,D正确。正确答案为D。
8.【答案】C
9.【答案】A
【解析】A、为保证I完全被氧化,应通入稍过量Cl2,但如果Cl2过量较多,将会继续氧化I2,A错误;B、NaOH可以与海带中的I2发生发应:3I2+6OH?===5I?+IO3?+3H2O,使碘元素更多的转移入溶液中,提高碘的吸收率,B正确;C、加入硫酸使溶液呈酸性,使I?与IO3?在酸性下发生归中反应生成I2,C正确;D、碘单质易升华,提纯碘单质可以采取升华法,D正确。正确答案为A。
10.【答案】D
【解析】A.从海水中提取食盐可采用蒸发结晶的方法,故A正确;B.溴能够与碱性物质反应,因此从海水中提取溴时,需控制海水呈酸性,故B正确;C.饱和溴水中通入空气,溴被空气带出,使得溴水的浓度减小,故C正确;D.实验室用石灰石和浓盐酸反应制备CO2,会使得二氧化碳中混有氯化氢气体,应该使用稀盐酸,故D错误;故选D。
11.【答案】A
【解析】A项,流程中反应①为Cl2+2Br?===2Cl?+Br2,该反应属于置换反应,故A正确;B项,反应②为Br2+SO2+H2O===H2SO4+2HBr,故B错误;C项,反应Cl2+2Br?===2Cl?+Br2中氧化剂的氧化性>氧化产物的氧化性,所以氧化性:Cl2>Br2,故C错误;D项,乙醇与水互相溶解,无法将Br2从水溶液中萃取出来,故D错误。
12.【答案】B
【解析】A.应该先过滤出沉淀,再加盐酸,除去碳酸钠和氢氧化钠等物质,A.错误;B.溶解度大的盐变为溶解度小的盐,该反应能够发生,B正确;C.工业上加入熟石灰,成本低,C错误;D.利用溴的氧化性,而非挥发性,D错误;答案选B。
13.【答案】D
14.【答案】C
【解析】石油是多种烃的混合物,故A正确;石油分馏得到的汽油、煤油、柴油等仍是混合物,故B正确;石油裂解气的主要成分是乙烯、丙烯等,故C错误;石油裂化的目的是为了提高汽油等轻质油的产量,故D正确。
15.【答案】A
【解析】A.多糖属于天然高分子化合物,可水解成为很多单位单糖,蛋白质是生物体内重要的高分子化合物,在酶的作用下水解为氨基酸,A正确;B.煤中不含苯和甲苯,煤干馏后从煤焦油中能分离出来苯和甲苯,B错误;C.干馏一般是煤的干馏,将煤隔绝空气加强热使其分解的过程,又叫煤的焦化,有化学变化,C错误;D.羊绒衫的成分为蛋白质,尼龙绳是合成高分子纤维,棉衬衣原材料是天然高分子纤维,D错误。故选择A。
16.【答案】B
【解析】依据高分子化合物聚丙烯酸酯的结构简式可确定其链节为,单体为,n为聚合度,因n值不确定,高分子化合物均是混合物,A、C、D均正确,B不正确,答案选B。
17.【答案】(13分,除标明外,每空1分)
(1)天然气 温室效应 酸雨
(2)煤的干馏 石油的分馏 裂化
(3)C4H10 C4H10C2H4+C2H6(2分)
(4)C+H2OCO+H2(2分) 1∶2(2分)
【解析】(1)化石燃料包括煤、石油和天然气。化石燃料燃烧时容易引起的环境问题是温室效应、 酸雨等,解决这些问题是现今面临的重要挑战。
(2)①通过煤的干馏可以得到煤焦油等;②通过石油分馏得到汽油;③通过重油裂化可以得到煤油。
(3)根据原子守恒可知X的化学式是C4H10;X在催化剂、加热、加压的条件下可生成乙烯和乙烷,该反应的化学方程式是C4H10C2H4+C2H6。
(4)碳与水蒸气反应生成水煤气(CO和H2),反应的化学方程式是C+H2OCO+H2;在此基础上,由水煤气可进一步合成甲醇( CH3OH),反应的方程式为CO+2H2→CH3OH,则合成甲醇所需的CO和H2的体积比是1∶2。
18.【答案】(11分)
(1)NaOH溶液(1分)
(2)MgCl2(熔融)Mg+Cl2↑(2分)
(3)①分液漏斗(1分)
②除去氯气中混有的氯化氢(1分)
③2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(2分)
④氯气和碱反应会放出热量,导致温度升高,发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O(2分,其它合理答案也给分)
⑤将丙装置浸在盛有冷水的水槽中或控制氯气产生速率(2分,其它合理答案也给分)
19.【答案】(13分)
(1)SiO2(1分)
(2)Al3+ +4OH?===+2H2O(2分) Fe3+ + 3OH?===Fe(OH)3↓(2分)
+CO2+2H2O===+Al(OH)3↓(2分)
(3)过滤(1分) 蒸发浓缩(1分)
(4)碱(1分) 发酵粉(1分,合理即给分)
(5)3∶10(2分)
(1)根据上述分析,固体a为难溶于盐酸的二氧化硅,固体a的化学式为SiO2。
(2)Ⅱ中加入过量的烧碱涉及到的反应离子方程式为Al3++4OH?===+2H2O、Fe3++3OH?===Fe(OH)3↓。Ⅲ中通入足量CO2气体发生反应的化学方程式为CO2+NaAlO2+2H2O===Al(OH)3↓+NaHCO3,离子方程式为CO2++2H2O===Al(OH)3↓+。
(3)Ⅲ中反应得到难溶于水的Al(OH)3和NaHCO3溶液,得到滤液c的实验操作为过滤。从铵明矾溶液中获得NH4Al(SO4)2·12H2O的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤。
(4)滤液c为NaHCO3溶液,NaHCO3溶液呈碱性。日常生活中常用NaHCO3作发酵粉等。
(5)铵明矾与硫酸铝物质的量之比为1∶1,则n(Al3+)∶n()=3∶5,Al3+全部来自铝土矿中的Al2O3,全部来自H2SO4,根据Al和守恒,投料时铝土矿中的Al2O3和H2SO4物质的量之比为∶5=3∶10。
20.【答案】(15分)
(1)BDE(2分)
(2)过滤(1分) 萃取(1分)
(3)使I?转化为I2(1分) 2I?+Cl2===2Cl?+I2(2分)
(4)CCl4(1分)
(5)①平衡压力便于液体流出(1分) ②漏斗下口(1分)
(6)取提取碘后的水溶液于试管中,加入淀粉溶液,不变蓝,说明没有I2剩余(1分)
(7)没有用石棉网,温度计应该插到支管口略靠下位置,冷却水方向应该是下进上出(2分)
(8)控制温度,使蒸馏烧瓶内液体受热均匀(1分) 蒸馏烧瓶(1分)
②四氯化碳密度比水大,应从分液漏斗下口流出。
(6)碘单质遇淀粉变蓝色,则检验提取碘后的水溶液中是否还含有单质碘的简单方法是:取提取碘后的水溶液于试管中,加入淀粉溶液,不变蓝,说明没有碘单质剩余。
(7)由图可知,该装置的错误主要有:温度计水银球位置错误,温度计水银球应与蒸馏烧瓶支管口相平或略靠下位置;冷却水水流方向错误,冷却水方向应该是下进上出;烧杯加热时应垫上石棉网。
(8)进行蒸馏操作时,使用水浴加热便于控制温度,同时还能使蒸馏烧瓶内液体受热均匀;四氯化碳沸点低于碘单质沸点,所以最后晶态碘在蒸馏烧瓶里聚集。
