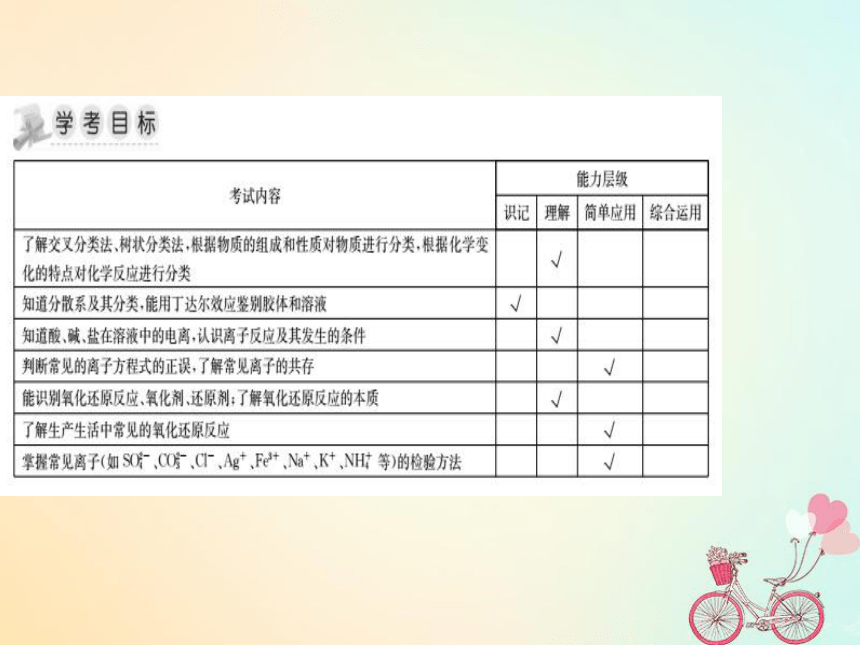
湖南省茶陵县高中化学第二章化学物质及其变化学考复习课件1新人教版必修1
文档属性
| 名称 | 湖南省茶陵县高中化学第二章化学物质及其变化学考复习课件1新人教版必修1 |

|
|
| 格式 | zip | ||
| 文件大小 | 344.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-06-22 00:00:00 | ||
图片预览





文档简介
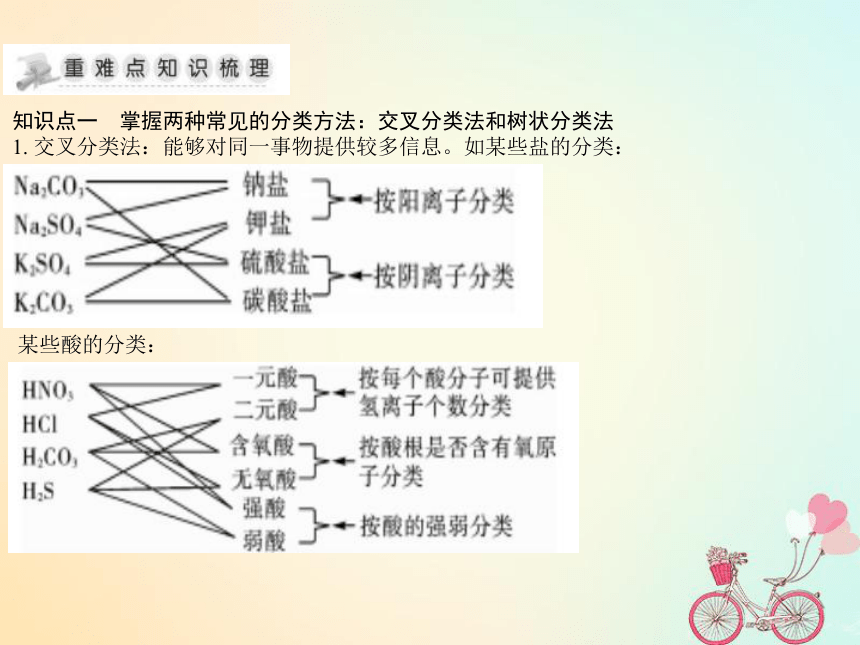
课件19张PPT。第二章 化学物质及其变化知识点一 掌握两种常见的分类方法:交叉分类法和树状分类法
1. 交叉分类法:能够对同一事物提供较多信息。如某些盐的分类:某些酸的分类:2.树状分类法:能反映出各事物的关系。把下列无序排列的物质进行分类:Fe、N2、NaCl溶液、CaO、H2O、Ag、S、Ca(OH)2、H2SO4、CaCO3、NH3·H2O、CH3COOH、漂白粉、KHCO3。知识点二 化学反应的分类
1. 根据反应物和生成物的类别以及反应前后物质种类的多少可以分为化合反应、分解反应、置换反应、复分解反应四大基本反应类型,其结构特点如下:
化合反应为“合多为一”;
分解反应为“一分为多”;
置换反应为“一单换一单”;
复分解反应为“相互交换成分”。
2. 根据反应中是否有离子参与可以划分为离子反应和非离子反应。
3. 根据反应中是否有电子转移可以划分为氧化还原反应和非氧化还原反应。
4. 根据反应进行的程度可以分为可逆反应和不可逆反应。
5. 根据反应的热效应可以分为吸热反应和放热反应。
(1)常见的吸热反应:Ba(OH)2·8H2O与NH4Cl的反应、氢气(木炭)还原氧化铜的反应、氯酸钾的分解反应、大部分的分解反应等。
(2)常见的放热反应:燃烧、酸碱中和反应、活泼金属与酸的反应、铝热反应、CaO与H2O的反应、大部分的化合反应等。知识点三 分散系及其分类
1. 分散系组成:分散剂和分散质。按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
2. 当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。知识点四 胶体
1. 常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉液、墨水等。
2. 胶体的特性:能产生丁达尔效应。区别胶体与其他分散系常用方法:丁达尔效应。胶体与其他分散系的本质区别是胶体粒子的直径大小。与胶体性质有关的现象或应用:明矾净水、用石膏或盐卤使豆浆变豆腐、制造涂料和墨水、制备纳米材料、入海口三角洲的形成等。知识点五 电解质和非电解质
1. 概念
(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质。)(1)电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质。
(2)酸、碱、盐和水都是电解质。
(3)能导电的物质不一定是电解质。能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
(4)电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
2. 溶液能够导电的原因:有能够自由移动的离子。
3. 电离方程式:要注意配平,原子个数守恒,电荷数守恒。
例如:Al2(SO4)3===2Al3++3SO2-4
HCl===H++Cl-
NaOH===Na++OH-
从电离角度看,电离时生成的阳离子全部是氢离子的化合物叫做酸;电离时生成的阴离子全部是氢氧根离子的化合物叫做碱;盐电离产生金属阳离子[或铵根离子(NH+4)]和酸根阴离子。知识点六 离子反应
1. 离子反应发生的条件:
(1) 复分解型离子反应发生条件:生成沉淀、生成气体、生成难电离的物质(如水、弱酸、弱碱)。
(2) 氧化还原型离子反应发生的条件:离子的价态发生的变化(如Fe放入FeCl3溶液中发生反应的离子方程式为Fe+2Fe3+3Fe2+)。
2. 离子方程式的书写(写、拆、删、查):
(1) 写:写出正确的化学方程式(要注意配平)。
(2) 拆:把易溶于水、易电离的物质写成离子形式。常见易溶于水、易电离的物质:三大强酸(H2SO4、HCl、HNO3),三大强碱[NaOH、KOH、Ba(OH)2],可溶性盐。这些物质拆成离子形式,其他物质一律保留化学式。
(3) 删:删除不参加反应的离子(价态不变和存在形式不变的离子)。
(4) 查:检查离子方程式等号两边是否原子个数守恒、电荷数守恒。
3. 离子方程式正误判断:
(1) 看是否符合反应事实(能不能发生反应,反应物、生成物对不对)。
(2) 看是否可拆。
(3) 看是否配平(原子个数守恒,电荷数守恒)。
(4) 看“===”“△”“↑”“↓”是否应用恰当知识点七 离子共存问题
1. 能发生复分解反应(生成沉淀或气体或水或难电离的物质)的离子不能大量共存。
(1)生成的沉淀:AgCl、BaSO4、BaCO3、CaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2等。
(2)生成气体:CO2-3、HCO-3、SO2-3、HSO-3、S2-等易挥发的弱酸的酸根与H+不能大量共存。
(3)生成难电离物:
① H+和OH-生成H2O。
② CH3COO-和H+生成CH3COOH(弱酸)、H+和ClO-生成HClO(弱酸)、NH+4和OH-生成NH3·H2O(弱碱)等。
③ 酸式酸根离子,如HCO-3、HSO-3等既不能和H+大量共存,也不能和OH-大量共存。如:HCO-3+H+H2O+CO2↑,HCO-3+OH-===H2O+CO2-3。
2. 审题时应注意题中给出的附加条件。
(1)无色溶液中不存在有色离子:Cu2+、Fe3+、Fe2+、MnO-4(常见的四种有色离子)。
(2)注意挖掘某些隐含离子:酸性溶液(或pH<7)中隐含有较多H+,碱性溶液(或pH>7)中隐含有较多OH-。
注意题目要求“大量共存”还是“不能大量共存”。知识点八 氧化还原反应
1. 氧化还原反应的本质:反应中有电子转移(包括电子的得失或偏移)。
2. 氧化还原反应的特征:化学反应前后有元素化合价发生变化。
3. 判断氧化还原反应的依据:凡是有元素化合价升降或有电子转移的化学反应都属于氧化还原反应。
4. 氧化还原反应的相关概念:还原剂(具有还原性):升(化合价升高)→失(失电子)→氧化(被氧化或发生氧化反应)→生成氧化产物。
“升、失、氧化、还原剂”
氧化剂(具有氧化性):降(化合物降低)→得(得电子)→还原(被还原或发生还原反应)→生成还原产物。
“降、得、还原、氧化剂”
注:一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找。1. 氧化还原反应中电子转移的表示方法。
(1)双线桥法——表示电子得失结果
例:
(2)单线桥法——表示电子转移情况
例:重点:
① 单箭号(在反应物之间);
② 箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素;
③ 只标转移电子总数,不标得与失(氧化剂得电子总数等于还原剂失电子总数)。6.氧化还原反应与四种基本反应类型的关系。7. 常见的氧化剂与还原剂。
(1)常见的氧化剂
① 活泼的非金属单质:O2、Cl2、Br2;
② 含高价金属阳离子的化合物:FeCl3;
③ 含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2、Na2O2、H2O2、HClO、NaClO、Ca(ClO)2。
(2)常见的还原剂
①活泼或较活泼的金属:K、Ca、Na、Mg、Al、Zn(按金属活动性顺序,还原性递减);
②含低价金属阳离子的化合物:Fe2+;
③某些非金属单质:C、H2;
④含有较低化合价元素的化合物:HCl、H2S、HI、KI、CO。一、题型导向
【例1】(2017年湖南省学业水平考试真题)下列物质中,属于钾盐的()
A.K B.K2O C.KOH D.K2SO4【答案】D【例2】(2016年湖南省学业水平考试真题)医用酒精是常用的消毒剂,它属于()
A.纯净物 B.混合物 C.酸 D.碱【答案】B【例3】(2015年湖南省学业水平考试真题)碳酸钠(Na2CO3)俗名苏打,属于()
A.酸 B .碱 C.盐 D.氧化物【答案】C【例4】(2017年湖南省学业水平考试真题)下列分散系中,分散质粒子大小在1~100 nm之间的是()
A.泥水 B.油水 C.Fe(OH)3胶体 D.CuSO4溶液【答案】C【例5】(2016年湖南省学业水平考试真题)下列应用中,与胶体性质有关的是()
A.漂白粉消毒 B.食盐调味 C.明矾净水 D.海水晒盐
【例6】(2015年湖南省学业水平考试真题)用红色激光照射下列物质,能观察到丁达尔效应的是()
A.乙醇溶液 B.氢氧化铁胶体 C.硫酸铜溶液 D.蔗糖溶液
【例7】(2017年湖南省学业水平考试真题)下列各组离子能在溶液中大量共存的是()
A. Ag+、Cl- B.Ca2+、CO2-3 C.H+、HCO-3 D.K+、NO-3
【例8】(2016年湖南省学业水平考试真题)下列各组中的离子,能在溶液中大量共存的是()
A.Ag+、Cl- B.H+、CO2-3 C.Na+、NO-3 D.Cu2+、OH-【答案】C【答案】B【答案】D【答案】C【例9】(2015年湖南省学业水平考试真题)下列离子在含有0?1 mol/L SO2-4的溶液中不能大量存在的是()
A.Al3+ B.Cu2+ C.Fe3+ D.Ba2+
【例10】(2017年湖南省学业水平考试真题)下列离子方程式中,正确的是()
A. 稀盐酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀盐酸滴在石灰石上:2H++CO2-3===H2O+CO2↑
C. 稀盐酸滴入氢氧化钾溶液中:H++OH-===H2O
D. 铁片插入硫酸铜溶液中:Fe+Cu2+===Fe3++Cu
【例11】(2016年湖南省学业水平考试真题)下列离子方程式中,正确的是()
A. 铁粉溶于稀硫酸:Fe+6H+===Fe3++3H2↑
B.氯化铁溶液腐蚀铜片:Cu+Fe3+===Fe2++Cu2+
C.钠与水的反应:Na+H2O===Na++OH-+H2↑
D.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O【答案】D【答案】C【答案】D【例12】(2015年湖南省学业水平考试真题)下列离子方程式中,正确的是()
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.铁与氯化铁溶液反应:Fe+Fe3+===2Fe2+
C.盐酸和氢氧化钡溶液反应:H++OH-===H2O
D.碳酸钙和稀盐酸反应:CO2-3+2H+===CO2↑+H2O
【例13】(2016年湖南省学业水平考试真题)煤气化时的主要反应为C(s)+H2O(g)一定条件CO(g)+H2(g)。关于该反应的叙述错误的是()
A. C的化合价升高
B.属于氧化还原反应
C.属于置换反应
D.H2O作还原剂
【答案】C【答案】D二、考情预测
了解分类法对于化学研究和化学学习的重要作用,知道胶体是一种常见的分散系,了解胶体在日常生活中的应用,能正确判断离子之间是否能共存,能正确书写常见的离子方程式,能识别氧化还原反应、氧化剂、还原剂,能结合生产生活实际举例说明常见的氧化还原反应。从近几年看,分类法、胶体的鉴别、离子共存、离子方程式书写、氧化还原反应判断及其概念是学业水平考试的必考点,要求较低,很常规。
1. 交叉分类法:能够对同一事物提供较多信息。如某些盐的分类:某些酸的分类:2.树状分类法:能反映出各事物的关系。把下列无序排列的物质进行分类:Fe、N2、NaCl溶液、CaO、H2O、Ag、S、Ca(OH)2、H2SO4、CaCO3、NH3·H2O、CH3COOH、漂白粉、KHCO3。知识点二 化学反应的分类
1. 根据反应物和生成物的类别以及反应前后物质种类的多少可以分为化合反应、分解反应、置换反应、复分解反应四大基本反应类型,其结构特点如下:
化合反应为“合多为一”;
分解反应为“一分为多”;
置换反应为“一单换一单”;
复分解反应为“相互交换成分”。
2. 根据反应中是否有离子参与可以划分为离子反应和非离子反应。
3. 根据反应中是否有电子转移可以划分为氧化还原反应和非氧化还原反应。
4. 根据反应进行的程度可以分为可逆反应和不可逆反应。
5. 根据反应的热效应可以分为吸热反应和放热反应。
(1)常见的吸热反应:Ba(OH)2·8H2O与NH4Cl的反应、氢气(木炭)还原氧化铜的反应、氯酸钾的分解反应、大部分的分解反应等。
(2)常见的放热反应:燃烧、酸碱中和反应、活泼金属与酸的反应、铝热反应、CaO与H2O的反应、大部分的化合反应等。知识点三 分散系及其分类
1. 分散系组成:分散剂和分散质。按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
2. 当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。知识点四 胶体
1. 常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉液、墨水等。
2. 胶体的特性:能产生丁达尔效应。区别胶体与其他分散系常用方法:丁达尔效应。胶体与其他分散系的本质区别是胶体粒子的直径大小。与胶体性质有关的现象或应用:明矾净水、用石膏或盐卤使豆浆变豆腐、制造涂料和墨水、制备纳米材料、入海口三角洲的形成等。知识点五 电解质和非电解质
1. 概念
(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质。)(1)电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质。
(2)酸、碱、盐和水都是电解质。
(3)能导电的物质不一定是电解质。能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
(4)电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
2. 溶液能够导电的原因:有能够自由移动的离子。
3. 电离方程式:要注意配平,原子个数守恒,电荷数守恒。
例如:Al2(SO4)3===2Al3++3SO2-4
HCl===H++Cl-
NaOH===Na++OH-
从电离角度看,电离时生成的阳离子全部是氢离子的化合物叫做酸;电离时生成的阴离子全部是氢氧根离子的化合物叫做碱;盐电离产生金属阳离子[或铵根离子(NH+4)]和酸根阴离子。知识点六 离子反应
1. 离子反应发生的条件:
(1) 复分解型离子反应发生条件:生成沉淀、生成气体、生成难电离的物质(如水、弱酸、弱碱)。
(2) 氧化还原型离子反应发生的条件:离子的价态发生的变化(如Fe放入FeCl3溶液中发生反应的离子方程式为Fe+2Fe3+3Fe2+)。
2. 离子方程式的书写(写、拆、删、查):
(1) 写:写出正确的化学方程式(要注意配平)。
(2) 拆:把易溶于水、易电离的物质写成离子形式。常见易溶于水、易电离的物质:三大强酸(H2SO4、HCl、HNO3),三大强碱[NaOH、KOH、Ba(OH)2],可溶性盐。这些物质拆成离子形式,其他物质一律保留化学式。
(3) 删:删除不参加反应的离子(价态不变和存在形式不变的离子)。
(4) 查:检查离子方程式等号两边是否原子个数守恒、电荷数守恒。
3. 离子方程式正误判断:
(1) 看是否符合反应事实(能不能发生反应,反应物、生成物对不对)。
(2) 看是否可拆。
(3) 看是否配平(原子个数守恒,电荷数守恒)。
(4) 看“===”“△”“↑”“↓”是否应用恰当知识点七 离子共存问题
1. 能发生复分解反应(生成沉淀或气体或水或难电离的物质)的离子不能大量共存。
(1)生成的沉淀:AgCl、BaSO4、BaCO3、CaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2等。
(2)生成气体:CO2-3、HCO-3、SO2-3、HSO-3、S2-等易挥发的弱酸的酸根与H+不能大量共存。
(3)生成难电离物:
① H+和OH-生成H2O。
② CH3COO-和H+生成CH3COOH(弱酸)、H+和ClO-生成HClO(弱酸)、NH+4和OH-生成NH3·H2O(弱碱)等。
③ 酸式酸根离子,如HCO-3、HSO-3等既不能和H+大量共存,也不能和OH-大量共存。如:HCO-3+H+H2O+CO2↑,HCO-3+OH-===H2O+CO2-3。
2. 审题时应注意题中给出的附加条件。
(1)无色溶液中不存在有色离子:Cu2+、Fe3+、Fe2+、MnO-4(常见的四种有色离子)。
(2)注意挖掘某些隐含离子:酸性溶液(或pH<7)中隐含有较多H+,碱性溶液(或pH>7)中隐含有较多OH-。
注意题目要求“大量共存”还是“不能大量共存”。知识点八 氧化还原反应
1. 氧化还原反应的本质:反应中有电子转移(包括电子的得失或偏移)。
2. 氧化还原反应的特征:化学反应前后有元素化合价发生变化。
3. 判断氧化还原反应的依据:凡是有元素化合价升降或有电子转移的化学反应都属于氧化还原反应。
4. 氧化还原反应的相关概念:还原剂(具有还原性):升(化合价升高)→失(失电子)→氧化(被氧化或发生氧化反应)→生成氧化产物。
“升、失、氧化、还原剂”
氧化剂(具有氧化性):降(化合物降低)→得(得电子)→还原(被还原或发生还原反应)→生成还原产物。
“降、得、还原、氧化剂”
注:一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找。1. 氧化还原反应中电子转移的表示方法。
(1)双线桥法——表示电子得失结果
例:
(2)单线桥法——表示电子转移情况
例:重点:
① 单箭号(在反应物之间);
② 箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素;
③ 只标转移电子总数,不标得与失(氧化剂得电子总数等于还原剂失电子总数)。6.氧化还原反应与四种基本反应类型的关系。7. 常见的氧化剂与还原剂。
(1)常见的氧化剂
① 活泼的非金属单质:O2、Cl2、Br2;
② 含高价金属阳离子的化合物:FeCl3;
③ 含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2、Na2O2、H2O2、HClO、NaClO、Ca(ClO)2。
(2)常见的还原剂
①活泼或较活泼的金属:K、Ca、Na、Mg、Al、Zn(按金属活动性顺序,还原性递减);
②含低价金属阳离子的化合物:Fe2+;
③某些非金属单质:C、H2;
④含有较低化合价元素的化合物:HCl、H2S、HI、KI、CO。一、题型导向
【例1】(2017年湖南省学业水平考试真题)下列物质中,属于钾盐的()
A.K B.K2O C.KOH D.K2SO4【答案】D【例2】(2016年湖南省学业水平考试真题)医用酒精是常用的消毒剂,它属于()
A.纯净物 B.混合物 C.酸 D.碱【答案】B【例3】(2015年湖南省学业水平考试真题)碳酸钠(Na2CO3)俗名苏打,属于()
A.酸 B .碱 C.盐 D.氧化物【答案】C【例4】(2017年湖南省学业水平考试真题)下列分散系中,分散质粒子大小在1~100 nm之间的是()
A.泥水 B.油水 C.Fe(OH)3胶体 D.CuSO4溶液【答案】C【例5】(2016年湖南省学业水平考试真题)下列应用中,与胶体性质有关的是()
A.漂白粉消毒 B.食盐调味 C.明矾净水 D.海水晒盐
【例6】(2015年湖南省学业水平考试真题)用红色激光照射下列物质,能观察到丁达尔效应的是()
A.乙醇溶液 B.氢氧化铁胶体 C.硫酸铜溶液 D.蔗糖溶液
【例7】(2017年湖南省学业水平考试真题)下列各组离子能在溶液中大量共存的是()
A. Ag+、Cl- B.Ca2+、CO2-3 C.H+、HCO-3 D.K+、NO-3
【例8】(2016年湖南省学业水平考试真题)下列各组中的离子,能在溶液中大量共存的是()
A.Ag+、Cl- B.H+、CO2-3 C.Na+、NO-3 D.Cu2+、OH-【答案】C【答案】B【答案】D【答案】C【例9】(2015年湖南省学业水平考试真题)下列离子在含有0?1 mol/L SO2-4的溶液中不能大量存在的是()
A.Al3+ B.Cu2+ C.Fe3+ D.Ba2+
【例10】(2017年湖南省学业水平考试真题)下列离子方程式中,正确的是()
A. 稀盐酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀盐酸滴在石灰石上:2H++CO2-3===H2O+CO2↑
C. 稀盐酸滴入氢氧化钾溶液中:H++OH-===H2O
D. 铁片插入硫酸铜溶液中:Fe+Cu2+===Fe3++Cu
【例11】(2016年湖南省学业水平考试真题)下列离子方程式中,正确的是()
A. 铁粉溶于稀硫酸:Fe+6H+===Fe3++3H2↑
B.氯化铁溶液腐蚀铜片:Cu+Fe3+===Fe2++Cu2+
C.钠与水的反应:Na+H2O===Na++OH-+H2↑
D.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O【答案】D【答案】C【答案】D【例12】(2015年湖南省学业水平考试真题)下列离子方程式中,正确的是()
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.铁与氯化铁溶液反应:Fe+Fe3+===2Fe2+
C.盐酸和氢氧化钡溶液反应:H++OH-===H2O
D.碳酸钙和稀盐酸反应:CO2-3+2H+===CO2↑+H2O
【例13】(2016年湖南省学业水平考试真题)煤气化时的主要反应为C(s)+H2O(g)一定条件CO(g)+H2(g)。关于该反应的叙述错误的是()
A. C的化合价升高
B.属于氧化还原反应
C.属于置换反应
D.H2O作还原剂
【答案】C【答案】D二、考情预测
了解分类法对于化学研究和化学学习的重要作用,知道胶体是一种常见的分散系,了解胶体在日常生活中的应用,能正确判断离子之间是否能共存,能正确书写常见的离子方程式,能识别氧化还原反应、氧化剂、还原剂,能结合生产生活实际举例说明常见的氧化还原反应。从近几年看,分类法、胶体的鉴别、离子共存、离子方程式书写、氧化还原反应判断及其概念是学业水平考试的必考点,要求较低,很常规。
