浙江省嘉兴市2018年中考科学试卷(化学部分)试题(解析版)
文档属性
| 名称 | 浙江省嘉兴市2018年中考科学试卷(化学部分)试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 154.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2018-06-26 21:34:11 | ||
图片预览



文档简介
浙江省嘉兴市2018年中考科学
化学部分试题
1.
二氧化碳气体既是温室效应的元凶,又是一种潜在的碳资源。实验室里,科学家已成功利用二氧化碳与环氧丙烷(一种简单有机物)在催化剂的作用下合成“二氧化碳塑料”。该新型塑料在投入工业生产前,以下不是科学家重点考虑的问题是
A.
如何提高催化剂的催化效率
B.
新型塑料是否可降解
C.
新型塑料的化学性质是否稳定
D.
新型塑料生产是否影响碳循环
【答案】D
【解析】A.
提高催化剂的催化效率,会提高二氧化碳塑料的产率,降低生产成本,是科学家重点考虑的问题;
B.
新型塑料是否可降解,会涉及到生产对环境污染的问题,是科学家重点考虑的问题;C.
新型塑料的化学性质是否稳定,会影响到塑料的使用价值和生产的价值问题,是科学家重点考虑的问题;
D.
生物圈中的碳循环主要表现在绿色植物从空气中吸收二氧化碳,经光合作用转化为葡萄糖,并放出氧气(O2),新型塑料生产不会影响碳循环,不是科学家重点考虑的问题。故选D。
2.
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.
操作I一定是降温
B.
操作I一定是加溶质
C.
①与③的溶质质量一定相等
D.
②与③的溶质质量分数一定相等
【答案】D
【解析】A.饱和溶液是:在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。要使固体物质的不饱和溶液变为饱和溶液,常用方法有:增加溶质、减少溶剂、降低温度。所以操作I不一定是降温,错误;B.
操作I不一定是加溶质,错误;C.被溶解的物质叫溶质,
①至③的过程中有固体析出,溶质质量减少,①比③的溶质多,错误;
D.
,②与③是同种物质在同种溶剂、同一温度下的饱和溶液,溶质质量分数一定相等,正确。故选D。
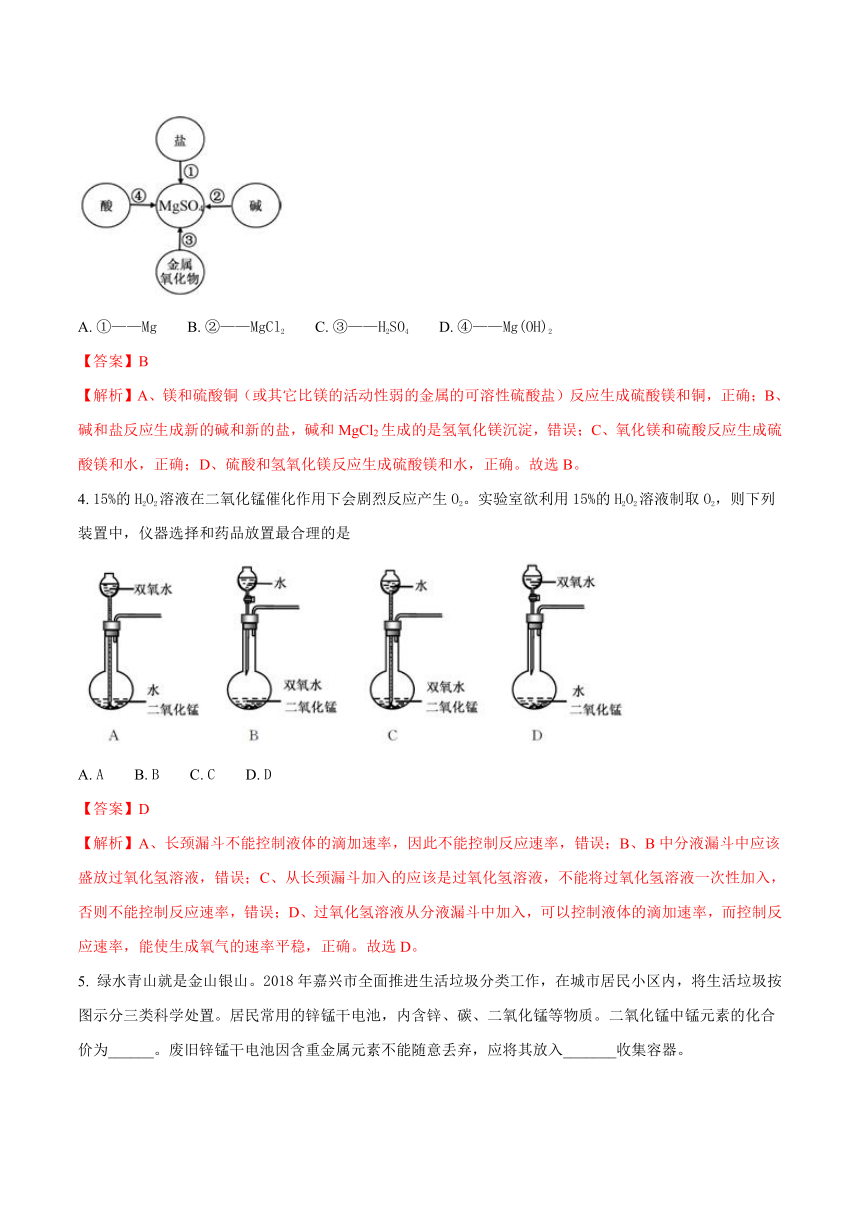
3.
某同学在学习了金属及其化合物之间的转化规律后,绘制了可以通过一步反应制取MgSO4的思维导图,其中所选用的物质错误的是
A.
①——Mg
B.
②——MgCl2
C.
③——H2SO4
D.
④——Mg(OH)2
【答案】B
【解析】A、镁和硫酸铜(或其它比镁的活动性弱的金属的可溶性硫酸盐)反应生成硫酸镁和铜,正确;B、
碱和盐反应生成新的碱和新的盐,碱和MgCl2生成的是氢氧化镁沉淀,错误;C、氧化镁和硫酸反应生成硫酸镁和水,正确;D、硫酸和氢氧化镁反应生成硫酸镁和水,正确。故选B。
4.
15%的H2O2溶液在二氧化锰催化作用下会剧烈反应产生O2。实验室欲利用15%的H2O2溶液制取O2,则下列装置中,仪器选择和药品放置最合理的是
A.
A
B.
B
C.
C
D.
D
【答案】D
【解析】A、长颈漏斗不能控制液体的滴加速率,因此不能控制反应速率,错误;B、B中分液漏斗中应该盛放过氧化氢溶液,错误;C、从长颈漏斗加入的应该是过氧化氢溶液,不能将过氧化氢溶液一次性加入,否则不能控制反应速率,错误;D、过氧化氢溶液从分液漏斗中加入,可以控制液体的滴加速率,而控制反应速率,能使生成氧气的速率平稳,正确。故选D。
5.
绿水青山就是金山银山。2018年嘉兴市全面推进生活垃圾分类工作,在城市居民小区内,将生活垃圾按图示分三类科学处置。居民常用的锌锰干电池,内含锌、碳、二氧化锰等物质。二氧化锰中锰元素的化合价为______。废旧锌锰干电池因含重金属元素不能随意丢弃,应将其放入_______收集容器。
【答案】
(1).
+4;
(2).
有害垃圾。
【解析】化合物中元素的化合价代数和为零,氧元素显-2价,二氧化锰中锰元素的化合价为+4;废旧锌锰干电池因含重金属元素不能随意丢弃,否则易导致水和土壤被污染,应将其放入有害垃圾收集容器。
6.
化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密团容器中某化学反应过程的微观示意图。据图回答:
(1)参加反应的“”与“”的分子个数比为_________。
(2)该反应的基本反应类型是________。
【答案】
(1).
2?:1;
(2).
化合反应
【解析】(1)据质量守恒定律可知,反应前后原子的种类、个数不变。参加反应的“”与“”的分子个数比为2
:1;(2)
由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;由一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应;由两种化合物相互交换成分形成两种新的化合物的反应叫复分解反应。该反应的基本反应类型是化合反应。
7.
兴趣小组某同学在做铜与硝酸银溶液反应的实验,当观察到铜丝表面有银白色固体出现时,发现试管内溶液未显蓝色,与所学知识不符。组内同学即展开讨论,认为溶液未显蓝色是因为铜离子的浓度太小,于是对铜离子浓度太小的原因进行了如下猜想:
猜想一:硝酸银溶液浓度不够大。
猜想二:铜丝中含有比铜活泼的金属。
猜想三:______
【实验验证】
(1)验证猜想一:你的方案是_________。
(2)验证猜想二:取上述相同的铜丝,选择一种酸或盐溶液在相同条件下进行实验,观察实验现象,得出结论。
请你在矩形框内画出实验装置图.并标出所选物质。___________
(3)验证猜想三:进一步实验……
【答案】
(1).
铜与硝酸银溶液反应的时间太短(合理即可)
(2).
其它条件不变,用浓度更大的AgNO3溶液,重复实验,观察实验现象,得出结论。
(3).
(合理即可)
【解析】铜与硝酸银溶液反应的时间太短,或反应速率太慢,都可能导致反应一定时间后,溶液中的铜离子浓度太低;【实验验证】(1)根据控制变量的原则,验证猜想一:方案是其它条件不变,用浓度更大的AgNO3溶液,重复实验,观察实验现象,得出结论;(2)
金属活动顺序表:K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。验证猜想二:取上述相同的铜丝,分别和硫酸或硫酸铜溶液在相同条件下进行实验,观察实验现象,如果有气泡产生或硫酸铜的溶液颜色变浅或变色,可证明铜丝中有比铜活泼的金属,反之,没有;
实验装置如图:
8.
最近,国外研究人员发明了一种在锌原子周围聚合咪唑钠(C3H3N2Na)和苯并咪唑(C7H6N2)两种有机物的新型玻璃,与硅原子周围聚合各种无机物的传统玻璃相比,具有更好的透光性和延展性。
(1)硅元素与锌元素之间最根本的区别是________不同。
(2)新型玻璃具有更好的延展性,这属于物质的______(选填“物理”或”化学”)性质。
(3)请列式计算咪唑钠(C3H3N2Na)中碳元素的质量分数____________。
【答案】
(1).
质子数(或核电荷数)
(2).
物理
(3).
C%=40%
【解析】(1)元素是具有相同质子数的同一类原子的总称,硅元素与锌元素之间最根本的区别是质子数不同;(2)
必须经化学变化才能表现的性质叫化学性质,不需要发生化学变化就能表现的性质叫物理性质。新型玻璃具有更好的延展性,这属于物质的物理性质;(3)
,咪唑钠(C3H3N2Na)中碳元素的质量分数:
=40%。
9.
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。
(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是________。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b计算出大理石样品中碳酸钙的质量__________________。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数___________。
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大,会对实验结果造成较大影响,其原因是________。
【答案】
(1).
硫酸与碳酸钙反应生成的硫酸钙微溶于水、它会包裏在大理石表面,使酸溶液不能与大理石接触,从而使反应中止
(2).
5
g
(3).
18.25%
(4).
盐酸浓度越大,挥发性越强,挥发出的氯化氢气体被吸收装置吸收,导致二氧化碳测量值偏大,对结果有较大影响
【解析】(1)制取二氧化碳时,常用石灰石或大理石和稀盐酸,不用硫酸的原因是:硫酸与碳酸钙反应生成的硫酸钙微溶于水、它会包裏在大理石表面,使酸溶液不能与大理石接触.从而使反应中止;(2)反应后,
吸收装置增加的质量就是碳酸钙反应生成二氧化碳的质量,设碳酸钙的质量为x,参加反应的氯化氢的质量为y
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
100
73
44
x
y
2.2g
100/x=44/2.2g
x=5g
73/y=44/2.2g
y=
3.65g
据质量守恒定律可知反应前后物质的总质量不变,所以:m+盐酸的质量=m+17.8g+2.2g,所加入盐酸的总质量为20g,实验中所用盐酸的溶质质量分数3.65g÷20g×100%=18.25%。(4)
盐酸浓度越大,挥发性越强,会挥发出更多的氯化氢气体被吸收装置吸收,导致二氧化碳测量值偏大,对结果有较大影响。
10.
洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl。HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3==NaCl+_____+CO2
(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管和______。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
第一次
第二次
第三次
第四次
第五次
加入NaHCO3溶液的质量/g
40
40
40
40
40
反应后溶液的总质量/g
138.9
177.8
216.7
255.6
295.6
试分析计算下列问题:
①第一次实验时,所加NaHCO3溶液中溶质质量是多少克_____________?
②该品牌洁厕灵中HCl的质量分数是多少______________?
【答案】
(1).
H2O
(2).
量筒、玻璃棒
(3).
第一次反应中,碳酸氢钠溶液中溶质质量为2.1克
(4).
洁厕灵中HCl的质量分数为3.65%。
【解析】(1)据质量守恒定律可知反应前后原子的种类、个数不变,所以方程式为HCl+NaHCO3==NaCl+
H2O
+CO2↑;(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管、量筒和玻璃棒;(3)由表格中数据可知,第一次至第四次加入的NaHCO3都完全反应,加至第四次时,盐酸和碳酸氢钠刚好完全反应,生成二氧化碳的总质量为4.4g,设参加反应的碳酸氢钠的质量为x,洁厕灵中HCl的质量为y,
NaHCO3
+
HCl
==
NaCl
+
H2O
+
CO2↑
84
36.5
44
x
y
4.4g
84/x=44/4.4g
x=8.4g
第一次反应中,碳酸氢钠溶液中溶质质量为8.4g÷4=2.1g;
36.5/y=44/4.4g
y=3.65g
洁厕灵中HCl的质量分数:
3.65g÷100g×100%=3.65%。
答:第一次反应中,碳酸氢钠溶液中溶质质量为2.1克
;洁厕灵中HCl的质量分数为3.65%。
化学部分试题
1.
二氧化碳气体既是温室效应的元凶,又是一种潜在的碳资源。实验室里,科学家已成功利用二氧化碳与环氧丙烷(一种简单有机物)在催化剂的作用下合成“二氧化碳塑料”。该新型塑料在投入工业生产前,以下不是科学家重点考虑的问题是
A.
如何提高催化剂的催化效率
B.
新型塑料是否可降解
C.
新型塑料的化学性质是否稳定
D.
新型塑料生产是否影响碳循环
【答案】D
【解析】A.
提高催化剂的催化效率,会提高二氧化碳塑料的产率,降低生产成本,是科学家重点考虑的问题;
B.
新型塑料是否可降解,会涉及到生产对环境污染的问题,是科学家重点考虑的问题;C.
新型塑料的化学性质是否稳定,会影响到塑料的使用价值和生产的价值问题,是科学家重点考虑的问题;
D.
生物圈中的碳循环主要表现在绿色植物从空气中吸收二氧化碳,经光合作用转化为葡萄糖,并放出氧气(O2),新型塑料生产不会影响碳循环,不是科学家重点考虑的问题。故选D。
2.
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.
操作I一定是降温
B.
操作I一定是加溶质
C.
①与③的溶质质量一定相等
D.
②与③的溶质质量分数一定相等
【答案】D
【解析】A.饱和溶液是:在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。要使固体物质的不饱和溶液变为饱和溶液,常用方法有:增加溶质、减少溶剂、降低温度。所以操作I不一定是降温,错误;B.
操作I不一定是加溶质,错误;C.被溶解的物质叫溶质,
①至③的过程中有固体析出,溶质质量减少,①比③的溶质多,错误;
D.
,②与③是同种物质在同种溶剂、同一温度下的饱和溶液,溶质质量分数一定相等,正确。故选D。
3.
某同学在学习了金属及其化合物之间的转化规律后,绘制了可以通过一步反应制取MgSO4的思维导图,其中所选用的物质错误的是
A.
①——Mg
B.
②——MgCl2
C.
③——H2SO4
D.
④——Mg(OH)2
【答案】B
【解析】A、镁和硫酸铜(或其它比镁的活动性弱的金属的可溶性硫酸盐)反应生成硫酸镁和铜,正确;B、
碱和盐反应生成新的碱和新的盐,碱和MgCl2生成的是氢氧化镁沉淀,错误;C、氧化镁和硫酸反应生成硫酸镁和水,正确;D、硫酸和氢氧化镁反应生成硫酸镁和水,正确。故选B。
4.
15%的H2O2溶液在二氧化锰催化作用下会剧烈反应产生O2。实验室欲利用15%的H2O2溶液制取O2,则下列装置中,仪器选择和药品放置最合理的是
A.
A
B.
B
C.
C
D.
D
【答案】D
【解析】A、长颈漏斗不能控制液体的滴加速率,因此不能控制反应速率,错误;B、B中分液漏斗中应该盛放过氧化氢溶液,错误;C、从长颈漏斗加入的应该是过氧化氢溶液,不能将过氧化氢溶液一次性加入,否则不能控制反应速率,错误;D、过氧化氢溶液从分液漏斗中加入,可以控制液体的滴加速率,而控制反应速率,能使生成氧气的速率平稳,正确。故选D。
5.
绿水青山就是金山银山。2018年嘉兴市全面推进生活垃圾分类工作,在城市居民小区内,将生活垃圾按图示分三类科学处置。居民常用的锌锰干电池,内含锌、碳、二氧化锰等物质。二氧化锰中锰元素的化合价为______。废旧锌锰干电池因含重金属元素不能随意丢弃,应将其放入_______收集容器。
【答案】
(1).
+4;
(2).
有害垃圾。
【解析】化合物中元素的化合价代数和为零,氧元素显-2价,二氧化锰中锰元素的化合价为+4;废旧锌锰干电池因含重金属元素不能随意丢弃,否则易导致水和土壤被污染,应将其放入有害垃圾收集容器。
6.
化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密团容器中某化学反应过程的微观示意图。据图回答:
(1)参加反应的“”与“”的分子个数比为_________。
(2)该反应的基本反应类型是________。
【答案】
(1).
2?:1;
(2).
化合反应
【解析】(1)据质量守恒定律可知,反应前后原子的种类、个数不变。参加反应的“”与“”的分子个数比为2
:1;(2)
由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;由一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应;由两种化合物相互交换成分形成两种新的化合物的反应叫复分解反应。该反应的基本反应类型是化合反应。
7.
兴趣小组某同学在做铜与硝酸银溶液反应的实验,当观察到铜丝表面有银白色固体出现时,发现试管内溶液未显蓝色,与所学知识不符。组内同学即展开讨论,认为溶液未显蓝色是因为铜离子的浓度太小,于是对铜离子浓度太小的原因进行了如下猜想:
猜想一:硝酸银溶液浓度不够大。
猜想二:铜丝中含有比铜活泼的金属。
猜想三:______
【实验验证】
(1)验证猜想一:你的方案是_________。
(2)验证猜想二:取上述相同的铜丝,选择一种酸或盐溶液在相同条件下进行实验,观察实验现象,得出结论。
请你在矩形框内画出实验装置图.并标出所选物质。___________
(3)验证猜想三:进一步实验……
【答案】
(1).
铜与硝酸银溶液反应的时间太短(合理即可)
(2).
其它条件不变,用浓度更大的AgNO3溶液,重复实验,观察实验现象,得出结论。
(3).
(合理即可)
【解析】铜与硝酸银溶液反应的时间太短,或反应速率太慢,都可能导致反应一定时间后,溶液中的铜离子浓度太低;【实验验证】(1)根据控制变量的原则,验证猜想一:方案是其它条件不变,用浓度更大的AgNO3溶液,重复实验,观察实验现象,得出结论;(2)
金属活动顺序表:K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。验证猜想二:取上述相同的铜丝,分别和硫酸或硫酸铜溶液在相同条件下进行实验,观察实验现象,如果有气泡产生或硫酸铜的溶液颜色变浅或变色,可证明铜丝中有比铜活泼的金属,反之,没有;
实验装置如图:
8.
最近,国外研究人员发明了一种在锌原子周围聚合咪唑钠(C3H3N2Na)和苯并咪唑(C7H6N2)两种有机物的新型玻璃,与硅原子周围聚合各种无机物的传统玻璃相比,具有更好的透光性和延展性。
(1)硅元素与锌元素之间最根本的区别是________不同。
(2)新型玻璃具有更好的延展性,这属于物质的______(选填“物理”或”化学”)性质。
(3)请列式计算咪唑钠(C3H3N2Na)中碳元素的质量分数____________。
【答案】
(1).
质子数(或核电荷数)
(2).
物理
(3).
C%=40%
【解析】(1)元素是具有相同质子数的同一类原子的总称,硅元素与锌元素之间最根本的区别是质子数不同;(2)
必须经化学变化才能表现的性质叫化学性质,不需要发生化学变化就能表现的性质叫物理性质。新型玻璃具有更好的延展性,这属于物质的物理性质;(3)
,咪唑钠(C3H3N2Na)中碳元素的质量分数:
=40%。
9.
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。
(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是________。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b计算出大理石样品中碳酸钙的质量__________________。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数___________。
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大,会对实验结果造成较大影响,其原因是________。
【答案】
(1).
硫酸与碳酸钙反应生成的硫酸钙微溶于水、它会包裏在大理石表面,使酸溶液不能与大理石接触,从而使反应中止
(2).
5
g
(3).
18.25%
(4).
盐酸浓度越大,挥发性越强,挥发出的氯化氢气体被吸收装置吸收,导致二氧化碳测量值偏大,对结果有较大影响
【解析】(1)制取二氧化碳时,常用石灰石或大理石和稀盐酸,不用硫酸的原因是:硫酸与碳酸钙反应生成的硫酸钙微溶于水、它会包裏在大理石表面,使酸溶液不能与大理石接触.从而使反应中止;(2)反应后,
吸收装置增加的质量就是碳酸钙反应生成二氧化碳的质量,设碳酸钙的质量为x,参加反应的氯化氢的质量为y
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
100
73
44
x
y
2.2g
100/x=44/2.2g
x=5g
73/y=44/2.2g
y=
3.65g
据质量守恒定律可知反应前后物质的总质量不变,所以:m+盐酸的质量=m+17.8g+2.2g,所加入盐酸的总质量为20g,实验中所用盐酸的溶质质量分数3.65g÷20g×100%=18.25%。(4)
盐酸浓度越大,挥发性越强,会挥发出更多的氯化氢气体被吸收装置吸收,导致二氧化碳测量值偏大,对结果有较大影响。
10.
洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl。HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3==NaCl+_____+CO2
(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管和______。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
第一次
第二次
第三次
第四次
第五次
加入NaHCO3溶液的质量/g
40
40
40
40
40
反应后溶液的总质量/g
138.9
177.8
216.7
255.6
295.6
试分析计算下列问题:
①第一次实验时,所加NaHCO3溶液中溶质质量是多少克_____________?
②该品牌洁厕灵中HCl的质量分数是多少______________?
【答案】
(1).
H2O
(2).
量筒、玻璃棒
(3).
第一次反应中,碳酸氢钠溶液中溶质质量为2.1克
(4).
洁厕灵中HCl的质量分数为3.65%。
【解析】(1)据质量守恒定律可知反应前后原子的种类、个数不变,所以方程式为HCl+NaHCO3==NaCl+
H2O
+CO2↑;(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管、量筒和玻璃棒;(3)由表格中数据可知,第一次至第四次加入的NaHCO3都完全反应,加至第四次时,盐酸和碳酸氢钠刚好完全反应,生成二氧化碳的总质量为4.4g,设参加反应的碳酸氢钠的质量为x,洁厕灵中HCl的质量为y,
NaHCO3
+
HCl
==
NaCl
+
H2O
+
CO2↑
84
36.5
44
x
y
4.4g
84/x=44/4.4g
x=8.4g
第一次反应中,碳酸氢钠溶液中溶质质量为8.4g÷4=2.1g;
36.5/y=44/4.4g
y=3.65g
洁厕灵中HCl的质量分数:
3.65g÷100g×100%=3.65%。
答:第一次反应中,碳酸氢钠溶液中溶质质量为2.1克
;洁厕灵中HCl的质量分数为3.65%。
同课章节目录
