物质的聚集状态详解
图片预览







文档简介
课件28张PPT。物质的三种聚集状态 ——气态、液态、固态日常生活中哪些物质存在不同的聚集状态?固定的钢铁和液态的钢水、铁水氧气、贮存在钢瓶内的液氧二氧化碳、干冰?为什么固态、液态、气态的物质在性质上有所不同呢微观结构体积受温度压强影响较小体积受温度压强影响较大。
当温度升高,气体分子间距变大,体积膨胀。
当压强增大,气体分子间距离缩小,体积缩小。1、前面我们学习了“物质的量(n)”,由n可以求出哪些物理量?
[思考]2、1mol物质所含的微粒数目相同(N=nNA),
1mol微粒的质量不一定相等(m=nM),
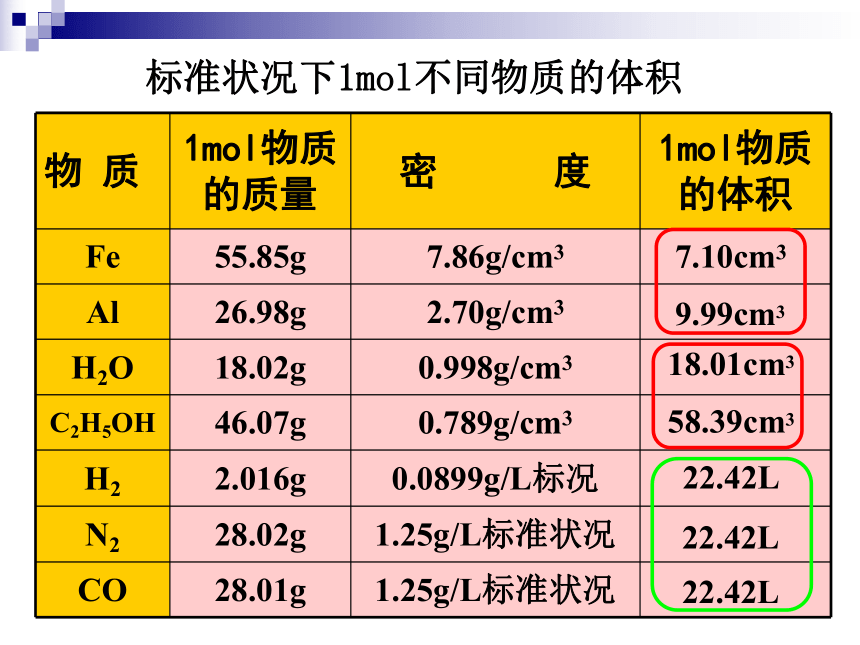
1mol物质的体积是否相同呢?9.99cm37.10cm318.01cm358.39cm322.42L22.42L22.42L标准状况下1mol不同物质的体积 [讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同,而相同条件(标准状况)下,1mol不同的气体体积基本相同呢?
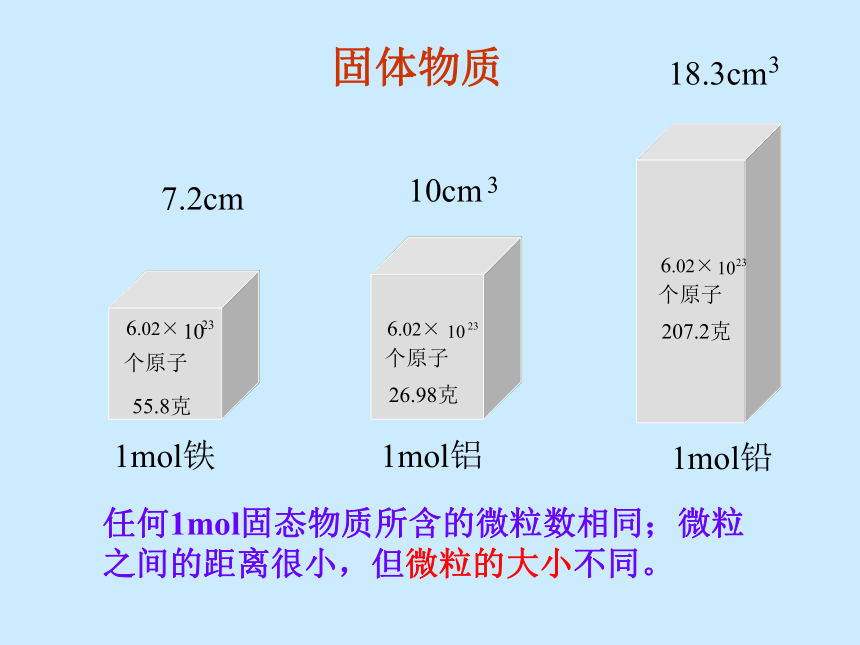
[提示] 决定物质体积大小的因素有哪些?①物质的粒子数目;②粒子的大小;③粒子之间的距离;2、影响物质体积的因素(书上11页)固体物质1mol铁1mol铝1mol铅7.2cm任何1mol固态物质所含的微粒数相同;微粒之间的距离很小,但微粒的大小不同。液体物质1mol硫酸18.0cm53.6cm任何1mol液态物质所含的微粒数相同;微粒之间的距离很小,但微粒的大小不同。构成固态结构微粒间的距离很小构成液态结构微粒间的距离也小固体、液体的体积主要由粒子本身大小决定。 [ 实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。0℃1 mol H2O( 18 mL)气体的体积主要由粒子间距离决定。[小结]
固体、液体物质粒子间间隔很小,在
粒子数目相同的情况下,固体、液体的
体积主要由粒子本身大小决定。
气体粒子间间隔很大,在粒子数目相
同的情况下,气体的体积主要由粒子间
距离决定。
[讨论]2、气体分子间的平均距离受哪些条件影响?是怎样影响的? 在一定温度、压强下,任何具有相同微粒数目的气体都具有大致相同的体积——阿伏伽德罗定律1、决定气体体积大小的主要因素有哪些?标准状况下气体摩尔体积要点:
条件:标准状况
(S.T.P)
对象:任何气体
物质的量:1mol结论体积约占
22.4L 0.282m标准状况下的气体摩尔体积示意图3.气体摩尔体积:常用单位有L/mol(L·mol-1)和m3/mol。公式:符号为Vm概念:1mol气体所占的体积。影响因素: ①温度越高,体积越大 ②压强越大,体积越小[练习]1. 标准状况,1mol任何物质的体积都约是22.4L。错,物质应是气体2. 1mol气体的体积约为22.4L。(错,标准状况)3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)4. 22.4L气体所含分子数一定大于11.2L气体 所含的分子数。(错,未指明是否在相同条件)5. 标准状况下,气体的摩尔体积都是22.4L。(错,“约为”;单位应为L/mol)6. 标准状况,1mol水的体积都约是22.4L错,水不是气体[练习]下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的
体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体
一定处于标准状况
(D)标准状况,1gH2和11.2LO2的物质的量
相等 D (11.2L)(1.5mol)(11.2L)(2×6.02×1023个)谢谢各位!物质的聚集状态第二课时拓展视野晶体:构成晶体的微粒的空间排列是有规则的。具有规则的几何外形,具有固定的熔点。
非晶态物质:构成非晶态物质的微粒的空间排列是无规则的。一般不具有规则的几何外形,没有固定的熔点。晶体与非晶态物质方解石铁矿石萤石红宝石 下列说法是否正确 ?为什么?
(1) 1mol N2 和 1mol O2 所占体积相同
(2) 1g N2 和 1g O2所含分子数相同
(3) 1mol N2 和 1mol O2 所含分子数相同
(4)1mol N2 和 1mol O2 在标准状况下混合,体积约为44.8L。
(5) 1L N2 和 1L O2 在同温同压下所含分子数相同
说法错误。未指明气体所处状态。 说法错误。两种气体物质的量不同。说法正确。物质的量相同的物质所含微粒数相同。 说法正确。混合后气体的物质的量为 2mol。同温同压同体积气体所含分子数相同 1、 同温同压下,含相同分子数的气体所具有的体积是什么关系? 2、同温同压下,相同体积的气体所含分子数是什么关系?思考: 在相同的温度和压强下,相同体积的任何气体都含相同数目的分子,这称为阿伏加德罗定律。阿伏加德罗定律 在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。适用对象:任何气体(包括混合气体)注
意适用条件:同温、同压、同体积 结论:分子数目相同,即气体物质的量
相同。
(四同定律)阿伏加德罗定律的应用 推论(1) 同温同压下,气体体积之比等于分子数之比,等于物质的量之比。例:同温同压下,4.4克CO2与9.6g氧气所占的体积比是多少? 在 H2 + Cl2 = 2 HCl 反应中,各物质
的系数表示什么意义?表示三种物质的分子数之比为 1:1:2表示三种物质的物质的量之比为 1:1:2表示三种物质(气体)的体积比为 1:1:2阿伏加德罗定律的应用推论(2) 同温同压下,气体密度之比等于摩尔质量之比 。m1 、 m2 气体质量M1 、 M2 气体摩尔质量因为所以得到 【练习】1、同温、同压下,CO2与CO的密度之比 。
2、某气体A对氧气的相对密度为0.5,求
①A的式量是多少?②A气体对空气的相对密度是多少?(同温同压下)练习1、同温同压下,等质量的CH4和CO2气体比较,下列说法 不正确的是( )
A. 密度比为4:11
B.分子数之比为4:11
C.体积比为11:4
D.物质的量之比为11:4
2、瓦斯中甲烷与氧气的质量比为1︰4时极易发生爆炸,则 此时甲烷与氧气的体积比是( )
A.1︰4 B.1︰8 C.1︰1 D.2︰13、在标准状况下,测得0.317g A气体的体积是100mL,计算此气体的相对分子质量。若A是双原子分子,则A可能是什么气体?练习
当温度升高,气体分子间距变大,体积膨胀。
当压强增大,气体分子间距离缩小,体积缩小。1、前面我们学习了“物质的量(n)”,由n可以求出哪些物理量?
[思考]2、1mol物质所含的微粒数目相同(N=nNA),
1mol微粒的质量不一定相等(m=nM),
1mol物质的体积是否相同呢?9.99cm37.10cm318.01cm358.39cm322.42L22.42L22.42L标准状况下1mol不同物质的体积 [讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同,而相同条件(标准状况)下,1mol不同的气体体积基本相同呢?
[提示] 决定物质体积大小的因素有哪些?①物质的粒子数目;②粒子的大小;③粒子之间的距离;2、影响物质体积的因素(书上11页)固体物质1mol铁1mol铝1mol铅7.2cm任何1mol固态物质所含的微粒数相同;微粒之间的距离很小,但微粒的大小不同。液体物质1mol硫酸18.0cm53.6cm任何1mol液态物质所含的微粒数相同;微粒之间的距离很小,但微粒的大小不同。构成固态结构微粒间的距离很小构成液态结构微粒间的距离也小固体、液体的体积主要由粒子本身大小决定。 [ 实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。0℃1 mol H2O( 18 mL)气体的体积主要由粒子间距离决定。[小结]
固体、液体物质粒子间间隔很小,在
粒子数目相同的情况下,固体、液体的
体积主要由粒子本身大小决定。
气体粒子间间隔很大,在粒子数目相
同的情况下,气体的体积主要由粒子间
距离决定。
[讨论]2、气体分子间的平均距离受哪些条件影响?是怎样影响的? 在一定温度、压强下,任何具有相同微粒数目的气体都具有大致相同的体积——阿伏伽德罗定律1、决定气体体积大小的主要因素有哪些?标准状况下气体摩尔体积要点:
条件:标准状况
(S.T.P)
对象:任何气体
物质的量:1mol结论体积约占
22.4L 0.282m标准状况下的气体摩尔体积示意图3.气体摩尔体积:常用单位有L/mol(L·mol-1)和m3/mol。公式:符号为Vm概念:1mol气体所占的体积。影响因素: ①温度越高,体积越大 ②压强越大,体积越小[练习]1. 标准状况,1mol任何物质的体积都约是22.4L。错,物质应是气体2. 1mol气体的体积约为22.4L。(错,标准状况)3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)4. 22.4L气体所含分子数一定大于11.2L气体 所含的分子数。(错,未指明是否在相同条件)5. 标准状况下,气体的摩尔体积都是22.4L。(错,“约为”;单位应为L/mol)6. 标准状况,1mol水的体积都约是22.4L错,水不是气体[练习]下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的
体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体
一定处于标准状况
(D)标准状况,1gH2和11.2LO2的物质的量
相等 D (11.2L)(1.5mol)(11.2L)(2×6.02×1023个)谢谢各位!物质的聚集状态第二课时拓展视野晶体:构成晶体的微粒的空间排列是有规则的。具有规则的几何外形,具有固定的熔点。
非晶态物质:构成非晶态物质的微粒的空间排列是无规则的。一般不具有规则的几何外形,没有固定的熔点。晶体与非晶态物质方解石铁矿石萤石红宝石 下列说法是否正确 ?为什么?
(1) 1mol N2 和 1mol O2 所占体积相同
(2) 1g N2 和 1g O2所含分子数相同
(3) 1mol N2 和 1mol O2 所含分子数相同
(4)1mol N2 和 1mol O2 在标准状况下混合,体积约为44.8L。
(5) 1L N2 和 1L O2 在同温同压下所含分子数相同
说法错误。未指明气体所处状态。 说法错误。两种气体物质的量不同。说法正确。物质的量相同的物质所含微粒数相同。 说法正确。混合后气体的物质的量为 2mol。同温同压同体积气体所含分子数相同 1、 同温同压下,含相同分子数的气体所具有的体积是什么关系? 2、同温同压下,相同体积的气体所含分子数是什么关系?思考: 在相同的温度和压强下,相同体积的任何气体都含相同数目的分子,这称为阿伏加德罗定律。阿伏加德罗定律 在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。适用对象:任何气体(包括混合气体)注
意适用条件:同温、同压、同体积 结论:分子数目相同,即气体物质的量
相同。
(四同定律)阿伏加德罗定律的应用 推论(1) 同温同压下,气体体积之比等于分子数之比,等于物质的量之比。例:同温同压下,4.4克CO2与9.6g氧气所占的体积比是多少? 在 H2 + Cl2 = 2 HCl 反应中,各物质
的系数表示什么意义?表示三种物质的分子数之比为 1:1:2表示三种物质的物质的量之比为 1:1:2表示三种物质(气体)的体积比为 1:1:2阿伏加德罗定律的应用推论(2) 同温同压下,气体密度之比等于摩尔质量之比 。m1 、 m2 气体质量M1 、 M2 气体摩尔质量因为所以得到 【练习】1、同温、同压下,CO2与CO的密度之比 。
2、某气体A对氧气的相对密度为0.5,求
①A的式量是多少?②A气体对空气的相对密度是多少?(同温同压下)练习1、同温同压下,等质量的CH4和CO2气体比较,下列说法 不正确的是( )
A. 密度比为4:11
B.分子数之比为4:11
C.体积比为11:4
D.物质的量之比为11:4
2、瓦斯中甲烷与氧气的质量比为1︰4时极易发生爆炸,则 此时甲烷与氧气的体积比是( )
A.1︰4 B.1︰8 C.1︰1 D.2︰13、在标准状况下,测得0.317g A气体的体积是100mL,计算此气体的相对分子质量。若A是双原子分子,则A可能是什么气体?练习
