人教版九年级化学导学案:第四单元-自然界的水
文档属性
| 名称 | 人教版九年级化学导学案:第四单元-自然界的水 |

|
|
| 格式 | zip | ||
| 文件大小 | 722.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-14 00:00:00 | ||
图片预览




文档简介
第四单元 自然界的水
课题1:爱护水资源
一、学习目标:
1.了解世界和中国的水资源状况。
2.通过统计调查水资源和水污染的状况,培养学生的搜集处理信息的能力。
3.通过设计家庭节水计划,使学生牢固地树立“节水从我做起”的信念。
【课前知识积累】
搜集有关水资源和节水的资料。可以通过书籍、报刊杂志、互联网等途径搜集。
【情境导入】
1、俗话说“人可三日无食,但不可一日无水”这是什么原因呢?2、“长寿村之谜”:于都县小溪乡坳下村总人口200多人,百岁老人三四个,80岁以上的习以为常,双胞胎五六对。这是什么原因呢?(2010年4月《赣南日报》)
二、自主探究:
知识点1:人类拥有的水资源
【阅读】课本第68页至70页内容,思考以下问题:
1.地球的表面积约有__________被水覆盖着;地球上最大的储水库是______; 淡水约占全球总水储量的______;海水中含有的化学元素大约有_____种;
2.中国水资源总量居世界第_____位,世界人均水量最多的国家是_____,中国人均水量约占世界均值的_______,我国人均水量最多的省(地区)是______; 我国人均水量最少的省是____。
3.世界上有 人口处于缺水状态, 工程将使我国北方44座大中型城市摆脱缺水困难,
【归纳小结】小组内交流讨论,明确以上问题,师生共同小结。
知识点2:爱护水资源
【阅读】课本第70页至72页内容,思考以下问题:
1.爱护水资源从哪些方面入手?
2.水体污染是指什么?水体污染源主要有哪些?
3.如何节约用水?预防和治理水污染?
【归纳小结】小组内交流讨论,明确以上问题,师生共同小结。
二、爱护水资源
1.节约用水:提高水的 ,使用新技术,改革工艺和改变习惯可以减少大量工农业和生活用水。
2.防止水体污染:
(1)水体污染是指什么?指大量污染物质排入水体,超过水体的 使水质恶化的现象。
(2)水体污染源:
①工业污染:工厂的“三废”( 、 、 )倒入江河、地下,污染江河和地下水。
②农业污染: 、 的不合理使用,也易造成水的污染。
③生活污染:生活 及生活 的任意排放,造成水的污染。
④其他污染:A、病原微生物污染、B、需氧有机物污染、C、富营养化污染(赤潮)、D、恶臭物污染、E、地下水硬度升高、F、重金属离子污染(水俣病)、J、石油泄露造成的海水污染、H、热污染、I、放射性水污染。
(3)水体污染的危害:破坏 ,影响工农业和渔业生产、危害人体健康。
(4)水体污染的防治措施:
①工业上:减少污染物的产生,对污染的水体进行处理。
②农业上:提倡使用农家肥,合理使用 和 。
③生活上:污水实行 。
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列关于水的叙述正确的是( )
A、水是取之不尽、用之不竭的自然资源 B、水是一种有限的宝贵资源,必须保护水资源
C、人类需要的淡水可通过海水蒸馏来补充 D、雨水是天然蒸馏水,所以是纯净物
2.目前,世界上有20多亿人口面临淡水危机,有关部门呼吁市民要节约用水。下列做法与节约用水无关的是( )
A、淘米水用来浇花 B、开发利用地下水 C、使用节水龙头 D、用喷灌、滴灌方法给农作物浇水
3. 下列用水行为不符合节约保护水资源这一主题的是( )
A.农业生产中要合理使用农药和化肥 B.工业废水和生活污水处理达标后再排放
C.将工业冷却水进行循环利用 D.用大量的水冲洗汽车代替人工擦洗
4.下列工业、农业、生活用水方式不宜提倡的是( )
A、园林喷灌 B、工业用水重复使用 C、口杯接水刷牙 D、不间断地边注水边洗衣
5.新制的蒸馏水不宜用于养金鱼,是因为蒸馏水中含有较少的( )
A、氧元素 B、氧原子 C、氧分子 D、氢元素
6.为了防止大气和水污染,还我碧水蓝天,下列措施中不可行的是( )
A、抑制水中所有动植物的生长 B、改变燃料的组成和结构,减少工业烟尘和各种有害气体的排放
C、禁止排放未经处理的工业废水和生活污水 D、推广使用无污染能源
7.“南水北调”工程已经全面动工。
(1)“南水北调”说明我国的水资源分布状况是 。
(2)“南水北调”工程必须遵循的三个重大原则:①先节水,后调水,如图所示标志中属于节水徽记的是 ,请你分析该徽记,说出其中一种象征意义 。
②先治污水后通水,请你任举一个造成水体污染的原因: 。
③先环保后用水。
【作业布置】请预习第四单元 课题2
授课教师签名:
第四单元 自然界的水
课题2:水的净化
一. 学习目标:
1.了解纯水与自然水、硬水、软水的区别;
2.了解吸附、沉淀过程和蒸馏等净化水的方法。
3.通过对本课题的学习,提高学生对环境保护的意识。
【课前知识积累】
1.你知道水存在于哪些地方吗?这些天然水是不是纯净物?
2.自来水中常含有一些可溶性和不溶性杂质,在通入用户前应如何处理?(自来水净化流程)
3.作为家庭饮用水最简单的消毒方法是什么?
4.如何除去黄泥水中含有的泥沙,在此操作中应注意哪些要领?
5.硬水和软水的区别是什么?应怎样鉴别?
【情境导入】
我们会昌是个水资源丰富的城市,有着百里湘江,三江六岸,这河水可直接饮用吗?你能否从中提取洁净的饮用水?
二、自主探究:
知识点1:水的净化
【阅读】课本74页,自来水厂的净化过程。
1、自来水厂的净化过程:
取水——(加絮凝剂)沉淀——过滤——(活性炭)吸附——消毒——配水
2、净化水的常用方法:
(1)静置沉淀法:如农村家庭厨房通常用水缸盛水,即利用了此原理。
(2)吸附沉淀法:①常用吸附剂:木炭、活性炭;(活性炭:它具有较强的吸附性,不仅能除去水中不溶性的杂质,还能除去水中可溶性的杂质。)②絮凝剂:明矾,它是白色晶体,溶于水后生成的胶状物吸附水中的悬浮物,加快悬浮物的沉淀速度。
(3)过滤法: 把不溶于液体的固体物质和液体分离的方法。
①过滤可以分离 与 的混合物
②过滤操作需要哪些仪器?
③过滤的操作要点:
一贴:滤纸要紧贴漏斗的 。
二低:滤纸的边缘要低于 的边缘; 的液面要低于滤纸的边缘。
三靠:烧杯口要紧靠引流的 ;玻璃棒的下端要靠在 的一边;漏斗的下端要紧靠 。
④玻璃棒的作用: 。
【分组实验】完成P75实验4-1、4-2 取水→加明矾吸附→过滤
【交流讨论】1.过滤后,滤液仍然浑浊可能的原因有哪些?
2.河水过滤后,滤液可以喝吗?
3.在生活中还能用什么来代替滤纸?
【观察思考】天然水经过沉淀,过滤,吸附等净化处理后得到的水是否是纯净水?
实验:取上面过滤过的液体滴在蒸发皿中,加热待蒸发后,观察现象。(可以演示)
现象: 。
结论:
知识点2:硬水和软水
【阅读】课本76页 归纳1、硬水和软水的概念
硬水:含有较多___________________的水。 软水:不含或含较少___________________的水。
2、硬水检验(1)加肥皂水 学生完成【实验】P76实验4-3
现象: 一个烧杯产生的 ,一个烧杯产生的 ,浮渣多。
结论:产生泡沫少的是___ ______,产生泡沫多的是_________ ___ 。
(2)蒸发法:硬水蒸发皿底部有白色固体;软水蒸发皿底部无或很少固体。
【阅读】P76第四段,讨论使用硬水会给人类带来那些危害呢?
3、硬水的软化
(1)生活中常用煮沸的方法降低水的硬度
(2)实验室常用蒸馏的方法得到蒸馏水以降低水的硬度,
(3)在工业上常用离子交换法和药剂法来得到软水。
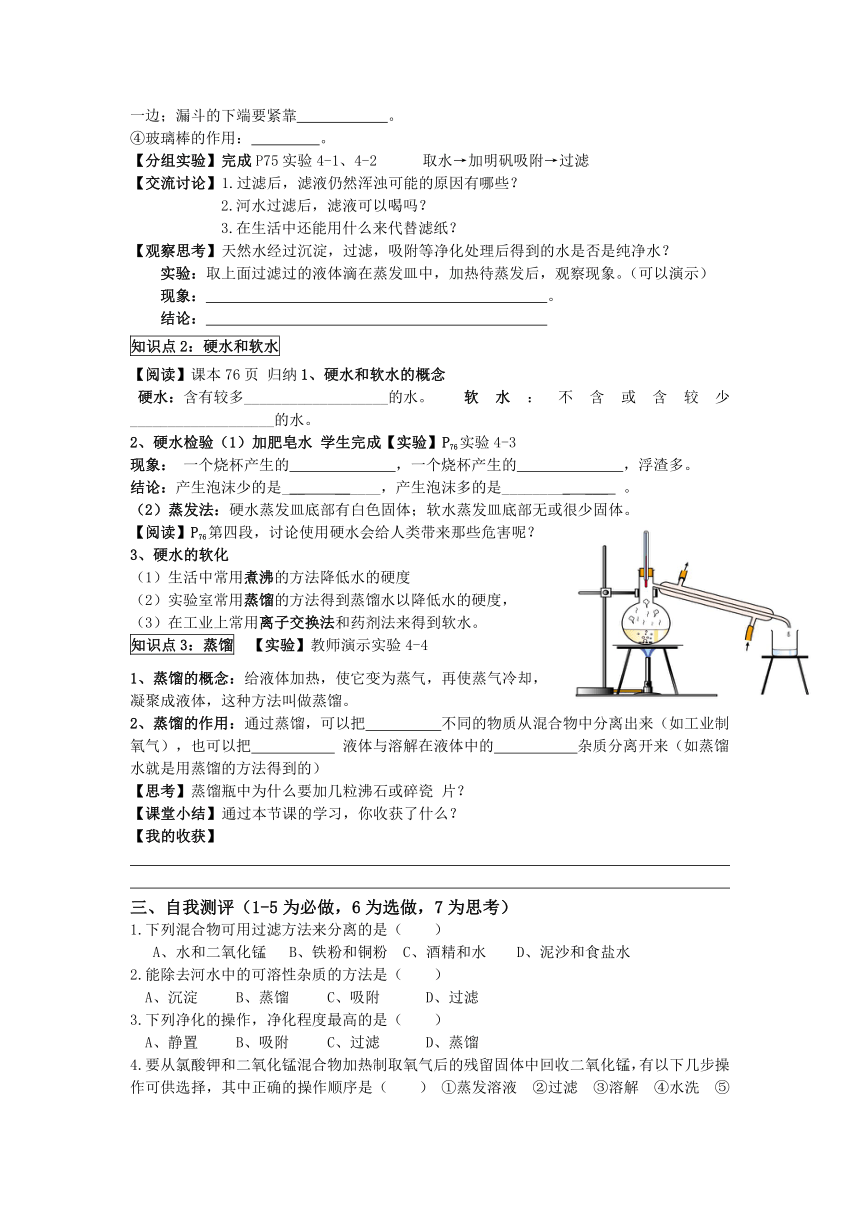
知识点3:蒸馏 【实验】教师演示实验4-4
1、蒸馏的概念:给液体加热,使它变为蒸气,再使蒸气冷却,凝聚成液体,这种方法叫做蒸馏。
2、蒸馏的作用:通过蒸馏,可以把 不同的物质从混合物中分离出来(如工业制氧气),也可以把 液体与溶解在液体中的 杂质分离开来(如蒸馏水就是用蒸馏的方法得到的)
【思考】蒸馏瓶中为什么要加几粒沸石或碎瓷 片?
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列混合物可用过滤方法来分离的是( )
A、水和二氧化锰 B、铁粉和铜粉 C、酒精和水 D、泥沙和食盐水
2.能除去河水中的可溶性杂质的方法是( )
A、沉淀 B、蒸馏 C、吸附 D、过滤
3.下列净化的操作,净化程度最高的是( )
A、静置 B、吸附 C、过滤 D、蒸馏
4.要从氯酸钾和二氧化锰混合物加热制取氧气后的残留固体中回收二氧化锰,有以下几步操作可供选择,其中正确的操作顺序是( ) ①蒸发溶液 ②过滤 ③溶解 ④水洗 ⑤烘干
A.③②④① B.③②⑤④ C.③②④⑤ D.③②①④
5.下列说法错误的是( )
A.将一滴雨水滴在玻璃片上,凉干后有痕迹证明雨水不是纯净物 B.溶有较多含钙.镁物质的水是硬水
C.鉴别蒸馏水还是矿泉水可滴加肥皂水 D.自来水可以饮用所以是纯净物
6.我们的饮用水是由河水净化所得,已知明矾能将水中的悬浮物凝聚而沉淀,氯气可杀菌。则家庭饮用水的正确净化过程是( )
A.河水→过滤→加氯气→加明矾→沉淀→净水 B.河水→加氯气→过滤→加明矾→沉淀→净水
C.河水→加明矾→加氯气→过滤→沉淀→净水 D.河水→加明矾→沉淀→过滤→加氯气→净水
9.右图为同学自制的简易净水器:
(1)小卵石、石英沙、膨松棉的作用是 ,活性炭的作用是 。
(2)净化后是硬水还是软水?可用来 检验。
(3)长期饮用硬水对人体健康不利,要降低水的硬度,可采取
【作业布置】P77 1、2、3、4
授课教师签名:
第四单元 自然界的水
课题3:水的组成
学习目标:
1.知道氢气的物理性质,正确描述氢气的化学性质,简述氢气的主要用途。
2.能根据水的电解实验知道水的组成。(重点)
3.从组成的不同记住化合物和单质的区别。(难点)
4.了解人类认识物质世界的过程和方法。
【课前知识积累】水的物理性质
色、态、味
熔点、沸点
密度
4℃时密度最大为1克/毫升,水凝固成冰时,密度变小,故冰浮于水面(有什么好处?)
重要性能
水能溶解多种物质形成溶液等
【情境导入】
水既普通又宝贵。那么你知道,水究竟是由什么组成的?要认识水的组成,我们就要先来认识一种最轻的气体—氢气
二、自主探究:
知识点1:氢气的性质
【阅读】P79完成实验4-5,填写以下内容。
1、物理性质: 色、 味的气体,密度比空气 ,是相同条件下密度最 的气体, 溶于水。
2、化学性质: ①可燃性: H2 + O2 ---(
a.纯净的氢气在氧气或空气中能 燃烧,发出 色或 色火焰,放大量热,有水生成。
b.氢气与空气或氧气混合气体点燃会发生 现象。(注意:点燃氢气前必须 )
知识点2:水的组成
【设计实验】
1.装置:如右图所示
2.现象:认真观察水的电解实验并做好记录,同时加以分析思考。
现象
1.通电后,两根电极上都出现 ,气体都是_____色的;
2.一段时间后,与电源正、负极相连的电极上产生的气体体积比约为_____ ___。
3.用带火星的木条检验试管A中的气体看到________;用燃着的木条检验试管B中的气体看到在空气中发出________的火焰。
分析
原因
3.结论:________________________________________________________.
该反应的文字表达式: _____________________________, 反应类型:__________反应.
【巧学妙记】电解水实验的简洁记忆法:(电极)正氧负氢,(体积)一氧二氢,(质量)八氧一氢。
【反思与评价】
1.水中加入少量新硫酸或氢氧化钠溶液的目的是什么?__________________
2.通的是__________________(填“交流电”或“直流电”)
【交流讨论】
1.水的电解实验里,有新物质生成吗?水发生了什么变化?说明水的组成是怎样的?
2.实验操作中试管A、B两试管的气体体积比常大于2:1原因可能是__________________
3.有人说水可以开发成能源,你是怎样想的?
知识点3:化合物、氧化物、单质
【交流讨论】
1.从上面的实验和发生的化学反应可见,水是由氢(H)、氧(0)两种元素组成。那么二氧化碳(CO2)、高锰酸钾(KMn04)、五氧化二磷(P2O5)、氢气(H2)、氧化铁(Fe2O3)、氮气(N2)和氧气(O2)分别由几种元素组成的??
2.根据各物质的组成元素特点,把上述物质中的氢气、氮气和氧气等称之为单质;水、二氧化碳、高锰酸钾、五氧化二磷、氧化铁等称之为化合物。试问:什么叫单质?什么叫化合物??
3.上述化合物中二氧化碳(CO2)、五氧化二磷(P2O5)、氧化铁(Fe2O3)又称之为氧化物。试问:它们有又什么共同特点?高锰酸钾(KMn04)属于氧化物吗??
【阅读】阅读教材第81页内容和“资料”。
【思考】1.由同种元素能否组成混合物?
2.含氧化合物与氧化物有什么区别?
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列有关电解水的说法错误是( )
A.水是由氢气和氧气组成的 B.水是由氢元素和氧元素组成
C.自然界中的水大多是混合物 D.水中加入硫酸是为增加导电性
2.下列各组物质中,前者是化合物,后者是单质的是( )。
A.高锰酸钾、氮气 B.洁净的空气、氧气 C.铝、二氧化碳 D.硫粉、氧化镁
3. 下图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
A.一个水分子由二个氢原子和一个氧原子构成
B.水分解后生成氢气和氧气的分子数比为2∶1
C.水分解过程中,分子的种类不变
D.水分解过程中,原子的数目不变
4.将下列物质分别按照混合物、纯净物、单质、化合物、氧化物等分类:①空气、②氮气、③水蒸气、④氧化铁、⑤红磷、⑥二氧化锰、⑦氯酸钾、⑧稀有气体。?并填充到右边的图中?
5.18世纪末,英国科学家普利斯特里把“易燃空气”(实际为氢气)和空气混合后盛在干燥的玻璃瓶中,点火时混合气体发生爆炸,且玻璃瓶内壁上出现了晶莹的水珠。请写出这一变化的文字表达式____ _____,此反应属于______(分解反应或化合反应)。 (第4题图)
6.下列关于水的说法不正确的是( )
A.水是生命活动不可缺少的物质 B.水是常见的溶剂
C.水既可作为反应物,也可以是生成物 D.水是由氢气和氧气组成的一种氧化物
7.如图所示是电解水的简易装置:
(1)电源的A为______极,B为_______极;
(2)检验乙中气体的方法_______________________________;
(3)根据以上实验事实可知:水是由________________组成的;
(4)写出该反应的文字表达式____________ ______反应的类型是__ _____
【作业布置】P82 1-5 授课教师签名:
第四单元 自然界的水
课题4:化合价与化学式(第一课时)
一、学习目标:
1.能说出化学式的含义。(重难点)
2.能依据物质的组成书写单质的化学式。
3.会读简单的化合物的名称。
4.知道书写化合物化学式的注意事项。(重点)
【课前知识积累】
写出下列元素的名称或元素符号。
Fe Mg H C Cu O
氮 硫 氦 锌 铝 钠
【情境导入】
请用上述符号,试着组合成熟悉的一些的物质的符号,比一比谁写的多、快。
引出化学式的概念
二、自主探究:
知识点一:化学式
【阅读】课本P83,思考以下问题:
1.什么是化学式?你能写出一些所学过的物质的化学式吗?
2.“2H2O”中的“2”分别表示什么意义
3.根据课本图,同桌互相叙述化学式H2O,CO2的意义。
宏观意义
微观意义
元素(H)
化学式(H2)
【交流讨论】说出符号H、2H 、H2、2H2 各具有什么意义?然后小组内讨论交流。
1.归纳:元素符号周围数字各有什么意义呢?
⑴微粒前的系数表示 。
例:两个氧原子:2O ;两个氧气分子: ;两个钠离子 。
⑵化学式右下角的数字表示该物质一个分子中含某原子的个数。
例:O2 (一个氧气分子含有氧原子的个数为2);SO3: 。
⑶元素右上角的数字表示其所带电荷数。如:O 2- (表示氧离子带两个单位的负电荷)
练习:下列数字“2”的意义:2Ca2+: ;
2NO2:
★元素符号周围数字的意义
a:表示有a个R粒子(原子、分子或离子等)
b:表示一个粒子中含有b个某原子
c:表示一个R离子带c个正(或负)电荷
d:表示(某化合物中)R元素的化合价为±d价
【阅读】课本P84上半部分内容,思考:
1.单质的化学式是怎样书写的?试着写出单质硅、磷、金、锌、氩气、氮气的化学式。
2.书写化合物的化学式时应注意些什么?
3.由两种元素组成的化合物是怎样命名的?试着读出MnO2、KI、Fe3O4、ZnS的名称。
【练习】写出并读出下列化学式
1.四氧化三铁 氯酸钾 二氧化锰 五氧化二磷 氮气
二氧化硫 过氧化氢 高锰酸钾 氩气 铁 水
2.NaCl CaCl2 MgO CaO CaS CO2 N2O5 P2O5
CS2 HF He Ar
【归纳小结】
1.化学式的书写:
2.化学式的读法:
①固态单质直接读名称:如Cu读作铜;气态单质在名称后加“气”,如H2读作氢气。
②化合物一般从右向左读“某化某”,例如:ZnS读作硫化锌。有时还要读出化学式中各元素的个数,如Fe3O4读作四氧化三铁。
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列有关符号中的数字意义,叙述正确的是( )
A.O2中的“2”表示2个氧原子 B.2Fe中的“2”表示2个铁原子
C.3H2O中的“2”表示一个氢分子中含有2个氢原子 D.2N中的“2”表示2个氮分子
2.指出下列符号中“2”所表示的意义
2O O2 2SO3
3.葡萄糖的化学式为C6H12O6,它由 种元素组成,它的一个分子中有 个原子,各原子的个数比是 。
4.“SO2”表示的意义有
① ②
③ ④
5.空气中含量最多的两种气体单质的化学式分别是 、 ,污染空气的三种有害气体的化学式分别是 、 、 。
6.维生素C主要存在于蔬菜和水果中,其化学式是C6H8O6,维生素由 种元素组成,它的一个分子中有 个原子,各原子的个数比是 。
7.写出下列化学符号:
2个铜原子 4个二氧化碳分子 3个氧分子
2个氮分子 氢气 四氧化二氮
【作业布置】预习化合价
授课教师签名:
第四单元 自然界的水
课题4:化合价与化学式(第二课时)
一、学习目标:
1.理解化合价并记住一些常见元素和原子团的化合价。
2.能依据物质组成,利用元素化合价书写常见物质的化学式(重点)。
【课前知识积累】
1.元素的性质与原子核外电子的排布,特别是__ ____有密切的关系。稀有气体元素的最外层都是__ __个,属于___ ____结构,金属元素最外层电子一般少于___ ___个,在化学反应中易____ __电子,趋向达到相对稳定结构,非金属元素最外层电子一般多于____ ___个,在化学反应中易_____ __电子,趋向达到相对稳定结构。
2.指出下列物质化学式中各原子的个数比:Al2O3 ___ __KIO3 ___ __H2CO3___ __
【情境导入】口诀:一价钾、钠、银、氯、氢;二价钙、镁、钡、氧、锌;一、二铜,二、三铁,三铝四硅五价磷;二、四、六硫,二、四碳;正价负价要分清!负一氢氧硝酸根;负二碳酸硫酸根;负三磷酸最特别;正一价的是铵根。
二、自主探究:
知识点二:化合价
【阅读】课本P84-86,记住P85表4-2下面的内容,完成下列问题:
【归纳小结】
1.化合价:用来表示原子之间相互化合的数目,是不同元素的原子 时表现出来的一种 。它与原子最外层电子数有非常密切关系。
2.化合价的规律:
⑴在化合物中氢通常显____价,氧元素通常显______价;
⑵在金属化合物中金属元素一般显______价,非金属元素一般显_______价;
⑶单质中元素的化合价为_______;
⑷在化合物里各元素的正负化合价的代数和为_________;
⑸一些元素在不同物质中可显______的化合价。
3.化合价的表示方法:书写在元素符号的 。
【练习】试着标出下列物质中各元素的化合价:
CaO Fe2O3 H2 KOH CO2 CO
【讨论】化合价的表示方法和离子符号的书写有什么区别?举例说明:
4.化合价的应用
⑴根据化合价书写化学式(“知价写式”)
【阅读】课本P86例题 归纳一般步骤:
① ② :③
④
★完成P86 练一练
⑵根据化学式计算某元素的化合价(“知式推价”)
例题:求高锰酸钾中锰元素的化合价(KMnO4)
【思考】什么是原子团?试举例说明。化学上原子团通常叫什么?
原子团是指 ,又叫 。
▲常见原子团的化合价
原子团
铵根
氢氧根
硝酸根
硫酸根
碳酸根
磷酸根
离子符号
化合价
+1
-1
-2
-2
-2
-3
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.填写下列各元素或根的化合价
Na Mg Al K Cu O H
OH CO3 NO3 SO4
2.氮气N2中氮的化合价是 ( ) A.—3 B.+5 C.+4 D.0
3.Mg中-2的意义
4.已知下列物质的化学式,你能判断其中带点元素的化合价吗?把你的想法与同学们交流一下。
H2SO4 NaClO4 CaCO3
5.许多元素在不同的化合物中会表现出不同的化合价,化学上通常把同一种元素的高价化合物按正常的方法命名,而把低价的化合物在命名时加上“亚”字,如铁的氧化物有以下几种:氧化铁、氧化亚铁、四氧化三铁,它们的化学式依次是 、 、 。氯化铁和氯化亚铁应分别写成 和 。
【中考直通车】
6.酒后驾车是一种非常严重的违章行为,交警常用“司机饮酒检测仪”检查司机呼出的气体以判断他是否饮酒。司机呼出的乙醇分子能在硫酸存在的条件下,使红色的三氧化铬变为绿色的硫酸铬。硫酸铬
[Cr2(SO4)3]中Cr的化合价为( )
A、+3 B、+5 C、+6 D、+7
7.下列化学符号错误的是( )
A.氯化镁:mgcl2 B.氦气:He C.3个亚铁离子:3Fe2+ D.2个氮原子:2N
8.原子序数11—17元素的符号和原子结构示意图如下,请结合下图回答:
⑴原子序数为15的原子质子数为_______最外层有______电子;
⑵结合上图用符号表示下列内容:
①原子序数为13的原子形成的离子符号____________,
②分子中含有两个原子物质的化学式_____________,
③原子序数为12、17的元素组成化合物的化学式_______________。
⑶从11—17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:__________________________________ ______。(任写一条)
【作业布置】请预习相对分子质量的有关计算
授课教师签名:
第四单元 自然界的水
课题4:化合价与化学式(第三课时)
一、学习目标:
1.知道相对分子质量的概念。
2.初步掌握根据化学式的计算。(重点)
【课前知识积累】
1.查出下列原子的相对原子质量:H O C S
2.从水的化学式H2O,可以看出一个水分子是由______个氢原子和______个氧原子构成。同样一个尿素[ CO(NH2)2 ] 分子由哪些原子构成?
【情境导入】 原子的质量很小,故我们采用相对原子质量表示,那么由原子构成的分子,质量仍然很小,又如何表示呢?
二、自主探究:
知识点三:根据化学式的计算
【阅读】课本P87下半部分及P88内容
【思考】什么是相对分子质量?
【练习】 1.你能否求出 H2、N2、CO2及H2SO4的相对分子质量?
2.试着计算:
⑴双氧水(H2O2)中氢、氧元素的质量比。
⑵硫酸(H2SO4)中氢、硫、氧元素的质量比。
⑶氢氧化钙[ Ca(OH)2 ]中各元素的质量比。
3.试着计算:
⑴SO3中氧元素的质量分数。
⑵尿素[ CO(NH2)2 ]中氮元素的质量分数
⑶你能算出50公斤尿素中含有多少氮元素吗?
⑷那么多少尿素中含有10公斤氮元素呢?
【交流讨论】小组内检查练习情况,交流讨论,总结根据化学式计算的方法和步骤。
【归纳小结】
1、计算相对分子质量
相对分子质量=化学式中各原子的相对原子质量的总和。
2、计算物质中各元素的质量比
①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
②计算时的结果约成最简整数比。
3、计算物质中某元素的质量分数
4、已知某化合物的质量,求某元素的质量
化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数
化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数
5、求化学式
6、计算不纯物中某元素(或某纯净物)的质量分数
计算公式:
②不纯物中某元素的质量分数=不纯物中纯净物的质量分数×该纯净物中某元素的质量分数。
③某纯净物的质量分数=实际上某元素的质量分数÷化学式中该元素的质量分数×100%
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1. 喝酒不开车,开车不喝酒。酒后驾驶是一种违法行为。酒精的化学式为C2H5OH。下列有关酒精的说法正确的是 ( )
A.酒精中氢元素的质量分数最大 B.酒精中碳、氢元素的质量比为1:3
C.酒精属于有机物 D.酒精分子是由2个碳原子、6个氢原子和1个氧原子构成的
2.家居装修时,装饰材料会释放出一种叫甲醛(CH2O)的有害气体,下列关于甲醛的说法不正确的是( )
A.甲醛是由碳氢氧三种元素组成的。 B.甲醛中碳氢氧三种元素的质量比是 1:2:1
C.甲醛的相对分子质量是30 D.甲醛是一种有毒的化合物
3.铌酸锂(LiNbO3)晶体是目前用途最广泛的新型无机材料之一。下列关于铌酸锂说法正确的是( )
A.铌酸锂是一种氧化物 B.铌酸锂是由五个原子构成的
C.铌酸锂是由铌、锂、氧三种元素组成的D.铌酸锂中铌、锂、氧元素的质量比为93∶7∶16
4. 染发时常用到的着色剂——对苯二胺,化学式为C6H8N2,是一种有毒化学药品,有致癌性,下列说法正确的是 ( )
A.对苯二胺中含有N2分子 B.对苯二胺中碳、氢、氮元素的质量比为6:8:2
C.对苯二胺由6个碳原子、8个氢原子和2个氮原子组成
D.对苯二胺中碳元素的质量分数表达式为
5、 已知葡萄糖的化学式为:C6H12O6
(1)葡萄糖的相对分子质量是 (2)碳、氢、氧的质量比是
(3)碳元素的质量分数是
6、我国前段时间在快餐店查出苏丹红而引起“苏丹红”事件。苏丹红一号(C16H12N2O)、苏丹红二号(C18H16N2O)都是工业合成的红色染色剂,世界上多数国家是不允许把它们作为食用色素的。
⑴这两种物质都是由_____________元素组成的;
⑵苏丹红1号中C、H、N、O的原子个数比是_______________________
⑶苏丹红1号、2号的相对分子质量之差为________________.
⑷苏丹红2号中氢元素的质量分数是_______________________.
7.蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸分子中C、H、O、N各原子个数比为 。
(2)丙氨酸的相对分子质量是 ,氮元素的质量分数为 (计算结果精确到0.1%)。
(3)合格奶粉每100 g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%。现测定某奶粉每100 g中含有氮元素的质量为2 g。请通过计算判断该奶粉是否属于合格奶粉。
【作业布置】P88 1-9
授课教师签名:
第四单元 自然界的水
《自然界中的水》单元复习
一、复习目标:
1.认识水的组成,认识电解水的实验装置,记住实验的现象和反应产物;
2.能够区分纯净物、混合物、单质、化合物、氧化物;
3.知道化学式和化合价的意义;掌握化合价的应用和表示,能根据化合价正确书写化学式,会进行化学式的简单计算
4.了解纯水与自然水、硬水与软水的区别,了解水体污染的成因及其防治措施;
5.了解氢气的性质,了解氢气的用途。
二、 知识复习【温故知新】
知识点一:水的组成
1.水的电解实验的现象:
正极气体气的验证方法: 负极气体气的验证方法:
结论:这说明水由__________________________。文字表达式
2.单质: 化合物:
▲请同学们试画出物质的分类图表
知识点二:水的净化
1.净化水的方法有 、 、 、 。
2.过滤操作要点主要有哪些?3.什么是软水和硬水?如何鉴别软水、硬水?
使用硬水会给生活带来哪些麻烦?怎样使硬水软化?
知识点三:爱护水资源
1.水污染的成因:(1) (2) (3) 。
2.防止水体污染的措施:(1) (2) (3) 。
知识点四:氢气
1.氢气的化学性质:可燃性,点燃氢气等可燃性气体前都要 。文字表达式:
2.氢气的用途:(连线)
性质 用途
密度最小的气体 冶炼金属;用作保护气
燃烧产生大量的热 作化工原料
还原性 充灌探空气球
和多种物质直接反应 作高能燃料;用于焊接、切割金属
知识点六:化学式与化合价
1.化合价中有三个“O” ⑴ ;⑵
⑶原子团中各元素正、负化合价的代数和不为 ,等于它的 。
2.几种数字的含义 +2
Fe2+ “2”表示 2 Fe3+:“2”表示 Fe“2”表示
2H2O 前“2”表示 后“2”
3.通常显正一价的元素有 (填元素符号,下同)通常显负一价的元素有 ,
通常显正二价的元素有 ,氧通常显 价。
4.标出下列元素或原子团的化合价:
Cl2 NaCl NH4NO3 KClO3 SiO2 NH3 FeSO4 Zn SO3 KMnO4 K2MnO4
5.写出下列物质的化学式:
氧气 氮气 氢气 氯气 氦气 氧化铁 硫酸铜 碳酸钠 硝酸铵
氧化镁 氯化氢 氢氧化铝 硫酸 氢氧化钠 氢氧化钙 。
6.化学式的意义:如H2O: , , 。
7.化合价与化学式的关系:⑴由化合价可 ⑵化学式可求出 ⑶由化合价可检查 。
知识点七:根据化学式的计算
1.计算相对分子质量
2.计算各元素的
3.计算各元素的原子
4.计算各元素 。
三、自我测评
1.下列物质中,属于纯净物的是 ( )
A.黄酒 B.矿泉水 C.24K黄金 D.铁矿石
2.国家游泳中心—“水立方”的设计灵感于一个“方盆子”,许多“水泡泡”、许多“水分子”。下列关于水分子的说法正确的是 ( )
A.水分子是极小的水滴 B.1个水分子由1个氢分子和1个氧原子构成
C.1个水分子由2个氢原子和1个氧原子构成 D.水分子不能再分
3.过滤操作的下列步骤中错误的是( )
A.取一张圆形滤纸,对折两次,打开成圆锥形,放入漏斗
B.如果滤纸高于漏斗边缘,用剪刀剪去多余部分,使滤纸的边缘比漏斗口稍低
C.用少量水润湿滤纸,使滤纸紧贴漏斗,滤纸层与漏斗壁间不留气泡
D.用玻璃棒轻轻搅动漏斗中液体,以加快过滤
4.根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论。下列说法正确的是( )
A.水是由氢分子和氧分子构成的 B.试管a、b中所得气体的体积比约为2:1
C.试管a、b中所得气体的质量比约为2:1 D.水是由氢原子和氧原子直接构成的
5.右图是电解水的实验装置图,请根据你所了解的知识填空:
(1)A为 极;(2)甲管与乙管中产生的气体体积比是 ,在相同条件
下氧气的溶解度大于氢气的溶解度,这会导致实验中测得结果比理论值偏_____;(填“小”或“大”)
(3)该实验中往往要在水中滴入稀硫酸或氢氧化钠溶液,其目的是 。
6.2008年5月12日汶川大地震牵动全周人民的心,灾区饮水安全成为人们关注的重要问题。请你运用以下资料及所学的化学知识,为灾区人民提供饮水安全常识。
【资料在线】我国生活饮用水的标准
感官指标
化学指标
细菌学指标
水质无色无味
且澄清透明
pH 6 5~8.5;总硬度<250mg/L。
(以碳酸钙计);铜 细茵总数<100个/mL等
(1)除去水中难溶性的固体物质可用 操作,该操作用到的玻璃仪器有 、 、 。
(2)检验水样是硬水还是软水,可用的物质是___ _______,若为硬水,其现象是 ,生活中将硬水变为软水的方法是 ;
(3)符合感官和化学指标的水还不一定是安全的饮用水,理由是____ _________
7.请用数字和化学符号表示:2个氢原子______ +2价的钙元素______ 2个钠离子______ 2个水分子______
8.海洛因是我国政府明令严禁的毒品。海洛因的化学式为C21H23NO5,它是由_______种元素组成的,每个海洛因分子中共有 个原子,海洛因的相对分子质量是__________其中碳元素与氮元素的质量比是__________,碳元素的质量分数是 。
我学会了
我还没完全理
解的内容有
解决办法
1、自己查资料( ) 2、和同学讨论( )3、向老师提问( )
四、课后反思
授课教师签名:
课题1:爱护水资源
一、学习目标:
1.了解世界和中国的水资源状况。
2.通过统计调查水资源和水污染的状况,培养学生的搜集处理信息的能力。
3.通过设计家庭节水计划,使学生牢固地树立“节水从我做起”的信念。
【课前知识积累】
搜集有关水资源和节水的资料。可以通过书籍、报刊杂志、互联网等途径搜集。
【情境导入】
1、俗话说“人可三日无食,但不可一日无水”这是什么原因呢?2、“长寿村之谜”:于都县小溪乡坳下村总人口200多人,百岁老人三四个,80岁以上的习以为常,双胞胎五六对。这是什么原因呢?(2010年4月《赣南日报》)
二、自主探究:
知识点1:人类拥有的水资源
【阅读】课本第68页至70页内容,思考以下问题:
1.地球的表面积约有__________被水覆盖着;地球上最大的储水库是______; 淡水约占全球总水储量的______;海水中含有的化学元素大约有_____种;
2.中国水资源总量居世界第_____位,世界人均水量最多的国家是_____,中国人均水量约占世界均值的_______,我国人均水量最多的省(地区)是______; 我国人均水量最少的省是____。
3.世界上有 人口处于缺水状态, 工程将使我国北方44座大中型城市摆脱缺水困难,
【归纳小结】小组内交流讨论,明确以上问题,师生共同小结。
知识点2:爱护水资源
【阅读】课本第70页至72页内容,思考以下问题:
1.爱护水资源从哪些方面入手?
2.水体污染是指什么?水体污染源主要有哪些?
3.如何节约用水?预防和治理水污染?
【归纳小结】小组内交流讨论,明确以上问题,师生共同小结。
二、爱护水资源
1.节约用水:提高水的 ,使用新技术,改革工艺和改变习惯可以减少大量工农业和生活用水。
2.防止水体污染:
(1)水体污染是指什么?指大量污染物质排入水体,超过水体的 使水质恶化的现象。
(2)水体污染源:
①工业污染:工厂的“三废”( 、 、 )倒入江河、地下,污染江河和地下水。
②农业污染: 、 的不合理使用,也易造成水的污染。
③生活污染:生活 及生活 的任意排放,造成水的污染。
④其他污染:A、病原微生物污染、B、需氧有机物污染、C、富营养化污染(赤潮)、D、恶臭物污染、E、地下水硬度升高、F、重金属离子污染(水俣病)、J、石油泄露造成的海水污染、H、热污染、I、放射性水污染。
(3)水体污染的危害:破坏 ,影响工农业和渔业生产、危害人体健康。
(4)水体污染的防治措施:
①工业上:减少污染物的产生,对污染的水体进行处理。
②农业上:提倡使用农家肥,合理使用 和 。
③生活上:污水实行 。
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列关于水的叙述正确的是( )
A、水是取之不尽、用之不竭的自然资源 B、水是一种有限的宝贵资源,必须保护水资源
C、人类需要的淡水可通过海水蒸馏来补充 D、雨水是天然蒸馏水,所以是纯净物
2.目前,世界上有20多亿人口面临淡水危机,有关部门呼吁市民要节约用水。下列做法与节约用水无关的是( )
A、淘米水用来浇花 B、开发利用地下水 C、使用节水龙头 D、用喷灌、滴灌方法给农作物浇水
3. 下列用水行为不符合节约保护水资源这一主题的是( )
A.农业生产中要合理使用农药和化肥 B.工业废水和生活污水处理达标后再排放
C.将工业冷却水进行循环利用 D.用大量的水冲洗汽车代替人工擦洗
4.下列工业、农业、生活用水方式不宜提倡的是( )
A、园林喷灌 B、工业用水重复使用 C、口杯接水刷牙 D、不间断地边注水边洗衣
5.新制的蒸馏水不宜用于养金鱼,是因为蒸馏水中含有较少的( )
A、氧元素 B、氧原子 C、氧分子 D、氢元素
6.为了防止大气和水污染,还我碧水蓝天,下列措施中不可行的是( )
A、抑制水中所有动植物的生长 B、改变燃料的组成和结构,减少工业烟尘和各种有害气体的排放
C、禁止排放未经处理的工业废水和生活污水 D、推广使用无污染能源
7.“南水北调”工程已经全面动工。
(1)“南水北调”说明我国的水资源分布状况是 。
(2)“南水北调”工程必须遵循的三个重大原则:①先节水,后调水,如图所示标志中属于节水徽记的是 ,请你分析该徽记,说出其中一种象征意义 。
②先治污水后通水,请你任举一个造成水体污染的原因: 。
③先环保后用水。
【作业布置】请预习第四单元 课题2
授课教师签名:
第四单元 自然界的水
课题2:水的净化
一. 学习目标:
1.了解纯水与自然水、硬水、软水的区别;
2.了解吸附、沉淀过程和蒸馏等净化水的方法。
3.通过对本课题的学习,提高学生对环境保护的意识。
【课前知识积累】
1.你知道水存在于哪些地方吗?这些天然水是不是纯净物?
2.自来水中常含有一些可溶性和不溶性杂质,在通入用户前应如何处理?(自来水净化流程)
3.作为家庭饮用水最简单的消毒方法是什么?
4.如何除去黄泥水中含有的泥沙,在此操作中应注意哪些要领?
5.硬水和软水的区别是什么?应怎样鉴别?
【情境导入】
我们会昌是个水资源丰富的城市,有着百里湘江,三江六岸,这河水可直接饮用吗?你能否从中提取洁净的饮用水?
二、自主探究:
知识点1:水的净化
【阅读】课本74页,自来水厂的净化过程。
1、自来水厂的净化过程:
取水——(加絮凝剂)沉淀——过滤——(活性炭)吸附——消毒——配水
2、净化水的常用方法:
(1)静置沉淀法:如农村家庭厨房通常用水缸盛水,即利用了此原理。
(2)吸附沉淀法:①常用吸附剂:木炭、活性炭;(活性炭:它具有较强的吸附性,不仅能除去水中不溶性的杂质,还能除去水中可溶性的杂质。)②絮凝剂:明矾,它是白色晶体,溶于水后生成的胶状物吸附水中的悬浮物,加快悬浮物的沉淀速度。
(3)过滤法: 把不溶于液体的固体物质和液体分离的方法。
①过滤可以分离 与 的混合物
②过滤操作需要哪些仪器?
③过滤的操作要点:
一贴:滤纸要紧贴漏斗的 。
二低:滤纸的边缘要低于 的边缘; 的液面要低于滤纸的边缘。
三靠:烧杯口要紧靠引流的 ;玻璃棒的下端要靠在 的一边;漏斗的下端要紧靠 。
④玻璃棒的作用: 。
【分组实验】完成P75实验4-1、4-2 取水→加明矾吸附→过滤
【交流讨论】1.过滤后,滤液仍然浑浊可能的原因有哪些?
2.河水过滤后,滤液可以喝吗?
3.在生活中还能用什么来代替滤纸?
【观察思考】天然水经过沉淀,过滤,吸附等净化处理后得到的水是否是纯净水?
实验:取上面过滤过的液体滴在蒸发皿中,加热待蒸发后,观察现象。(可以演示)
现象: 。
结论:
知识点2:硬水和软水
【阅读】课本76页 归纳1、硬水和软水的概念
硬水:含有较多___________________的水。 软水:不含或含较少___________________的水。
2、硬水检验(1)加肥皂水 学生完成【实验】P76实验4-3
现象: 一个烧杯产生的 ,一个烧杯产生的 ,浮渣多。
结论:产生泡沫少的是___ ______,产生泡沫多的是_________ ___ 。
(2)蒸发法:硬水蒸发皿底部有白色固体;软水蒸发皿底部无或很少固体。
【阅读】P76第四段,讨论使用硬水会给人类带来那些危害呢?
3、硬水的软化
(1)生活中常用煮沸的方法降低水的硬度
(2)实验室常用蒸馏的方法得到蒸馏水以降低水的硬度,
(3)在工业上常用离子交换法和药剂法来得到软水。
知识点3:蒸馏 【实验】教师演示实验4-4
1、蒸馏的概念:给液体加热,使它变为蒸气,再使蒸气冷却,凝聚成液体,这种方法叫做蒸馏。
2、蒸馏的作用:通过蒸馏,可以把 不同的物质从混合物中分离出来(如工业制氧气),也可以把 液体与溶解在液体中的 杂质分离开来(如蒸馏水就是用蒸馏的方法得到的)
【思考】蒸馏瓶中为什么要加几粒沸石或碎瓷 片?
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列混合物可用过滤方法来分离的是( )
A、水和二氧化锰 B、铁粉和铜粉 C、酒精和水 D、泥沙和食盐水
2.能除去河水中的可溶性杂质的方法是( )
A、沉淀 B、蒸馏 C、吸附 D、过滤
3.下列净化的操作,净化程度最高的是( )
A、静置 B、吸附 C、过滤 D、蒸馏
4.要从氯酸钾和二氧化锰混合物加热制取氧气后的残留固体中回收二氧化锰,有以下几步操作可供选择,其中正确的操作顺序是( ) ①蒸发溶液 ②过滤 ③溶解 ④水洗 ⑤烘干
A.③②④① B.③②⑤④ C.③②④⑤ D.③②①④
5.下列说法错误的是( )
A.将一滴雨水滴在玻璃片上,凉干后有痕迹证明雨水不是纯净物 B.溶有较多含钙.镁物质的水是硬水
C.鉴别蒸馏水还是矿泉水可滴加肥皂水 D.自来水可以饮用所以是纯净物
6.我们的饮用水是由河水净化所得,已知明矾能将水中的悬浮物凝聚而沉淀,氯气可杀菌。则家庭饮用水的正确净化过程是( )
A.河水→过滤→加氯气→加明矾→沉淀→净水 B.河水→加氯气→过滤→加明矾→沉淀→净水
C.河水→加明矾→加氯气→过滤→沉淀→净水 D.河水→加明矾→沉淀→过滤→加氯气→净水
9.右图为同学自制的简易净水器:
(1)小卵石、石英沙、膨松棉的作用是 ,活性炭的作用是 。
(2)净化后是硬水还是软水?可用来 检验。
(3)长期饮用硬水对人体健康不利,要降低水的硬度,可采取
【作业布置】P77 1、2、3、4
授课教师签名:
第四单元 自然界的水
课题3:水的组成
学习目标:
1.知道氢气的物理性质,正确描述氢气的化学性质,简述氢气的主要用途。
2.能根据水的电解实验知道水的组成。(重点)
3.从组成的不同记住化合物和单质的区别。(难点)
4.了解人类认识物质世界的过程和方法。
【课前知识积累】水的物理性质
色、态、味
熔点、沸点
密度
4℃时密度最大为1克/毫升,水凝固成冰时,密度变小,故冰浮于水面(有什么好处?)
重要性能
水能溶解多种物质形成溶液等
【情境导入】
水既普通又宝贵。那么你知道,水究竟是由什么组成的?要认识水的组成,我们就要先来认识一种最轻的气体—氢气
二、自主探究:
知识点1:氢气的性质
【阅读】P79完成实验4-5,填写以下内容。
1、物理性质: 色、 味的气体,密度比空气 ,是相同条件下密度最 的气体, 溶于水。
2、化学性质: ①可燃性: H2 + O2 ---(
a.纯净的氢气在氧气或空气中能 燃烧,发出 色或 色火焰,放大量热,有水生成。
b.氢气与空气或氧气混合气体点燃会发生 现象。(注意:点燃氢气前必须 )
知识点2:水的组成
【设计实验】
1.装置:如右图所示
2.现象:认真观察水的电解实验并做好记录,同时加以分析思考。
现象
1.通电后,两根电极上都出现 ,气体都是_____色的;
2.一段时间后,与电源正、负极相连的电极上产生的气体体积比约为_____ ___。
3.用带火星的木条检验试管A中的气体看到________;用燃着的木条检验试管B中的气体看到在空气中发出________的火焰。
分析
原因
3.结论:________________________________________________________.
该反应的文字表达式: _____________________________, 反应类型:__________反应.
【巧学妙记】电解水实验的简洁记忆法:(电极)正氧负氢,(体积)一氧二氢,(质量)八氧一氢。
【反思与评价】
1.水中加入少量新硫酸或氢氧化钠溶液的目的是什么?__________________
2.通的是__________________(填“交流电”或“直流电”)
【交流讨论】
1.水的电解实验里,有新物质生成吗?水发生了什么变化?说明水的组成是怎样的?
2.实验操作中试管A、B两试管的气体体积比常大于2:1原因可能是__________________
3.有人说水可以开发成能源,你是怎样想的?
知识点3:化合物、氧化物、单质
【交流讨论】
1.从上面的实验和发生的化学反应可见,水是由氢(H)、氧(0)两种元素组成。那么二氧化碳(CO2)、高锰酸钾(KMn04)、五氧化二磷(P2O5)、氢气(H2)、氧化铁(Fe2O3)、氮气(N2)和氧气(O2)分别由几种元素组成的??
2.根据各物质的组成元素特点,把上述物质中的氢气、氮气和氧气等称之为单质;水、二氧化碳、高锰酸钾、五氧化二磷、氧化铁等称之为化合物。试问:什么叫单质?什么叫化合物??
3.上述化合物中二氧化碳(CO2)、五氧化二磷(P2O5)、氧化铁(Fe2O3)又称之为氧化物。试问:它们有又什么共同特点?高锰酸钾(KMn04)属于氧化物吗??
【阅读】阅读教材第81页内容和“资料”。
【思考】1.由同种元素能否组成混合物?
2.含氧化合物与氧化物有什么区别?
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列有关电解水的说法错误是( )
A.水是由氢气和氧气组成的 B.水是由氢元素和氧元素组成
C.自然界中的水大多是混合物 D.水中加入硫酸是为增加导电性
2.下列各组物质中,前者是化合物,后者是单质的是( )。
A.高锰酸钾、氮气 B.洁净的空气、氧气 C.铝、二氧化碳 D.硫粉、氧化镁
3. 下图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
A.一个水分子由二个氢原子和一个氧原子构成
B.水分解后生成氢气和氧气的分子数比为2∶1
C.水分解过程中,分子的种类不变
D.水分解过程中,原子的数目不变
4.将下列物质分别按照混合物、纯净物、单质、化合物、氧化物等分类:①空气、②氮气、③水蒸气、④氧化铁、⑤红磷、⑥二氧化锰、⑦氯酸钾、⑧稀有气体。?并填充到右边的图中?
5.18世纪末,英国科学家普利斯特里把“易燃空气”(实际为氢气)和空气混合后盛在干燥的玻璃瓶中,点火时混合气体发生爆炸,且玻璃瓶内壁上出现了晶莹的水珠。请写出这一变化的文字表达式____ _____,此反应属于______(分解反应或化合反应)。 (第4题图)
6.下列关于水的说法不正确的是( )
A.水是生命活动不可缺少的物质 B.水是常见的溶剂
C.水既可作为反应物,也可以是生成物 D.水是由氢气和氧气组成的一种氧化物
7.如图所示是电解水的简易装置:
(1)电源的A为______极,B为_______极;
(2)检验乙中气体的方法_______________________________;
(3)根据以上实验事实可知:水是由________________组成的;
(4)写出该反应的文字表达式____________ ______反应的类型是__ _____
【作业布置】P82 1-5 授课教师签名:
第四单元 自然界的水
课题4:化合价与化学式(第一课时)
一、学习目标:
1.能说出化学式的含义。(重难点)
2.能依据物质的组成书写单质的化学式。
3.会读简单的化合物的名称。
4.知道书写化合物化学式的注意事项。(重点)
【课前知识积累】
写出下列元素的名称或元素符号。
Fe Mg H C Cu O
氮 硫 氦 锌 铝 钠
【情境导入】
请用上述符号,试着组合成熟悉的一些的物质的符号,比一比谁写的多、快。
引出化学式的概念
二、自主探究:
知识点一:化学式
【阅读】课本P83,思考以下问题:
1.什么是化学式?你能写出一些所学过的物质的化学式吗?
2.“2H2O”中的“2”分别表示什么意义
3.根据课本图,同桌互相叙述化学式H2O,CO2的意义。
宏观意义
微观意义
元素(H)
化学式(H2)
【交流讨论】说出符号H、2H 、H2、2H2 各具有什么意义?然后小组内讨论交流。
1.归纳:元素符号周围数字各有什么意义呢?
⑴微粒前的系数表示 。
例:两个氧原子:2O ;两个氧气分子: ;两个钠离子 。
⑵化学式右下角的数字表示该物质一个分子中含某原子的个数。
例:O2 (一个氧气分子含有氧原子的个数为2);SO3: 。
⑶元素右上角的数字表示其所带电荷数。如:O 2- (表示氧离子带两个单位的负电荷)
练习:下列数字“2”的意义:2Ca2+: ;
2NO2:
★元素符号周围数字的意义
a:表示有a个R粒子(原子、分子或离子等)
b:表示一个粒子中含有b个某原子
c:表示一个R离子带c个正(或负)电荷
d:表示(某化合物中)R元素的化合价为±d价
【阅读】课本P84上半部分内容,思考:
1.单质的化学式是怎样书写的?试着写出单质硅、磷、金、锌、氩气、氮气的化学式。
2.书写化合物的化学式时应注意些什么?
3.由两种元素组成的化合物是怎样命名的?试着读出MnO2、KI、Fe3O4、ZnS的名称。
【练习】写出并读出下列化学式
1.四氧化三铁 氯酸钾 二氧化锰 五氧化二磷 氮气
二氧化硫 过氧化氢 高锰酸钾 氩气 铁 水
2.NaCl CaCl2 MgO CaO CaS CO2 N2O5 P2O5
CS2 HF He Ar
【归纳小结】
1.化学式的书写:
2.化学式的读法:
①固态单质直接读名称:如Cu读作铜;气态单质在名称后加“气”,如H2读作氢气。
②化合物一般从右向左读“某化某”,例如:ZnS读作硫化锌。有时还要读出化学式中各元素的个数,如Fe3O4读作四氧化三铁。
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.下列有关符号中的数字意义,叙述正确的是( )
A.O2中的“2”表示2个氧原子 B.2Fe中的“2”表示2个铁原子
C.3H2O中的“2”表示一个氢分子中含有2个氢原子 D.2N中的“2”表示2个氮分子
2.指出下列符号中“2”所表示的意义
2O O2 2SO3
3.葡萄糖的化学式为C6H12O6,它由 种元素组成,它的一个分子中有 个原子,各原子的个数比是 。
4.“SO2”表示的意义有
① ②
③ ④
5.空气中含量最多的两种气体单质的化学式分别是 、 ,污染空气的三种有害气体的化学式分别是 、 、 。
6.维生素C主要存在于蔬菜和水果中,其化学式是C6H8O6,维生素由 种元素组成,它的一个分子中有 个原子,各原子的个数比是 。
7.写出下列化学符号:
2个铜原子 4个二氧化碳分子 3个氧分子
2个氮分子 氢气 四氧化二氮
【作业布置】预习化合价
授课教师签名:
第四单元 自然界的水
课题4:化合价与化学式(第二课时)
一、学习目标:
1.理解化合价并记住一些常见元素和原子团的化合价。
2.能依据物质组成,利用元素化合价书写常见物质的化学式(重点)。
【课前知识积累】
1.元素的性质与原子核外电子的排布,特别是__ ____有密切的关系。稀有气体元素的最外层都是__ __个,属于___ ____结构,金属元素最外层电子一般少于___ ___个,在化学反应中易____ __电子,趋向达到相对稳定结构,非金属元素最外层电子一般多于____ ___个,在化学反应中易_____ __电子,趋向达到相对稳定结构。
2.指出下列物质化学式中各原子的个数比:Al2O3 ___ __KIO3 ___ __H2CO3___ __
【情境导入】口诀:一价钾、钠、银、氯、氢;二价钙、镁、钡、氧、锌;一、二铜,二、三铁,三铝四硅五价磷;二、四、六硫,二、四碳;正价负价要分清!负一氢氧硝酸根;负二碳酸硫酸根;负三磷酸最特别;正一价的是铵根。
二、自主探究:
知识点二:化合价
【阅读】课本P84-86,记住P85表4-2下面的内容,完成下列问题:
【归纳小结】
1.化合价:用来表示原子之间相互化合的数目,是不同元素的原子 时表现出来的一种 。它与原子最外层电子数有非常密切关系。
2.化合价的规律:
⑴在化合物中氢通常显____价,氧元素通常显______价;
⑵在金属化合物中金属元素一般显______价,非金属元素一般显_______价;
⑶单质中元素的化合价为_______;
⑷在化合物里各元素的正负化合价的代数和为_________;
⑸一些元素在不同物质中可显______的化合价。
3.化合价的表示方法:书写在元素符号的 。
【练习】试着标出下列物质中各元素的化合价:
CaO Fe2O3 H2 KOH CO2 CO
【讨论】化合价的表示方法和离子符号的书写有什么区别?举例说明:
4.化合价的应用
⑴根据化合价书写化学式(“知价写式”)
【阅读】课本P86例题 归纳一般步骤:
① ② :③
④
★完成P86 练一练
⑵根据化学式计算某元素的化合价(“知式推价”)
例题:求高锰酸钾中锰元素的化合价(KMnO4)
【思考】什么是原子团?试举例说明。化学上原子团通常叫什么?
原子团是指 ,又叫 。
▲常见原子团的化合价
原子团
铵根
氢氧根
硝酸根
硫酸根
碳酸根
磷酸根
离子符号
化合价
+1
-1
-2
-2
-2
-3
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1.填写下列各元素或根的化合价
Na Mg Al K Cu O H
OH CO3 NO3 SO4
2.氮气N2中氮的化合价是 ( ) A.—3 B.+5 C.+4 D.0
3.Mg中-2的意义
4.已知下列物质的化学式,你能判断其中带点元素的化合价吗?把你的想法与同学们交流一下。
H2SO4 NaClO4 CaCO3
5.许多元素在不同的化合物中会表现出不同的化合价,化学上通常把同一种元素的高价化合物按正常的方法命名,而把低价的化合物在命名时加上“亚”字,如铁的氧化物有以下几种:氧化铁、氧化亚铁、四氧化三铁,它们的化学式依次是 、 、 。氯化铁和氯化亚铁应分别写成 和 。
【中考直通车】
6.酒后驾车是一种非常严重的违章行为,交警常用“司机饮酒检测仪”检查司机呼出的气体以判断他是否饮酒。司机呼出的乙醇分子能在硫酸存在的条件下,使红色的三氧化铬变为绿色的硫酸铬。硫酸铬
[Cr2(SO4)3]中Cr的化合价为( )
A、+3 B、+5 C、+6 D、+7
7.下列化学符号错误的是( )
A.氯化镁:mgcl2 B.氦气:He C.3个亚铁离子:3Fe2+ D.2个氮原子:2N
8.原子序数11—17元素的符号和原子结构示意图如下,请结合下图回答:
⑴原子序数为15的原子质子数为_______最外层有______电子;
⑵结合上图用符号表示下列内容:
①原子序数为13的原子形成的离子符号____________,
②分子中含有两个原子物质的化学式_____________,
③原子序数为12、17的元素组成化合物的化学式_______________。
⑶从11—17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:__________________________________ ______。(任写一条)
【作业布置】请预习相对分子质量的有关计算
授课教师签名:
第四单元 自然界的水
课题4:化合价与化学式(第三课时)
一、学习目标:
1.知道相对分子质量的概念。
2.初步掌握根据化学式的计算。(重点)
【课前知识积累】
1.查出下列原子的相对原子质量:H O C S
2.从水的化学式H2O,可以看出一个水分子是由______个氢原子和______个氧原子构成。同样一个尿素[ CO(NH2)2 ] 分子由哪些原子构成?
【情境导入】 原子的质量很小,故我们采用相对原子质量表示,那么由原子构成的分子,质量仍然很小,又如何表示呢?
二、自主探究:
知识点三:根据化学式的计算
【阅读】课本P87下半部分及P88内容
【思考】什么是相对分子质量?
【练习】 1.你能否求出 H2、N2、CO2及H2SO4的相对分子质量?
2.试着计算:
⑴双氧水(H2O2)中氢、氧元素的质量比。
⑵硫酸(H2SO4)中氢、硫、氧元素的质量比。
⑶氢氧化钙[ Ca(OH)2 ]中各元素的质量比。
3.试着计算:
⑴SO3中氧元素的质量分数。
⑵尿素[ CO(NH2)2 ]中氮元素的质量分数
⑶你能算出50公斤尿素中含有多少氮元素吗?
⑷那么多少尿素中含有10公斤氮元素呢?
【交流讨论】小组内检查练习情况,交流讨论,总结根据化学式计算的方法和步骤。
【归纳小结】
1、计算相对分子质量
相对分子质量=化学式中各原子的相对原子质量的总和。
2、计算物质中各元素的质量比
①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
②计算时的结果约成最简整数比。
3、计算物质中某元素的质量分数
4、已知某化合物的质量,求某元素的质量
化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数
化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数
5、求化学式
6、计算不纯物中某元素(或某纯净物)的质量分数
计算公式:
②不纯物中某元素的质量分数=不纯物中纯净物的质量分数×该纯净物中某元素的质量分数。
③某纯净物的质量分数=实际上某元素的质量分数÷化学式中该元素的质量分数×100%
【课堂小结】通过本节课的学习,你收获了什么?
【我的收获】
三、自我测评(1-5为必做,6为选做,7为思考)
1. 喝酒不开车,开车不喝酒。酒后驾驶是一种违法行为。酒精的化学式为C2H5OH。下列有关酒精的说法正确的是 ( )
A.酒精中氢元素的质量分数最大 B.酒精中碳、氢元素的质量比为1:3
C.酒精属于有机物 D.酒精分子是由2个碳原子、6个氢原子和1个氧原子构成的
2.家居装修时,装饰材料会释放出一种叫甲醛(CH2O)的有害气体,下列关于甲醛的说法不正确的是( )
A.甲醛是由碳氢氧三种元素组成的。 B.甲醛中碳氢氧三种元素的质量比是 1:2:1
C.甲醛的相对分子质量是30 D.甲醛是一种有毒的化合物
3.铌酸锂(LiNbO3)晶体是目前用途最广泛的新型无机材料之一。下列关于铌酸锂说法正确的是( )
A.铌酸锂是一种氧化物 B.铌酸锂是由五个原子构成的
C.铌酸锂是由铌、锂、氧三种元素组成的D.铌酸锂中铌、锂、氧元素的质量比为93∶7∶16
4. 染发时常用到的着色剂——对苯二胺,化学式为C6H8N2,是一种有毒化学药品,有致癌性,下列说法正确的是 ( )
A.对苯二胺中含有N2分子 B.对苯二胺中碳、氢、氮元素的质量比为6:8:2
C.对苯二胺由6个碳原子、8个氢原子和2个氮原子组成
D.对苯二胺中碳元素的质量分数表达式为
5、 已知葡萄糖的化学式为:C6H12O6
(1)葡萄糖的相对分子质量是 (2)碳、氢、氧的质量比是
(3)碳元素的质量分数是
6、我国前段时间在快餐店查出苏丹红而引起“苏丹红”事件。苏丹红一号(C16H12N2O)、苏丹红二号(C18H16N2O)都是工业合成的红色染色剂,世界上多数国家是不允许把它们作为食用色素的。
⑴这两种物质都是由_____________元素组成的;
⑵苏丹红1号中C、H、N、O的原子个数比是_______________________
⑶苏丹红1号、2号的相对分子质量之差为________________.
⑷苏丹红2号中氢元素的质量分数是_______________________.
7.蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸分子中C、H、O、N各原子个数比为 。
(2)丙氨酸的相对分子质量是 ,氮元素的质量分数为 (计算结果精确到0.1%)。
(3)合格奶粉每100 g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%。现测定某奶粉每100 g中含有氮元素的质量为2 g。请通过计算判断该奶粉是否属于合格奶粉。
【作业布置】P88 1-9
授课教师签名:
第四单元 自然界的水
《自然界中的水》单元复习
一、复习目标:
1.认识水的组成,认识电解水的实验装置,记住实验的现象和反应产物;
2.能够区分纯净物、混合物、单质、化合物、氧化物;
3.知道化学式和化合价的意义;掌握化合价的应用和表示,能根据化合价正确书写化学式,会进行化学式的简单计算
4.了解纯水与自然水、硬水与软水的区别,了解水体污染的成因及其防治措施;
5.了解氢气的性质,了解氢气的用途。
二、 知识复习【温故知新】
知识点一:水的组成
1.水的电解实验的现象:
正极气体气的验证方法: 负极气体气的验证方法:
结论:这说明水由__________________________。文字表达式
2.单质: 化合物:
▲请同学们试画出物质的分类图表
知识点二:水的净化
1.净化水的方法有 、 、 、 。
2.过滤操作要点主要有哪些?3.什么是软水和硬水?如何鉴别软水、硬水?
使用硬水会给生活带来哪些麻烦?怎样使硬水软化?
知识点三:爱护水资源
1.水污染的成因:(1) (2) (3) 。
2.防止水体污染的措施:(1) (2) (3) 。
知识点四:氢气
1.氢气的化学性质:可燃性,点燃氢气等可燃性气体前都要 。文字表达式:
2.氢气的用途:(连线)
性质 用途
密度最小的气体 冶炼金属;用作保护气
燃烧产生大量的热 作化工原料
还原性 充灌探空气球
和多种物质直接反应 作高能燃料;用于焊接、切割金属
知识点六:化学式与化合价
1.化合价中有三个“O” ⑴ ;⑵
⑶原子团中各元素正、负化合价的代数和不为 ,等于它的 。
2.几种数字的含义 +2
Fe2+ “2”表示 2 Fe3+:“2”表示 Fe“2”表示
2H2O 前“2”表示 后“2”
3.通常显正一价的元素有 (填元素符号,下同)通常显负一价的元素有 ,
通常显正二价的元素有 ,氧通常显 价。
4.标出下列元素或原子团的化合价:
Cl2 NaCl NH4NO3 KClO3 SiO2 NH3 FeSO4 Zn SO3 KMnO4 K2MnO4
5.写出下列物质的化学式:
氧气 氮气 氢气 氯气 氦气 氧化铁 硫酸铜 碳酸钠 硝酸铵
氧化镁 氯化氢 氢氧化铝 硫酸 氢氧化钠 氢氧化钙 。
6.化学式的意义:如H2O: , , 。
7.化合价与化学式的关系:⑴由化合价可 ⑵化学式可求出 ⑶由化合价可检查 。
知识点七:根据化学式的计算
1.计算相对分子质量
2.计算各元素的
3.计算各元素的原子
4.计算各元素 。
三、自我测评
1.下列物质中,属于纯净物的是 ( )
A.黄酒 B.矿泉水 C.24K黄金 D.铁矿石
2.国家游泳中心—“水立方”的设计灵感于一个“方盆子”,许多“水泡泡”、许多“水分子”。下列关于水分子的说法正确的是 ( )
A.水分子是极小的水滴 B.1个水分子由1个氢分子和1个氧原子构成
C.1个水分子由2个氢原子和1个氧原子构成 D.水分子不能再分
3.过滤操作的下列步骤中错误的是( )
A.取一张圆形滤纸,对折两次,打开成圆锥形,放入漏斗
B.如果滤纸高于漏斗边缘,用剪刀剪去多余部分,使滤纸的边缘比漏斗口稍低
C.用少量水润湿滤纸,使滤纸紧贴漏斗,滤纸层与漏斗壁间不留气泡
D.用玻璃棒轻轻搅动漏斗中液体,以加快过滤
4.根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论。下列说法正确的是( )
A.水是由氢分子和氧分子构成的 B.试管a、b中所得气体的体积比约为2:1
C.试管a、b中所得气体的质量比约为2:1 D.水是由氢原子和氧原子直接构成的
5.右图是电解水的实验装置图,请根据你所了解的知识填空:
(1)A为 极;(2)甲管与乙管中产生的气体体积比是 ,在相同条件
下氧气的溶解度大于氢气的溶解度,这会导致实验中测得结果比理论值偏_____;(填“小”或“大”)
(3)该实验中往往要在水中滴入稀硫酸或氢氧化钠溶液,其目的是 。
6.2008年5月12日汶川大地震牵动全周人民的心,灾区饮水安全成为人们关注的重要问题。请你运用以下资料及所学的化学知识,为灾区人民提供饮水安全常识。
【资料在线】我国生活饮用水的标准
感官指标
化学指标
细菌学指标
水质无色无味
且澄清透明
pH 6 5~8.5;总硬度<250mg/L。
(以碳酸钙计);铜
(1)除去水中难溶性的固体物质可用 操作,该操作用到的玻璃仪器有 、 、 。
(2)检验水样是硬水还是软水,可用的物质是___ _______,若为硬水,其现象是 ,生活中将硬水变为软水的方法是 ;
(3)符合感官和化学指标的水还不一定是安全的饮用水,理由是____ _________
7.请用数字和化学符号表示:2个氢原子______ +2价的钙元素______ 2个钠离子______ 2个水分子______
8.海洛因是我国政府明令严禁的毒品。海洛因的化学式为C21H23NO5,它是由_______种元素组成的,每个海洛因分子中共有 个原子,海洛因的相对分子质量是__________其中碳元素与氮元素的质量比是__________,碳元素的质量分数是 。
我学会了
我还没完全理
解的内容有
解决办法
1、自己查资料( ) 2、和同学讨论( )3、向老师提问( )
四、课后反思
授课教师签名:
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
