高中化学人教版(新课程标准)必修1第一章第二节物质的量课件(20张)
文档属性
| 名称 | 高中化学人教版(新课程标准)必修1第一章第二节物质的量课件(20张) |

|
|
| 格式 | zip | ||
| 文件大小 | 212.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-18 00:00:00 | ||
图片预览







文档简介
课件20张PPT。第一章 从实验学化学第二节 化学计量在实验中的运用
第一课时
物质的量的单位─摩尔【回顾】 物质是由分子,原子,离子等微粒构成。
例如,水是由水分子构成。
铁是由铁原子构成。
氯化钠由钠离子和氯离子构成。想一想?一滴水中含有的水分子个数?
已知一滴水(约0.05mL)大约含有16万七千亿亿个水分子。
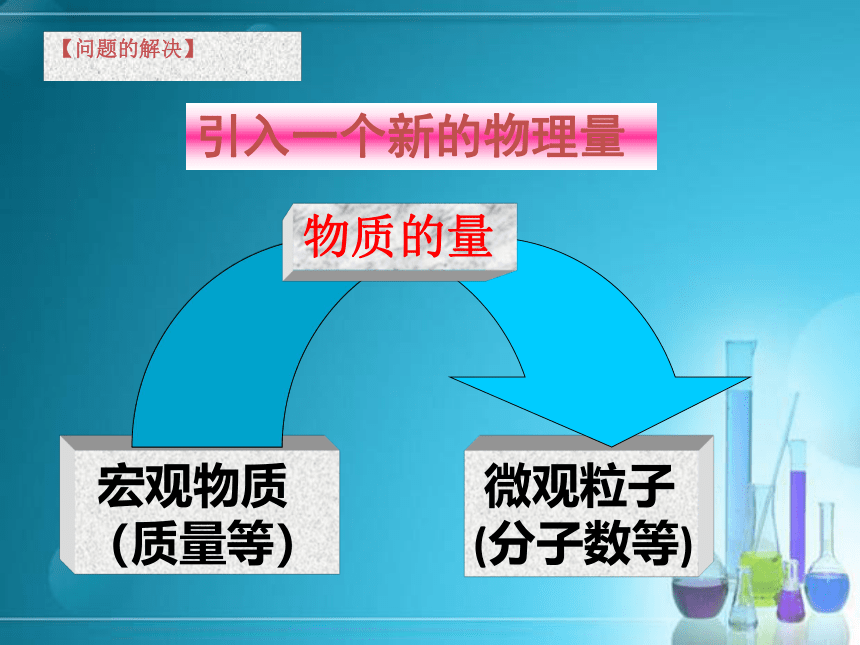
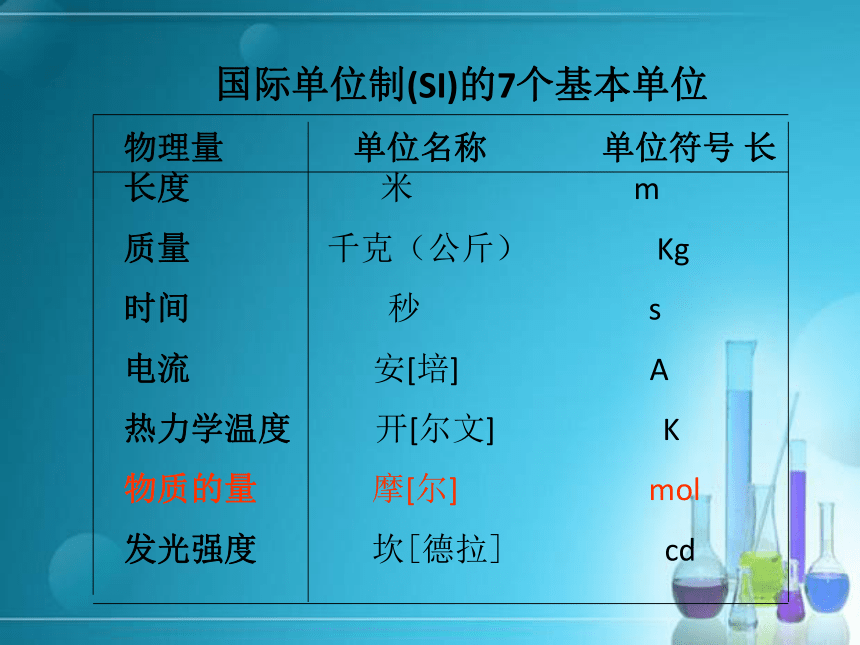
宏 观(质量) 微 观(分子数)?[疑问]一滴水中所含的水分子数大约有16万7千亿亿个,如果让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完.【问题的解决】引入一个新的物理量物质的量 国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号 长 长度 米 m
质量 千克(公斤) Kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd一.物质的量 定义:表示含有一定数目粒子的集合体的一个物理量,符号为n。
物质的量是国际单位制中七个基本物理量之一。
2.单位:摩尔,简称:摩,符号:mol
注意事项:(1)“物质的量”是一个整体,是个专有名词。不能拆开,不是质量。(2)只适用于微观的粒子——分子、原子、离子、电子、质子等
(3)使用时应指明粒子的种类。(一般后面跟化学式)判断下列说法是否正确?1. 一杯水的物质的量是2Kg.
2. 物质的量的单位是摩尔.
3. 1molNa元素.
4. 4mol水分子.
5. 1mol苹果.
6. 3mol氧.
2mol氧原子.
3mol氧分子. 国际上规定,1mol粒子集体所含有的粒子数与0.012Kg12C中所含有的C原子数相同。 那么1mol任何粒子到底有多少呢?0.012kg 12C微观构成(C原子数)?已知:一个碳原子的质量为 1.993 × 10-23g
求: 0.012kg 碳-12 中所含的碳原子数?[思考]解: ≈ 6.02×1023 0.012kg×103g/kg1.993 × 10-23g碳原子数=1mol物质
含微粒数目二.阿伏加德罗常数将1mol粒子集体中所含的粒子数称为阿伏加德罗常数.符号:NA; 单位:mol-1.
NA≈ 6.02×1023mol-1
特别注意:阿伏加德罗常数是一个精确值,而6.02*1023是NA的近似值。阿伏加德罗常数与NA的关系近似于圆周率与π的关系。这杯水的物质的量是nmol,水分子个数_个.
思一思
假设有一杯水,
这杯水的物质的量是1mol,水分子个数是NA个.
这杯水的物质的量是2mol,水分子个数是2NA个.
这杯水的物质的量是3mol,水分子个数是3NA个.
?。。。。。。。。。。。。物质的量、阿伏加德罗常数与粒子数(N)之间存在如下关系:
N=n*NA
转化为:
n=N/NA
或 NA=N/n
特别注意:物质的量用n表示,粒子数用N表示。【推导】?1.一个NH3分子中含有_个电子,0.5molNH3中约含有_个电子.
2.0.1molNaSO4中含有粒子总共_个,Na+的物质的量_,SO42-的物质的量是_.
3.3molO2和2molO3中分子个数之比_,原子个数之比_.
4.1molH2SO4中有_H2SO4分子,约_个H2SO4分子练习小 结 (1) 一个概念及单位:物质的量 摩尔一个常数和数值:阿伏加德罗常数 6.02×1023mol-1(2) 三个关系:概念和单位;n 、 N 、 NA;不同层次粒子间
物质的量的关系物质的量粒子数 NANA(3)注意三点: ①用摩尔必须指明粒子的名称
②只能用于微观粒子
③物质的量是一个专有名词,不 可拆分
÷意义 物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量微粒数
(N) ×NA ÷ NA物质的量(n) 一滴水中含有的水分子个数? 已知一滴水的体积约为0.05mL.即为0.05g.微观粒子(分子数等)物质的量宏观质量NA?谢谢观看
第一课时
物质的量的单位─摩尔【回顾】 物质是由分子,原子,离子等微粒构成。
例如,水是由水分子构成。
铁是由铁原子构成。
氯化钠由钠离子和氯离子构成。想一想?一滴水中含有的水分子个数?
已知一滴水(约0.05mL)大约含有16万七千亿亿个水分子。
宏 观(质量) 微 观(分子数)?[疑问]一滴水中所含的水分子数大约有16万7千亿亿个,如果让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完.【问题的解决】引入一个新的物理量物质的量 国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号 长 长度 米 m
质量 千克(公斤) Kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd一.物质的量 定义:表示含有一定数目粒子的集合体的一个物理量,符号为n。
物质的量是国际单位制中七个基本物理量之一。
2.单位:摩尔,简称:摩,符号:mol
注意事项:(1)“物质的量”是一个整体,是个专有名词。不能拆开,不是质量。(2)只适用于微观的粒子——分子、原子、离子、电子、质子等
(3)使用时应指明粒子的种类。(一般后面跟化学式)判断下列说法是否正确?1. 一杯水的物质的量是2Kg.
2. 物质的量的单位是摩尔.
3. 1molNa元素.
4. 4mol水分子.
5. 1mol苹果.
6. 3mol氧.
2mol氧原子.
3mol氧分子. 国际上规定,1mol粒子集体所含有的粒子数与0.012Kg12C中所含有的C原子数相同。 那么1mol任何粒子到底有多少呢?0.012kg 12C微观构成(C原子数)?已知:一个碳原子的质量为 1.993 × 10-23g
求: 0.012kg 碳-12 中所含的碳原子数?[思考]解: ≈ 6.02×1023 0.012kg×103g/kg1.993 × 10-23g碳原子数=1mol物质
含微粒数目二.阿伏加德罗常数将1mol粒子集体中所含的粒子数称为阿伏加德罗常数.符号:NA; 单位:mol-1.
NA≈ 6.02×1023mol-1
特别注意:阿伏加德罗常数是一个精确值,而6.02*1023是NA的近似值。阿伏加德罗常数与NA的关系近似于圆周率与π的关系。这杯水的物质的量是nmol,水分子个数_个.
思一思
假设有一杯水,
这杯水的物质的量是1mol,水分子个数是NA个.
这杯水的物质的量是2mol,水分子个数是2NA个.
这杯水的物质的量是3mol,水分子个数是3NA个.
?。。。。。。。。。。。。物质的量、阿伏加德罗常数与粒子数(N)之间存在如下关系:
N=n*NA
转化为:
n=N/NA
或 NA=N/n
特别注意:物质的量用n表示,粒子数用N表示。【推导】?1.一个NH3分子中含有_个电子,0.5molNH3中约含有_个电子.
2.0.1molNaSO4中含有粒子总共_个,Na+的物质的量_,SO42-的物质的量是_.
3.3molO2和2molO3中分子个数之比_,原子个数之比_.
4.1molH2SO4中有_H2SO4分子,约_个H2SO4分子练习小 结 (1) 一个概念及单位:物质的量 摩尔一个常数和数值:阿伏加德罗常数 6.02×1023mol-1(2) 三个关系:概念和单位;n 、 N 、 NA;不同层次粒子间
物质的量的关系物质的量粒子数 NANA(3)注意三点: ①用摩尔必须指明粒子的名称
②只能用于微观粒子
③物质的量是一个专有名词,不 可拆分
÷意义 物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量微粒数
(N) ×NA ÷ NA物质的量(n) 一滴水中含有的水分子个数? 已知一滴水的体积约为0.05mL.即为0.05g.微观粒子(分子数等)物质的量宏观质量NA?谢谢观看
