人教版九上化学课时导学案 第二章 课题3 制取氧气(含答案)
文档属性
| 名称 | 人教版九上化学课时导学案 第二章 课题3 制取氧气(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-19 11:04:02 | ||
图片预览




文档简介
21世纪教育网 –中小学教育资源及组卷应用平台
课题3制取氧气
课时目标
1.认识实验室制取氧气的药品和反应原理,初步了解实验室制取氧气的操作。
2.认识催化剂及其作用。
3.了解分解反应及其特点。
4.知道工业上大量制取氧气的原理。
课堂导学
知识点一 氧气的实验室制法
在实验室里,常采用加热高锰酸钾(暗紫色固体,化学符号:KMnO4)、分解过氧化氢(化学符号:H2O2)或加热氯酸钾(白色固体,化学符号:KClO3),各反应的文字表达式分别为:
(1) 高锰酸钾锰酸钾+二氧化锰+氧气;
(2) 过氧化氢水+氧气 ;
(3) 氯酸钾氯化钾+氧气 。
1. 加热高锰酸钾制取氧气
实验装置图 实验操作 实验现象
加热试管,用排水法收集氧气 ①__________________________
把带火星的木条伸入瓶中 ②__________________________
[实验分析]
高锰酸钾在加热条件下会分解生成锰酸钾(化学符号:K2MnO4)、二氧化锰(黑色固体,化学符号:MnO2)和氧气。氧气经导管流向集气瓶内。
2. 分解过氧化氢制取氧气
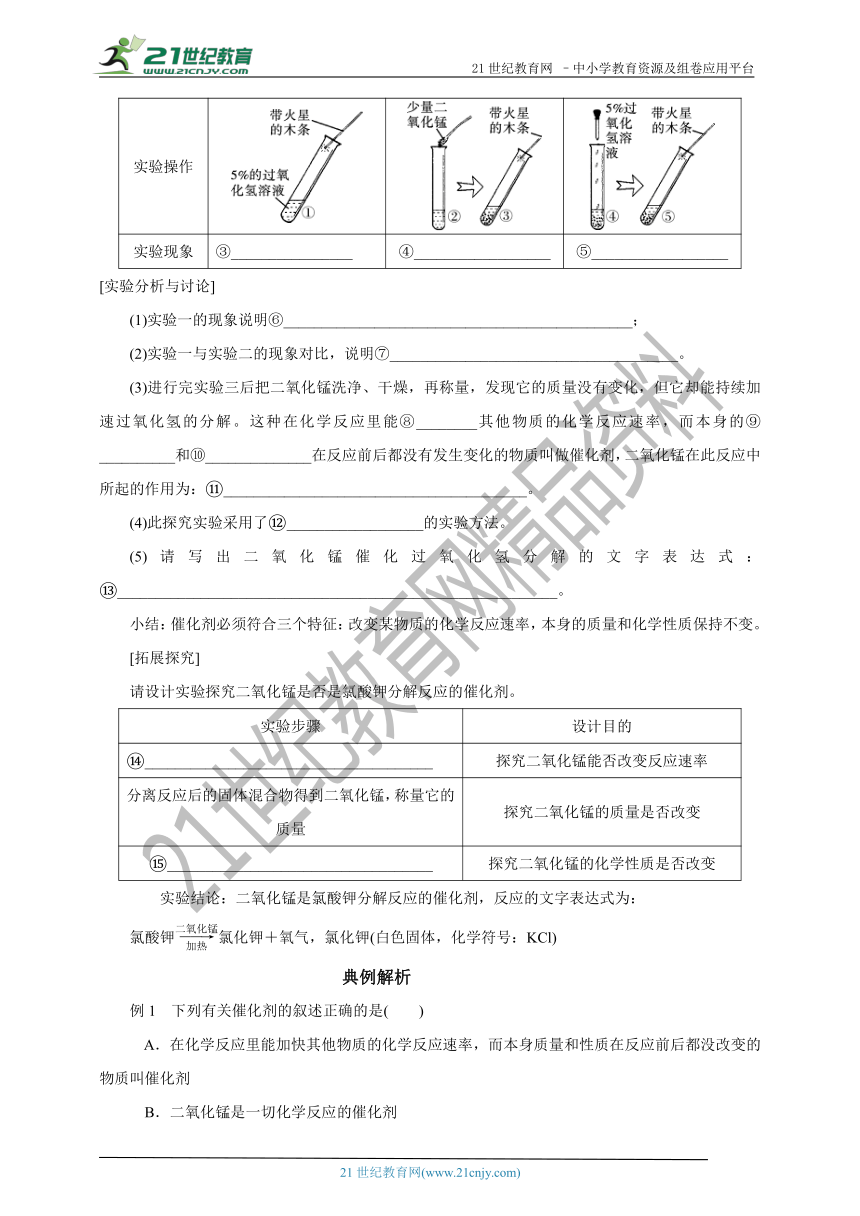
过氧化氢溶液(俗称双氧水)在常温下可以分解放出氧气,但反应速率慢,实验室使用过氧化氢制取氧气时,通常加入少量二氧化锰,这是为什么呢?现就对分解过氧化氢制氧气反应中二氧化锰的作用展开探究:
实验序号 一 二 三
实验操作
实验现象 ③________________ ④__________________ ⑤__________________
[实验分析与讨论]
(1)实验一的现象说明⑥______________________________________________;
(2)实验一与实验二的现象对比,说明⑦______________________________________。
(3)进行完实验三后把二氧化锰洗净、干燥,再称量,发现它的质量没有变化,但它却能持续加速过氧化氢的分解。这种在化学反应里能⑧________其他物质的化学反应速率,而本身的⑨__________和⑩______________在反应前后都没有发生变化的物质叫做催化剂,二氧化锰在此反应中所起的作用为: ________________________________________。
(4)此探究实验采用了 __________________的实验方法。
(5)请写出二氧化锰催化过氧化氢分解的文字表达式: __________________________________________________________。
小结:催化剂必须符合三个特征:改变某物质的化学反应速率,本身的质量和化学性质保持不变。
[拓展探究]
请设计实验探究二氧化锰是否是氯酸钾分解反应的催化剂。
实验步骤 设计目的
______________________________________ 探究二氧化锰能否改变反应速率
分离反应后的固体混合物得到二氧化锰,称量它的质量 探究二氧化锰的质量是否改变
___________________________________ 探究二氧化锰的化学性质是否改变
实验结论:二氧化锰是氯酸钾分解反应的催化剂,反应的文字表达式为:
氯酸钾氯化钾+氧气,氯化钾(白色固体,化学符号:KCl)
典例解析
例1 下列有关催化剂的叙述正确的是( )
A.在化学反应里能加快其他物质的化学反应速率,而本身质量和性质在反应前后都没改变的物质叫催化剂
B.二氧化锰是一切化学反应的催化剂
C.在过氧化氢的分解反应前后,二氧化锰的质量和化学性质都没有发生改变
D.要使过氧化氢分解放出氧气,必须要加入二氧化锰,否则就不能发生反应
解析:催化剂概念中“改变”不能片面地理解为“加快”,有些化学反应速率太快,存在危险性,需要催化剂来减缓反应速率。“化学性质”不变,不能说成是性质(包括物理性质)不变。一种催化剂可能是几个反应的催化剂,同一反应也可能存在几种催化剂。
答案:C
变式练习
1.淀粉酶可以将人体不能直接吸收的淀粉转变成易吸收的小分子物质。下图是淀粉酶对淀粉作用过程的示意图,对该过程的表述错误的是( )
A.酶起催化作用 B.是物理变化
C.是化学变化 D.酶的化学性质没有改变
2.关于催化剂的说法正确的是________________(填序号)
①质量变小 ②质量不变 ③性质不变 ④化学性质不变 ⑤加快化学反应速率 ⑥改变化学反应速率 ⑦二氧化锰是一切反应的催化剂
知识点二 分解反应
分析上述三个实验室制氧气的反应,可以发现他们的共同特征是: ______________________________________________________________________。
(1)定义:由一种 ____________生成 __________或 ______________其他物质的反应,叫做分解反应。
(2)特点: ______________________________________________________________。
(3)表达式的通式可表示为:______________________________________________。
(4)属于化学基本反应类型之一。
典例解析
例2 气相合成金刚石薄膜被誉为“20世纪的炼金术”。其中化学气相沉积法制造金刚石薄膜的原理为:甲烷金刚石+氢气,该反应所属的基本反应类型为( )
A.化合反应 B.分解反应 C.氧化反应 D.以上三者均不是
解析:化合反应的特点是多种物质生成一种物质;分解反应的特点是一种物质生成多种物质,符合情景反应;物质与氧气发生的反应属于氧化反应,但氧化反应不属于基本反应类型。
答案:B
变式练习
3.下列反应既不是化合反应,也不是分解反应的是( )
A.水氢气+氧气 B.一氧化碳+氧化铜铜+二氧化碳
C.铝+氧气氧化铝 D.氯酸钾氯化钾+氧气
下列反应中,属于分解反应的是( B )
知识点三 氧气的工业制法
阅读教材P40的资料卡片,了解工业上是如何大量制取氧气的。
(1)原料:空气
(2)方法:
①分离液态空气法
利用空气各成分的沸点不同,通过先液化空气,再蒸发分离制取。
②膜分离技术法
将空气通过富集氧气功能的薄膜,即可得到含氧气量较高的空气,用该膜进行多级分离,可得到90%以上的富氧空气。
课堂小结
一、氧气的实验室制法
1.制取药品及原理; 2.催化剂 3.分解反应
二、氧气的工业制法
1.液化蒸发空气法 2.膜分离技术法
课时达标
1.下列药品不能用于实验室制取氧气的是( )
A.高锰酸钾 B.过氧化氢 C.氯化钾 D.氯酸钾
2.实现“低碳经济”的一种策略是节约能源。如图所示的四种制取氧气的方法中最节能的是( )
A.① B.② C.③ D.④
3.研究表明,许多金属氧化物对氯酸钾的分解有催化作用。下表是不同金属氧化物作催化剂,氯酸钾剧烈反应时的温度:
氧化物 氧化铁 氧化铝 氧化铜 氧化镁
剧烈反应的温度/℃ 490 540 350 546
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用( )
A.氧化铁 B.氧化铝 C.氧化铜 D.氧化镁
4.有一种暗紫色固体A,加热后生成无色气体B,B能使带火星的木条复燃。非金属固体C在B中燃烧产生刺激性气味的气体。金属D在B中燃烧,火星四射,生成一种黑色固体E。请按要求回答下列问题:
(1)写出下列物质的名称:B__________、C__________、E__________。
(2)写出加热A生成B的文字表达式:____________________,此基本反应类型属于________________。
(3)D在B中燃烧的文字表达式为:______________________________,此基本反应类型属于________________。
课后作业
A 双基过关
1. 下列方法均可用于制取氧气,其中属于物理变化的是( )。
A. 蒸发液态空气 B. 加热高锰酸钾 C. 分解过氧化氢溶液 D. 加热氧化汞
2. 实现“低碳经济”的一种策略是节约能源。如图所示的四种制取氧气的方法中最节能的是( )。
A. ① B. ② C. ③ D. ④
3. 分解过氧化氢溶液制取氧气,加入二氧化锰的目的是( )。
A. 制取更多的氧气
B. 不加入二氧化锰,过氧化氢不能生成氧气
C. 加入二氧化锰,过氧化氢不需要加热就能生成氧气
D. 加入二氧化锰,提高制取氧气的纯度
4. 加热氯酸钾制取氧气时忘了加入二氧化锰,结果是( )。
A. 根本无法生成氧气
B. 产生氧气的总质量减小
C. 产生氧气速率慢
D. 没有水生成
5. 某同学加热氯酸钾制氧气,错把高锰酸钾当作二氧化锰放入氯酸钾内,其结果与只加热氯酸钾相比,正确的是( )。
A. 反应速率不变 B. 反应速率加快,生成氧气质量不变
C. 生成氧气质量减少 D. 反应速率加快,生成氧气质量增加
6. 下列反应属于分解反应的是( )。
A. 铁 + 氧气 四氧化三铁 B. 甲烷 + 氧气 二氧化碳 + 水
C. 过氧化氢 水 + 氧气 D. 铁 + 硫酸铜 铜 + 硫酸亚铁
7. 下列对催化剂描述正确的是( )。
A. 任何化学反应都需要催化剂
B. 催化剂在反应前后本身的质量发生了变化
C. 只有分解反应才需要催化剂
D. 某些化学反应可以有多种催化剂
8. 研究表明,许多金属氧化物对氯酸钾的分解有催化作用。下表是不同金属氧化物作催化剂,氯酸钾剧烈反应时的温度。
氧化物 氧化铁 氧化铝 氧化铜 氧化镁
剧烈反应的温度/℃ 490 540 350 546
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用( )。
A. 氧化铁 B. 氧化铝 C. 氧化铜 D. 氧化镁
9. 实验室制取氧气与工业制取氧气比较,下列叙述正确的是( )。
A. 生产原料不同 B. 制取产物完全不同
C. 都是化学反应 D. 都利用了物质的化学性质
10. 有A,B,C,D四种物质,B是暗红色固体,在空气中能剧烈燃烧,产生大量白烟;C能在无色气体A中燃烧并发出蓝紫色火焰;将燃着的木条伸入无色无味气体D中,木条立刻熄灭,向D中加入澄清的石灰水中,石灰水变浑浊。由此可推断:
(1)写出物质的名称:A___________,B___________, C_____________ D_____________。
(2)写出下列转化的文字表达式:B→C___________________________。
B能力提高
淀粉酶可以将人体不能直接吸收的淀粉转变成易吸收的小分子物质。下图是淀粉酶对淀粉作用过程的示意图,对该过程的表述错误的是( )。
A. 酶起催化作用
B. 是物理变化
C. 是化学变化
D. 酶的化学性质没有改变
12. 某同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
实验步骤 实验现象 实验结论
①将等体积的两种无色液体分别加入A、B两个试管中;②分别向A、B两试管中同时加入等质量的________________,观察现象 A试管中__________;B试管中有气泡产生 A试管中的无色液体是_______________;B试管中的无色液体是______________
(1)B试管中发生反应的文字表达式:_______________________________。
(2)如何验证B试管中产生的气体?(写出操作步骤、实验现象和结论)
____________________________________________________________________。
参考答案
课堂导练
① 有气泡产生 ② 带火星的木条复燃 ③有气泡产生,火星的木条不复燃 ④没有气泡产生,带火星的木条不复燃 ⑤有大量气泡产生,带火星的木条复燃 ⑥过氧化氢溶液常温下分解速率慢 ⑦二氧化锰能加快过氧化氢溶液的分解速率 ⑧改变 ⑨ 质量 ⑩化学性质 催化作用 对比 过氧化氢水+氧气 取质量相同的两份氯酸钾,一份不加二氧化锰,一份加少量二氧化锰,同时进行实验 取反应后分离得到的二氧化锰,加入锰酸钾中,再次进行实验 反应物只有一种,生成物有多种 反应物 两种 两种以上 一变多 A→B+C+……
变式训练
1.B 2.②④⑥ 3. B 4. B
课时达标
1.C 2.C 3.C 4.(1)氧气、硫、四氧化三铁 (2)高锰酸钾锰酸钾+二氧化锰+氧气,分解反应 (3)铁+氧气四氧化三铁 化合反应
课后作业
A 双基过关
1. A 2. C 3. C 4. C 5. D 6. C 7. D 8. C 9. A
10. (1)O2;Fe ;S ;CO2
(2)铁+氧气四氧化三铁
B 能力提高
11. B
12. 二氧化锰 无明显现象 水 双氧水
(1)过氧化氢 水 + 氧气
(2) 将带火星的木条伸入试管B中,若木条复燃,则是氧气
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
课题3制取氧气
课时目标
1.认识实验室制取氧气的药品和反应原理,初步了解实验室制取氧气的操作。
2.认识催化剂及其作用。
3.了解分解反应及其特点。
4.知道工业上大量制取氧气的原理。
课堂导学
知识点一 氧气的实验室制法
在实验室里,常采用加热高锰酸钾(暗紫色固体,化学符号:KMnO4)、分解过氧化氢(化学符号:H2O2)或加热氯酸钾(白色固体,化学符号:KClO3),各反应的文字表达式分别为:
(1) 高锰酸钾锰酸钾+二氧化锰+氧气;
(2) 过氧化氢水+氧气 ;
(3) 氯酸钾氯化钾+氧气 。
1. 加热高锰酸钾制取氧气
实验装置图 实验操作 实验现象
加热试管,用排水法收集氧气 ①__________________________
把带火星的木条伸入瓶中 ②__________________________
[实验分析]
高锰酸钾在加热条件下会分解生成锰酸钾(化学符号:K2MnO4)、二氧化锰(黑色固体,化学符号:MnO2)和氧气。氧气经导管流向集气瓶内。
2. 分解过氧化氢制取氧气
过氧化氢溶液(俗称双氧水)在常温下可以分解放出氧气,但反应速率慢,实验室使用过氧化氢制取氧气时,通常加入少量二氧化锰,这是为什么呢?现就对分解过氧化氢制氧气反应中二氧化锰的作用展开探究:
实验序号 一 二 三
实验操作
实验现象 ③________________ ④__________________ ⑤__________________
[实验分析与讨论]
(1)实验一的现象说明⑥______________________________________________;
(2)实验一与实验二的现象对比,说明⑦______________________________________。
(3)进行完实验三后把二氧化锰洗净、干燥,再称量,发现它的质量没有变化,但它却能持续加速过氧化氢的分解。这种在化学反应里能⑧________其他物质的化学反应速率,而本身的⑨__________和⑩______________在反应前后都没有发生变化的物质叫做催化剂,二氧化锰在此反应中所起的作用为: ________________________________________。
(4)此探究实验采用了 __________________的实验方法。
(5)请写出二氧化锰催化过氧化氢分解的文字表达式: __________________________________________________________。
小结:催化剂必须符合三个特征:改变某物质的化学反应速率,本身的质量和化学性质保持不变。
[拓展探究]
请设计实验探究二氧化锰是否是氯酸钾分解反应的催化剂。
实验步骤 设计目的
______________________________________ 探究二氧化锰能否改变反应速率
分离反应后的固体混合物得到二氧化锰,称量它的质量 探究二氧化锰的质量是否改变
___________________________________ 探究二氧化锰的化学性质是否改变
实验结论:二氧化锰是氯酸钾分解反应的催化剂,反应的文字表达式为:
氯酸钾氯化钾+氧气,氯化钾(白色固体,化学符号:KCl)
典例解析
例1 下列有关催化剂的叙述正确的是( )
A.在化学反应里能加快其他物质的化学反应速率,而本身质量和性质在反应前后都没改变的物质叫催化剂
B.二氧化锰是一切化学反应的催化剂
C.在过氧化氢的分解反应前后,二氧化锰的质量和化学性质都没有发生改变
D.要使过氧化氢分解放出氧气,必须要加入二氧化锰,否则就不能发生反应
解析:催化剂概念中“改变”不能片面地理解为“加快”,有些化学反应速率太快,存在危险性,需要催化剂来减缓反应速率。“化学性质”不变,不能说成是性质(包括物理性质)不变。一种催化剂可能是几个反应的催化剂,同一反应也可能存在几种催化剂。
答案:C
变式练习
1.淀粉酶可以将人体不能直接吸收的淀粉转变成易吸收的小分子物质。下图是淀粉酶对淀粉作用过程的示意图,对该过程的表述错误的是( )
A.酶起催化作用 B.是物理变化
C.是化学变化 D.酶的化学性质没有改变
2.关于催化剂的说法正确的是________________(填序号)
①质量变小 ②质量不变 ③性质不变 ④化学性质不变 ⑤加快化学反应速率 ⑥改变化学反应速率 ⑦二氧化锰是一切反应的催化剂
知识点二 分解反应
分析上述三个实验室制氧气的反应,可以发现他们的共同特征是: ______________________________________________________________________。
(1)定义:由一种 ____________生成 __________或 ______________其他物质的反应,叫做分解反应。
(2)特点: ______________________________________________________________。
(3)表达式的通式可表示为:______________________________________________。
(4)属于化学基本反应类型之一。
典例解析
例2 气相合成金刚石薄膜被誉为“20世纪的炼金术”。其中化学气相沉积法制造金刚石薄膜的原理为:甲烷金刚石+氢气,该反应所属的基本反应类型为( )
A.化合反应 B.分解反应 C.氧化反应 D.以上三者均不是
解析:化合反应的特点是多种物质生成一种物质;分解反应的特点是一种物质生成多种物质,符合情景反应;物质与氧气发生的反应属于氧化反应,但氧化反应不属于基本反应类型。
答案:B
变式练习
3.下列反应既不是化合反应,也不是分解反应的是( )
A.水氢气+氧气 B.一氧化碳+氧化铜铜+二氧化碳
C.铝+氧气氧化铝 D.氯酸钾氯化钾+氧气
下列反应中,属于分解反应的是( B )
知识点三 氧气的工业制法
阅读教材P40的资料卡片,了解工业上是如何大量制取氧气的。
(1)原料:空气
(2)方法:
①分离液态空气法
利用空气各成分的沸点不同,通过先液化空气,再蒸发分离制取。
②膜分离技术法
将空气通过富集氧气功能的薄膜,即可得到含氧气量较高的空气,用该膜进行多级分离,可得到90%以上的富氧空气。
课堂小结
一、氧气的实验室制法
1.制取药品及原理; 2.催化剂 3.分解反应
二、氧气的工业制法
1.液化蒸发空气法 2.膜分离技术法
课时达标
1.下列药品不能用于实验室制取氧气的是( )
A.高锰酸钾 B.过氧化氢 C.氯化钾 D.氯酸钾
2.实现“低碳经济”的一种策略是节约能源。如图所示的四种制取氧气的方法中最节能的是( )
A.① B.② C.③ D.④
3.研究表明,许多金属氧化物对氯酸钾的分解有催化作用。下表是不同金属氧化物作催化剂,氯酸钾剧烈反应时的温度:
氧化物 氧化铁 氧化铝 氧化铜 氧化镁
剧烈反应的温度/℃ 490 540 350 546
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用( )
A.氧化铁 B.氧化铝 C.氧化铜 D.氧化镁
4.有一种暗紫色固体A,加热后生成无色气体B,B能使带火星的木条复燃。非金属固体C在B中燃烧产生刺激性气味的气体。金属D在B中燃烧,火星四射,生成一种黑色固体E。请按要求回答下列问题:
(1)写出下列物质的名称:B__________、C__________、E__________。
(2)写出加热A生成B的文字表达式:____________________,此基本反应类型属于________________。
(3)D在B中燃烧的文字表达式为:______________________________,此基本反应类型属于________________。
课后作业
A 双基过关
1. 下列方法均可用于制取氧气,其中属于物理变化的是( )。
A. 蒸发液态空气 B. 加热高锰酸钾 C. 分解过氧化氢溶液 D. 加热氧化汞
2. 实现“低碳经济”的一种策略是节约能源。如图所示的四种制取氧气的方法中最节能的是( )。
A. ① B. ② C. ③ D. ④
3. 分解过氧化氢溶液制取氧气,加入二氧化锰的目的是( )。
A. 制取更多的氧气
B. 不加入二氧化锰,过氧化氢不能生成氧气
C. 加入二氧化锰,过氧化氢不需要加热就能生成氧气
D. 加入二氧化锰,提高制取氧气的纯度
4. 加热氯酸钾制取氧气时忘了加入二氧化锰,结果是( )。
A. 根本无法生成氧气
B. 产生氧气的总质量减小
C. 产生氧气速率慢
D. 没有水生成
5. 某同学加热氯酸钾制氧气,错把高锰酸钾当作二氧化锰放入氯酸钾内,其结果与只加热氯酸钾相比,正确的是( )。
A. 反应速率不变 B. 反应速率加快,生成氧气质量不变
C. 生成氧气质量减少 D. 反应速率加快,生成氧气质量增加
6. 下列反应属于分解反应的是( )。
A. 铁 + 氧气 四氧化三铁 B. 甲烷 + 氧气 二氧化碳 + 水
C. 过氧化氢 水 + 氧气 D. 铁 + 硫酸铜 铜 + 硫酸亚铁
7. 下列对催化剂描述正确的是( )。
A. 任何化学反应都需要催化剂
B. 催化剂在反应前后本身的质量发生了变化
C. 只有分解反应才需要催化剂
D. 某些化学反应可以有多种催化剂
8. 研究表明,许多金属氧化物对氯酸钾的分解有催化作用。下表是不同金属氧化物作催化剂,氯酸钾剧烈反应时的温度。
氧化物 氧化铁 氧化铝 氧化铜 氧化镁
剧烈反应的温度/℃ 490 540 350 546
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用( )。
A. 氧化铁 B. 氧化铝 C. 氧化铜 D. 氧化镁
9. 实验室制取氧气与工业制取氧气比较,下列叙述正确的是( )。
A. 生产原料不同 B. 制取产物完全不同
C. 都是化学反应 D. 都利用了物质的化学性质
10. 有A,B,C,D四种物质,B是暗红色固体,在空气中能剧烈燃烧,产生大量白烟;C能在无色气体A中燃烧并发出蓝紫色火焰;将燃着的木条伸入无色无味气体D中,木条立刻熄灭,向D中加入澄清的石灰水中,石灰水变浑浊。由此可推断:
(1)写出物质的名称:A___________,B___________, C_____________ D_____________。
(2)写出下列转化的文字表达式:B→C___________________________。
B能力提高
淀粉酶可以将人体不能直接吸收的淀粉转变成易吸收的小分子物质。下图是淀粉酶对淀粉作用过程的示意图,对该过程的表述错误的是( )。
A. 酶起催化作用
B. 是物理变化
C. 是化学变化
D. 酶的化学性质没有改变
12. 某同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
实验步骤 实验现象 实验结论
①将等体积的两种无色液体分别加入A、B两个试管中;②分别向A、B两试管中同时加入等质量的________________,观察现象 A试管中__________;B试管中有气泡产生 A试管中的无色液体是_______________;B试管中的无色液体是______________
(1)B试管中发生反应的文字表达式:_______________________________。
(2)如何验证B试管中产生的气体?(写出操作步骤、实验现象和结论)
____________________________________________________________________。
参考答案
课堂导练
① 有气泡产生 ② 带火星的木条复燃 ③有气泡产生,火星的木条不复燃 ④没有气泡产生,带火星的木条不复燃 ⑤有大量气泡产生,带火星的木条复燃 ⑥过氧化氢溶液常温下分解速率慢 ⑦二氧化锰能加快过氧化氢溶液的分解速率 ⑧改变 ⑨ 质量 ⑩化学性质 催化作用 对比 过氧化氢水+氧气 取质量相同的两份氯酸钾,一份不加二氧化锰,一份加少量二氧化锰,同时进行实验 取反应后分离得到的二氧化锰,加入锰酸钾中,再次进行实验 反应物只有一种,生成物有多种 反应物 两种 两种以上 一变多 A→B+C+……
变式训练
1.B 2.②④⑥ 3. B 4. B
课时达标
1.C 2.C 3.C 4.(1)氧气、硫、四氧化三铁 (2)高锰酸钾锰酸钾+二氧化锰+氧气,分解反应 (3)铁+氧气四氧化三铁 化合反应
课后作业
A 双基过关
1. A 2. C 3. C 4. C 5. D 6. C 7. D 8. C 9. A
10. (1)O2;Fe ;S ;CO2
(2)铁+氧气四氧化三铁
B 能力提高
11. B
12. 二氧化锰 无明显现象 水 双氧水
(1)过氧化氢 水 + 氧气
(2) 将带火星的木条伸入试管B中,若木条复燃,则是氧气
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
