高一年级化学必修一苏教版 氯气生产原理
文档属性
| 名称 | 高一年级化学必修一苏教版 氯气生产原理 |  | |
| 格式 | zip | ||
| 文件大小 | 809.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-22 14:23:26 | ||
图片预览








文档简介
课件21张PPT。专题2 从海水中获得的化学物质氯气的生产原理第一单元 氯、溴、碘及其化合物你知道浩瀚的大海中究竟蕴藏着哪些物质吗?请阅读书P40阅读研究2、溴元素:被称为“海洋元素”3、碘元素:总量可达到8×1010 t海水中的资源
1、氯化物:主要为氯化钠,其次是氯化镁、
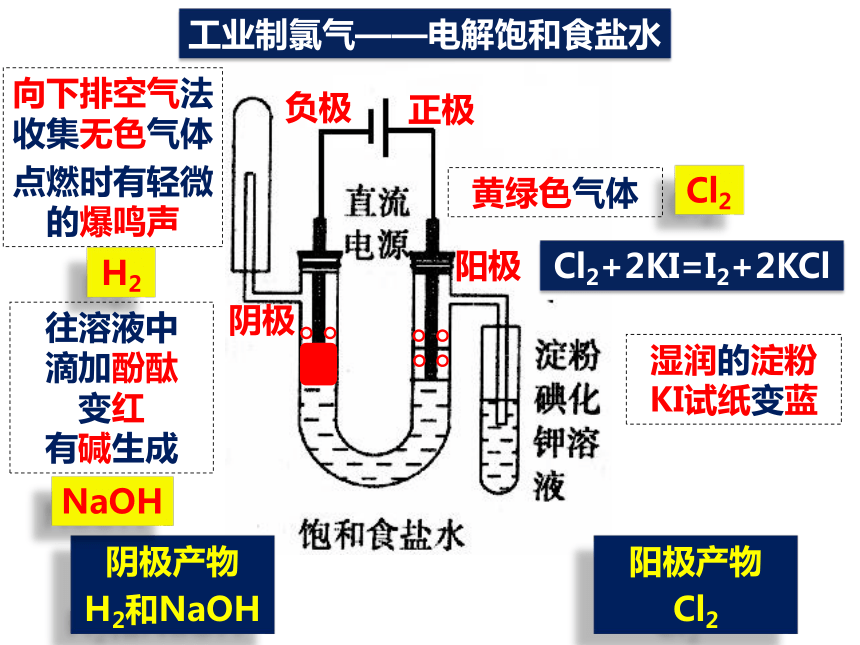
氯化钙和氯化钾知识回顾如何从海水中获得NaCl?如何进行粗盐的精制?(含泥沙、Mg2+、Ca2+、SO42-)思考:NaCl俗名“食盐”,它有哪些用途呢?2、医学:浓度为0.9%的为“生理食盐水”4、工业:电解饱和食盐水制取Cl21、日常生活: 是必需调味品.3、公路上的积雪也可以用氯化钠来消除你知道吗?向下排空气法收集无色气体
点燃时有轻微的爆鸣声H2黄绿色气体Cl2工业制氯气——电解饱和食盐水往溶液中
滴加酚酞
变红
有碱生成Cl2+2KI=I2+2KCl湿润的淀粉KI试纸变蓝负极阴极正极阳极阴极产物
H2和NaOH阳极产物
Cl2NaOH两极均产生气泡通电后有新的气体物质生成将铁棒上方收集到的气体靠近火焰,有轻微的爆鸣声有氢气生成黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝有氯气生成铁棒周围的颜色变红有碱性物质生成工业制氯气——电解饱和食盐水1、关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.在阳极附近的溶液中滴入淀粉KI溶液,溶液呈蓝色
C.在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解溶液转移到烧杯中充分搅拌,溶液呈中性
B2、下列装置中能验证氯化钠溶液(含酚酞)电解产物的装置是(电极均为石墨)( )DMnO2 + HCl(稀)MnO2 + HCl(浓)MnO2 + HCl(浓)黄绿色气体
且有强烈的刺激性1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)时发现:MnO2 + HCl(稀)实验室制氯气MnO2 + 4HCl(浓)== MnCl2 + Cl2 ↑ + 2H2O黑色固体液体需要加热气体烧瓶分液漏斗酒精灯集气瓶石棉网洗气瓶【思考】:
1、实验室制取Cl2时,可用什么方法收集Cl2?Cl2在饱和NaCl溶液中的溶解度很小【思考】:
2、如何判定集气瓶中的Cl2已经收集满?Cl2+2KI=I2+2KCl集气瓶口能使湿润的淀粉KI试纸变蓝,或者,观察集气瓶中气体的颜色,是否呈
黄绿色。【思考】:
3、多余的Cl2能否直接排放于空气中?应该如何处理?Cl2有强烈的刺激性气味,有毒,
会污染大气。
可以用碱液加以吸收。
如NaOH溶液,反应的方程式如下:
Cl2+2NaOH=NaClO+NaCl+H2O
但不能用澄清石灰水
(浓度太小,无法充分吸收Cl2)浓盐酸MnO2Cl2分液漏斗圆底烧瓶石棉网注意:长进短出酒精灯NaOH溶液这样收集的氯气含有什么杂质?浓盐酸易挥发 问题一:如何除去Cl2中的HCl杂质?希望能找到一种物质,可以除去HCl,但又不会减小Cl2的损失。HClH2O加热时水蒸气易挥发饱和NaCl溶液这样收集的氯气含有什么杂质?浓盐酸易挥发 问题二:如何除去Cl2中的H2O杂质?希望能找到一种物质,可以除去H2O,但又不会减小Cl2的损失。HClH2O加热时水蒸气易挥发浓硫酸实验室制氯气① 仪器:分液漏斗、圆底烧瓶、铁架台、石棉网、酒精灯,集气瓶、烧杯、导管、双孔橡皮塞等 ② 药品:MnO2固体、浓HCl③反应原理:④发生装置:固-液加热型⑤收集装置:向上排气或排饱和食盐水⑥净化装置:⑦尾气吸收装置:⑧注意事项:A、浓盐酸易挥发……B、操作:先验密,后实验;先固体,后液体; 先撤管,后撤灯;先除杂,后收集发生装置净化装置收集装置尾气处理装置实验室制备干燥纯净氯气的装置图Cl2的制法(1)工业制法
——电解饱和食盐水
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
“氯碱工业”
(2)实验室制法
MnO2+4HCl == MnCl2+Cl2 + H2O△(浓)通电2这样书写有什么问题吗?这样书写有什么问题吗?↑常见气体的发生装置
1、氯化物:主要为氯化钠,其次是氯化镁、
氯化钙和氯化钾知识回顾如何从海水中获得NaCl?如何进行粗盐的精制?(含泥沙、Mg2+、Ca2+、SO42-)思考:NaCl俗名“食盐”,它有哪些用途呢?2、医学:浓度为0.9%的为“生理食盐水”4、工业:电解饱和食盐水制取Cl21、日常生活: 是必需调味品.3、公路上的积雪也可以用氯化钠来消除你知道吗?向下排空气法收集无色气体
点燃时有轻微的爆鸣声H2黄绿色气体Cl2工业制氯气——电解饱和食盐水往溶液中
滴加酚酞
变红
有碱生成Cl2+2KI=I2+2KCl湿润的淀粉KI试纸变蓝负极阴极正极阳极阴极产物
H2和NaOH阳极产物
Cl2NaOH两极均产生气泡通电后有新的气体物质生成将铁棒上方收集到的气体靠近火焰,有轻微的爆鸣声有氢气生成黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝有氯气生成铁棒周围的颜色变红有碱性物质生成工业制氯气——电解饱和食盐水1、关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.在阳极附近的溶液中滴入淀粉KI溶液,溶液呈蓝色
C.在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解溶液转移到烧杯中充分搅拌,溶液呈中性
B2、下列装置中能验证氯化钠溶液(含酚酞)电解产物的装置是(电极均为石墨)( )DMnO2 + HCl(稀)MnO2 + HCl(浓)MnO2 + HCl(浓)黄绿色气体
且有强烈的刺激性1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)时发现:MnO2 + HCl(稀)实验室制氯气MnO2 + 4HCl(浓)== MnCl2 + Cl2 ↑ + 2H2O黑色固体液体需要加热气体烧瓶分液漏斗酒精灯集气瓶石棉网洗气瓶【思考】:
1、实验室制取Cl2时,可用什么方法收集Cl2?Cl2在饱和NaCl溶液中的溶解度很小【思考】:
2、如何判定集气瓶中的Cl2已经收集满?Cl2+2KI=I2+2KCl集气瓶口能使湿润的淀粉KI试纸变蓝,或者,观察集气瓶中气体的颜色,是否呈
黄绿色。【思考】:
3、多余的Cl2能否直接排放于空气中?应该如何处理?Cl2有强烈的刺激性气味,有毒,
会污染大气。
可以用碱液加以吸收。
如NaOH溶液,反应的方程式如下:
Cl2+2NaOH=NaClO+NaCl+H2O
但不能用澄清石灰水
(浓度太小,无法充分吸收Cl2)浓盐酸MnO2Cl2分液漏斗圆底烧瓶石棉网注意:长进短出酒精灯NaOH溶液这样收集的氯气含有什么杂质?浓盐酸易挥发 问题一:如何除去Cl2中的HCl杂质?希望能找到一种物质,可以除去HCl,但又不会减小Cl2的损失。HClH2O加热时水蒸气易挥发饱和NaCl溶液这样收集的氯气含有什么杂质?浓盐酸易挥发 问题二:如何除去Cl2中的H2O杂质?希望能找到一种物质,可以除去H2O,但又不会减小Cl2的损失。HClH2O加热时水蒸气易挥发浓硫酸实验室制氯气① 仪器:分液漏斗、圆底烧瓶、铁架台、石棉网、酒精灯,集气瓶、烧杯、导管、双孔橡皮塞等 ② 药品:MnO2固体、浓HCl③反应原理:④发生装置:固-液加热型⑤收集装置:向上排气或排饱和食盐水⑥净化装置:⑦尾气吸收装置:⑧注意事项:A、浓盐酸易挥发……B、操作:先验密,后实验;先固体,后液体; 先撤管,后撤灯;先除杂,后收集发生装置净化装置收集装置尾气处理装置实验室制备干燥纯净氯气的装置图Cl2的制法(1)工业制法
——电解饱和食盐水
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
“氯碱工业”
(2)实验室制法
MnO2+4HCl == MnCl2+Cl2 + H2O△(浓)通电2这样书写有什么问题吗?这样书写有什么问题吗?↑常见气体的发生装置
