高中化学苏教版必修一专题1 第三单元 人类对原子结构的认识 教学课件(34张)
文档属性
| 名称 | 高中化学苏教版必修一专题1 第三单元 人类对原子结构的认识 教学课件(34张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-23 19:50:19 | ||
图片预览








文档简介
课件34张PPT。化学家眼中的物质世界第三单元
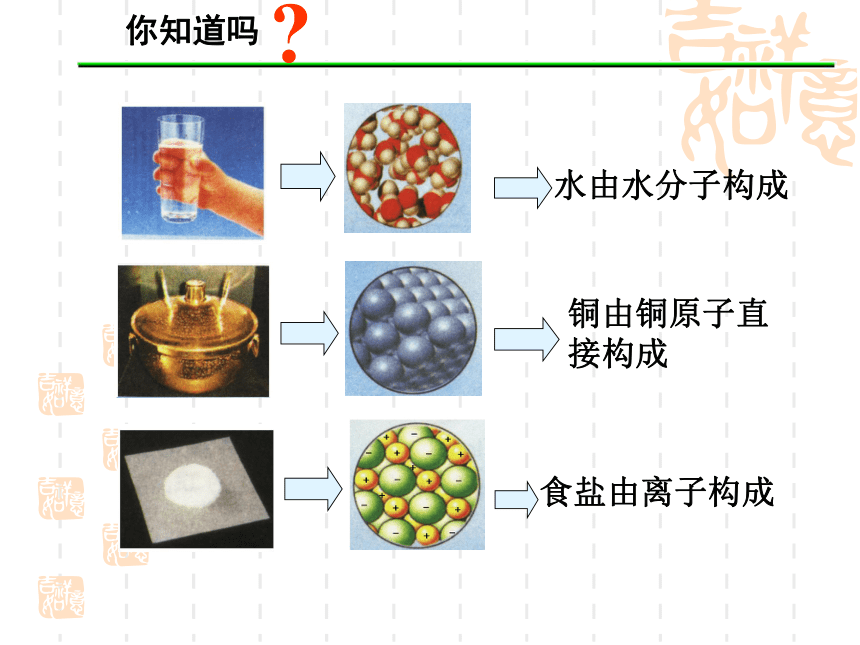
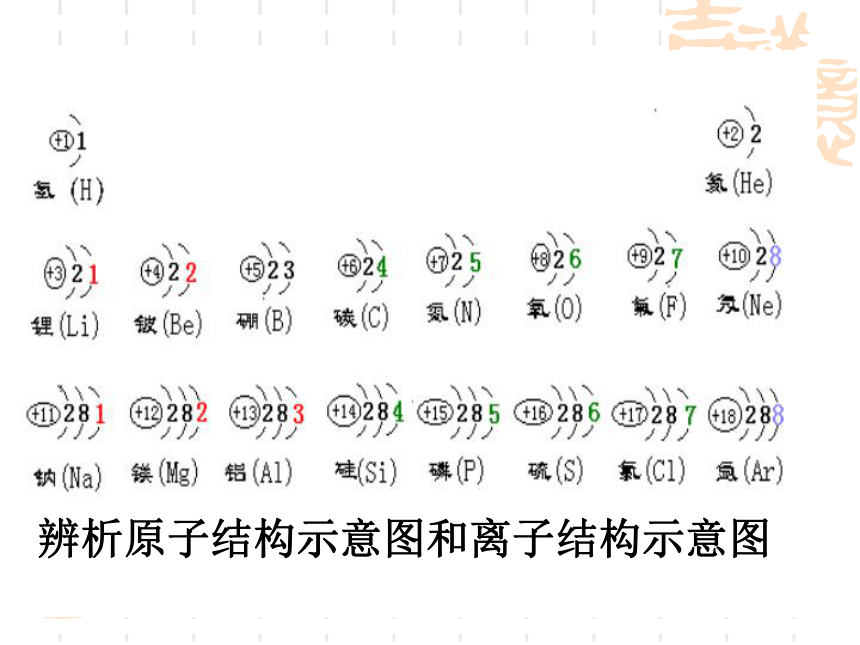
人类对原子结构的认识你知道吗?下列说法正确吗?为什么?1.分子是保持物质化学性质的最小微粒.2.原子是化学反应中的最小微粒.3.化学变化中,分子可以再分,原子不能再分我们前辈是如何认识原子的? 历 史1、公元前5世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子。一、原子结构模型的演变 道尔顿原子模型(1803年):原子是实心球“葡萄干面包式”原子结构模型带核的原子结构模型分层模型量子力学模型+15第1层第2层第3层2851.原子结构示意图 人们常用原子结构示意图表示原子的核外电子排布.二、原子核外电子排布辨析原子结构示意图和离子结构示意图
2.原子结构与元素性质的关系(结构决定性质)(1)稳定结构:
(如He、Ne、Ar等)即最外层为8电子的结构(K层为2个)
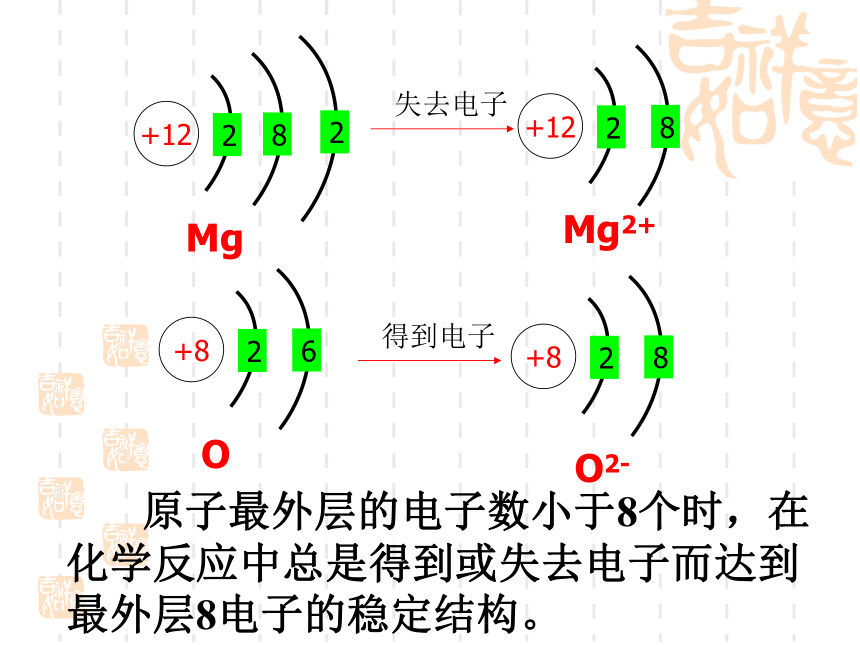
特点:原子既不容易失去电子又不容易得到电子失去电子得到电子 原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数<4时,容易失去电子最外层电子数>4时,容易得到电子在化学反应中,原子核不发生变化的,但
原子的最外层电子可能会发生变化。⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 发 发生变化,元素的化学性质主要决定于原子结构中的 。【交流与讨论】
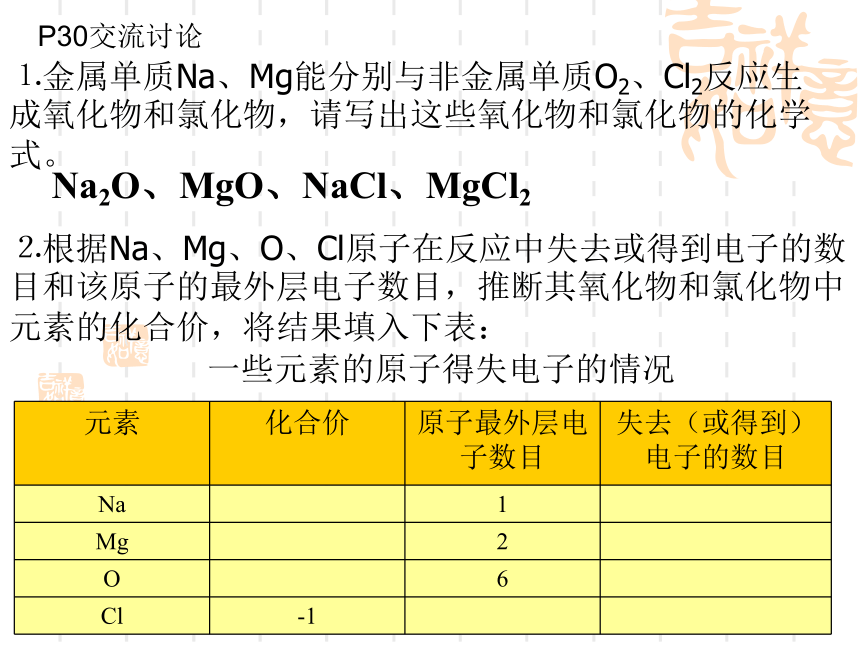
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:
一些元素的原子得失电子的情况
Na2O、MgO、NaCl、MgCl2P30交流讨论3.金属和非金属的化合价失电子得电子正 价失电子数负 价得电子数三、原子及原子核1.表1 几种原子的构成核电荷数 =质子数= 电子数 = 原子序数原子: 离子的电性?阳离子:核电荷数 =质子数﹥电子数
质子数=电子数+电荷绝对值阴离子:核电荷数 =质子数﹤电子数
质子数=电子数-电荷绝对值 2. 表2 构成原子的粒子及其性质1/18361.0071.008相对质量质量数(A)= 质子数(Z)+ 中子数(N)
质量数(A) = 原子的近似相对原子质量
原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。——元素符号质量数 —— 核电荷数 ——
(核内质子数)3.表示原子组成的一种方法 Z 决定元素种类
Z N决定原子种类
a——代表质量数
b——代表质子数或核电荷数
c——代表离子所带电荷数
d——代表化合价
e——代表原子个数
a、b、c、d、e 各表示什么?离子(B)2.已知某元素相对原子质量为227、
中子数为138,则质子数为
A. 416 B. 89 C. 227 D. 203练习3.关于 Cl叙述错误的是
A.质量数为37 B.中子数为20
C.电子数为17 D.相对原子质量为35.5
3717(D)4.某金属原子符号为 X,该原子原子核内
中子数与质子数之差为
A. 32 B. 67 C. 99 D. 166(A)练习5.下列粒子中与NH4+具有相同质子数和电
子数的是
A. Na+ B. F- C. OH- D. H2O
(A)练习7、某元素的某种离子X2-核外共有a个电子,核内有b个中子,表示该X原子的下列符号中正确的是练习2.已知X,Y原子的核电荷数分别为a和b,Xm+和Yn-的核外电子排布相同,下列正确的是:
A a=b+m+n B a=b-m+n
C a=b+m-n D a=b-n-m练习(A)1、核电荷数分别为16的元素和4的元素的原子相比较,前者的下列数据是后者的4倍的是
A 电子数 B 最外层电子数
C 电子层数 D 次外层电子数 (AD)学以致用用 AZX表示原子:
1.求中性原子的中子数:N=
2.求阴离子的中子数,AXn-共有x个电子,则N=
3.求阳离子的中子数,AXn+共有x个电子,则N=
4.求中性分子或原子团的中子数,1H216O分子中,N=
③阴离子:核外有10个电子的微粒①分子:②阳离子:Ne、HF、H2O、NH3、CH4Na+、Mg2+、Al3+、NH4+、H3O+N3-、O2-、F-、OH-、NH2-能力考查3.已知R2+核内共有N个中子,R的质量数
为A,m g R2+中含电子的物质的量为
A. mol
B. mol
C. mol
D. mol(D)能力考查练习:
符合示意图 的粒子不
可能是
A、Ar B、k+ C、Cl- D、Cl 道尔顿原子模型 (实心球) 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。历 史 足 迹1904汤姆生提出了原子结构的 (发现了电子)
“葡萄干面包式模型”原子是一个平均分布着正电荷的阳极球,其中均匀镶嵌着许多电子,中和了电荷,从而形成了中性原子。 卢瑟福原子模型 (空心球) 1911年,英国物理学家卢瑟福根据α粒子散射现象认识到原子是由原子核和核外电子构成.电子在核周围做高速运动,就像行星围绕太阳运转一样。 玻尔原子模型 1913年丹麦物理学家玻尔提出,原子核外,电子在一系列稳定的轨道上运动。 电 子 云现代原子结构学说量子力学模型(1926年)
人类对原子结构的认识你知道吗?下列说法正确吗?为什么?1.分子是保持物质化学性质的最小微粒.2.原子是化学反应中的最小微粒.3.化学变化中,分子可以再分,原子不能再分我们前辈是如何认识原子的? 历 史1、公元前5世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子。一、原子结构模型的演变 道尔顿原子模型(1803年):原子是实心球“葡萄干面包式”原子结构模型带核的原子结构模型分层模型量子力学模型+15第1层第2层第3层2851.原子结构示意图 人们常用原子结构示意图表示原子的核外电子排布.二、原子核外电子排布辨析原子结构示意图和离子结构示意图
2.原子结构与元素性质的关系(结构决定性质)(1)稳定结构:
(如He、Ne、Ar等)即最外层为8电子的结构(K层为2个)
特点:原子既不容易失去电子又不容易得到电子失去电子得到电子 原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数<4时,容易失去电子最外层电子数>4时,容易得到电子在化学反应中,原子核不发生变化的,但
原子的最外层电子可能会发生变化。⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 发 发生变化,元素的化学性质主要决定于原子结构中的 。【交流与讨论】
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:
一些元素的原子得失电子的情况
Na2O、MgO、NaCl、MgCl2P30交流讨论3.金属和非金属的化合价失电子得电子正 价失电子数负 价得电子数三、原子及原子核1.表1 几种原子的构成核电荷数 =质子数= 电子数 = 原子序数原子: 离子的电性?阳离子:核电荷数 =质子数﹥电子数
质子数=电子数+电荷绝对值阴离子:核电荷数 =质子数﹤电子数
质子数=电子数-电荷绝对值 2. 表2 构成原子的粒子及其性质1/18361.0071.008相对质量质量数(A)= 质子数(Z)+ 中子数(N)
质量数(A) = 原子的近似相对原子质量
原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。——元素符号质量数 —— 核电荷数 ——
(核内质子数)3.表示原子组成的一种方法 Z 决定元素种类
Z N决定原子种类
a——代表质量数
b——代表质子数或核电荷数
c——代表离子所带电荷数
d——代表化合价
e——代表原子个数
a、b、c、d、e 各表示什么?离子(B)2.已知某元素相对原子质量为227、
中子数为138,则质子数为
A. 416 B. 89 C. 227 D. 203练习3.关于 Cl叙述错误的是
A.质量数为37 B.中子数为20
C.电子数为17 D.相对原子质量为35.5
3717(D)4.某金属原子符号为 X,该原子原子核内
中子数与质子数之差为
A. 32 B. 67 C. 99 D. 166(A)练习5.下列粒子中与NH4+具有相同质子数和电
子数的是
A. Na+ B. F- C. OH- D. H2O
(A)练习7、某元素的某种离子X2-核外共有a个电子,核内有b个中子,表示该X原子的下列符号中正确的是练习2.已知X,Y原子的核电荷数分别为a和b,Xm+和Yn-的核外电子排布相同,下列正确的是:
A a=b+m+n B a=b-m+n
C a=b+m-n D a=b-n-m练习(A)1、核电荷数分别为16的元素和4的元素的原子相比较,前者的下列数据是后者的4倍的是
A 电子数 B 最外层电子数
C 电子层数 D 次外层电子数 (AD)学以致用用 AZX表示原子:
1.求中性原子的中子数:N=
2.求阴离子的中子数,AXn-共有x个电子,则N=
3.求阳离子的中子数,AXn+共有x个电子,则N=
4.求中性分子或原子团的中子数,1H216O分子中,N=
③阴离子:核外有10个电子的微粒①分子:②阳离子:Ne、HF、H2O、NH3、CH4Na+、Mg2+、Al3+、NH4+、H3O+N3-、O2-、F-、OH-、NH2-能力考查3.已知R2+核内共有N个中子,R的质量数
为A,m g R2+中含电子的物质的量为
A. mol
B. mol
C. mol
D. mol(D)能力考查练习:
符合示意图 的粒子不
可能是
A、Ar B、k+ C、Cl- D、Cl 道尔顿原子模型 (实心球) 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。历 史 足 迹1904汤姆生提出了原子结构的 (发现了电子)
“葡萄干面包式模型”原子是一个平均分布着正电荷的阳极球,其中均匀镶嵌着许多电子,中和了电荷,从而形成了中性原子。 卢瑟福原子模型 (空心球) 1911年,英国物理学家卢瑟福根据α粒子散射现象认识到原子是由原子核和核外电子构成.电子在核周围做高速运动,就像行星围绕太阳运转一样。 玻尔原子模型 1913年丹麦物理学家玻尔提出,原子核外,电子在一系列稳定的轨道上运动。 电 子 云现代原子结构学说量子力学模型(1926年)
