高中化学苏教版>必修一专题1第三单元 人类对原子结构的认识(26张)
文档属性
| 名称 | 高中化学苏教版>必修一专题1第三单元 人类对原子结构的认识(26张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-23 19:59:20 | ||
图片预览








文档简介
课件26张PPT。专题一 化学家眼中的物质世界
第三单元 人类对原子结构的认识
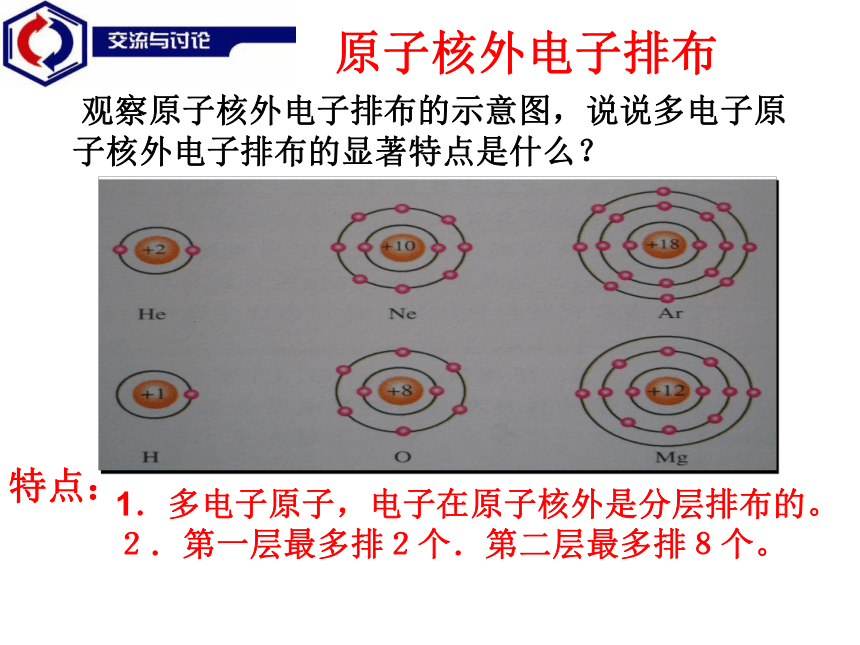
原子核外电子排布 为什么各种元素会形成不同的化合价呢,它的形成又和什么有关系呢? 为什么氧化镁的化学式为MgO,而氯化镁的化学式为MgCl2呢?你知道吗?人类对原子结构的认识原子核外电子排布三维目标1.知识与技能:了解钠、镁、氧等常见元素原子的核外电子分层排布的情况。知道原子在反应过程中常通过电子得失使最外层达到8或2电子稳定结构的事实。了解元素化合价和原子核外电子排布的关系。
2.过程与方法:采用学生自主讨论的方法,多创设情境让学生自主学习、自主得出结论。通过交流讨论,认识原子结构与物质发生化学反应变化的关系。
3.情感态度价值观:体验和感受化学研究和认识物质的科学方法,了解化学学科研究的主要内容和基本方法。从而增强学习化学的兴趣。请你说一说你对原子结构的初步认识?回顾初三核电荷数=质子数=核外电子数 观察原子核外电子排布的示意图,说说多电子原子核外电子排布的显著特点是什么?特点:1.多电子原子,电子在原子核外是分层排布的。2.第一层最多排2个.第二层最多排8个。原子核外电子排布 原子中的电子总是处在原子核的引力场中。在多电子原子中,电子的能量是不相同的。在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。这样的现象类似于地球的万物处于地心的引力场中,只有具有较高能量的物体才能摆脱地球引力的束缚。资料卡一 自然界有一个普遍的规律,那就是“能量越低越稳定”。
电子总是优先占据能量较低的区域,这样能使整个原子体系的能量处于最低,从而促使原子的稳定存在。
所以电子总是尽可能地先从内层排起,当一层充满后再填充下一层。资料卡二分层排布 K L M N O P Q …电子层符号低 → 高能量高低 1 2 3 4 5 6 7 …电子层(n)近 → 远离核距离原子结构示意图 仔细观察,说说各个符号分别表示什么意思?①③②④ 根据图示,请写出各原子的原子结构示意图。小试牛刀资料卡三:1~18号元素的原子结构示意图1.金属元素与非金属元素最外层电子数各有什么特点?
2.观察各元素的最外层电子数,你又发现什么规律?观察20号元素钙,26号铁元素的原子结构示意图,与1-18元素的原子结构示意图进行比较. 人们在认识客观物质的过程中总是从简单到复杂,从表面到本质。
人们认识客观规律的过程总是从“发现问题”到“解决问题”再到“新问题的发现”,在周而复始中螺旋上升,所以认识是有阶段性的,学习也是有阶段性的。拓展视野资料卡四:稀有气体元素的原子核外电子排布最外层达到8个电子(第一层为最外层为2个),称为稳定结构。在化学反应的过程中,各原子会通过不同方式,最终达到稳定结构。(P29)请同学们认真阅读书本29页的问题解决讨论以下几个问题:
1.镁原子和氧原子在反应过程中为什么要变成相应的离子?
2.镁原子和氧原子在反应过程中分别通过怎样的方式变成
相应离子的?
3.在化学反应的过程中,原子的结构发生了怎样的变化?元素化学性质与最外层电子关系在化学反应过程中,原子核不发生变化,但原子的最外层电子发生了变化。元素的化学性质主要取决于最外层电子结构决定性质整理与归纳用原子结构示意图表示镁原子和氧原子结合成氧化镁的过程。 用原子结构示意图表示钠原子和氯原子结合成氯化钠的过程。趁热打铁氯化钠的形成过程e-ClNaCl -Na+ Na、Mg、Al等活泼金属单质与F2、O2、Cl2等活泼
非金属单质发生反应生成的化合物中,金属元素和非
金属元素的化合价与其在反应中失去或得到电子的数
目存在一定的关系。请与同学共同探究下列问题。
1. 金属单质 Na、Mg能分别与非金属单质O2、Cl2
反应生成氧化物和氯化物,请写出这些氧化物和氯化
物的化学式。
——————————————————————
Na2O NaCl MgO MgCl2(P30)2.根据 Na、Mg、 O、Cl原子在反应过程中失去或
得到电子的数目及其最外层电子数目,推断其氧化物
和氯化物的化合价,将结果填入表1-6.表1-6 一些元素的原子得失电子的情况26-1元素的化合价与原子的最外层电子数有着怎样的关系?
与得失电子的数目呢?问题解决①金属最外层电子数﹤4时,易失去电子(化合价=+失去的电子数目)②非金属最外层电子数≥4时,易得到电子(化合价=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负) 为什么各种元素会形成各种不同的化合价,它的形成究竟和什么有关?问题解决现在你能解决课前的问题了吗?⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 _____发生变化,元素的化学性质主要决定于原子结构中的 。回顾与总结对照1-18元素的原子结构示意图,结合本节课所学知识,试画出下列各微粒的结构示意图:
(1)与氖原子电子层结构相同的—2价阴离子: 。
(2)最外层电子数为次外层电子数2倍的原子: 。
(3)L层电子数为K层、M层电子数之和的原子: 。
(4)与氖原子电子层结构相同的+1价阳离子 : 。研究性学习
第三单元 人类对原子结构的认识
原子核外电子排布 为什么各种元素会形成不同的化合价呢,它的形成又和什么有关系呢? 为什么氧化镁的化学式为MgO,而氯化镁的化学式为MgCl2呢?你知道吗?人类对原子结构的认识原子核外电子排布三维目标1.知识与技能:了解钠、镁、氧等常见元素原子的核外电子分层排布的情况。知道原子在反应过程中常通过电子得失使最外层达到8或2电子稳定结构的事实。了解元素化合价和原子核外电子排布的关系。
2.过程与方法:采用学生自主讨论的方法,多创设情境让学生自主学习、自主得出结论。通过交流讨论,认识原子结构与物质发生化学反应变化的关系。
3.情感态度价值观:体验和感受化学研究和认识物质的科学方法,了解化学学科研究的主要内容和基本方法。从而增强学习化学的兴趣。请你说一说你对原子结构的初步认识?回顾初三核电荷数=质子数=核外电子数 观察原子核外电子排布的示意图,说说多电子原子核外电子排布的显著特点是什么?特点:1.多电子原子,电子在原子核外是分层排布的。2.第一层最多排2个.第二层最多排8个。原子核外电子排布 原子中的电子总是处在原子核的引力场中。在多电子原子中,电子的能量是不相同的。在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。这样的现象类似于地球的万物处于地心的引力场中,只有具有较高能量的物体才能摆脱地球引力的束缚。资料卡一 自然界有一个普遍的规律,那就是“能量越低越稳定”。
电子总是优先占据能量较低的区域,这样能使整个原子体系的能量处于最低,从而促使原子的稳定存在。
所以电子总是尽可能地先从内层排起,当一层充满后再填充下一层。资料卡二分层排布 K L M N O P Q …电子层符号低 → 高能量高低 1 2 3 4 5 6 7 …电子层(n)近 → 远离核距离原子结构示意图 仔细观察,说说各个符号分别表示什么意思?①③②④ 根据图示,请写出各原子的原子结构示意图。小试牛刀资料卡三:1~18号元素的原子结构示意图1.金属元素与非金属元素最外层电子数各有什么特点?
2.观察各元素的最外层电子数,你又发现什么规律?观察20号元素钙,26号铁元素的原子结构示意图,与1-18元素的原子结构示意图进行比较. 人们在认识客观物质的过程中总是从简单到复杂,从表面到本质。
人们认识客观规律的过程总是从“发现问题”到“解决问题”再到“新问题的发现”,在周而复始中螺旋上升,所以认识是有阶段性的,学习也是有阶段性的。拓展视野资料卡四:稀有气体元素的原子核外电子排布最外层达到8个电子(第一层为最外层为2个),称为稳定结构。在化学反应的过程中,各原子会通过不同方式,最终达到稳定结构。(P29)请同学们认真阅读书本29页的问题解决讨论以下几个问题:
1.镁原子和氧原子在反应过程中为什么要变成相应的离子?
2.镁原子和氧原子在反应过程中分别通过怎样的方式变成
相应离子的?
3.在化学反应的过程中,原子的结构发生了怎样的变化?元素化学性质与最外层电子关系在化学反应过程中,原子核不发生变化,但原子的最外层电子发生了变化。元素的化学性质主要取决于最外层电子结构决定性质整理与归纳用原子结构示意图表示镁原子和氧原子结合成氧化镁的过程。 用原子结构示意图表示钠原子和氯原子结合成氯化钠的过程。趁热打铁氯化钠的形成过程e-ClNaCl -Na+ Na、Mg、Al等活泼金属单质与F2、O2、Cl2等活泼
非金属单质发生反应生成的化合物中,金属元素和非
金属元素的化合价与其在反应中失去或得到电子的数
目存在一定的关系。请与同学共同探究下列问题。
1. 金属单质 Na、Mg能分别与非金属单质O2、Cl2
反应生成氧化物和氯化物,请写出这些氧化物和氯化
物的化学式。
——————————————————————
Na2O NaCl MgO MgCl2(P30)2.根据 Na、Mg、 O、Cl原子在反应过程中失去或
得到电子的数目及其最外层电子数目,推断其氧化物
和氯化物的化合价,将结果填入表1-6.表1-6 一些元素的原子得失电子的情况26-1元素的化合价与原子的最外层电子数有着怎样的关系?
与得失电子的数目呢?问题解决①金属最外层电子数﹤4时,易失去电子(化合价=+失去的电子数目)②非金属最外层电子数≥4时,易得到电子(化合价=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负) 为什么各种元素会形成各种不同的化合价,它的形成究竟和什么有关?问题解决现在你能解决课前的问题了吗?⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 _____发生变化,元素的化学性质主要决定于原子结构中的 。回顾与总结对照1-18元素的原子结构示意图,结合本节课所学知识,试画出下列各微粒的结构示意图:
(1)与氖原子电子层结构相同的—2价阴离子: 。
(2)最外层电子数为次外层电子数2倍的原子: 。
(3)L层电子数为K层、M层电子数之和的原子: 。
(4)与氖原子电子层结构相同的+1价阳离子 : 。研究性学习
