鲁教版化学九上 第二单元 第四节 元素(同步提优学案)
文档属性
| 名称 | 鲁教版化学九上 第二单元 第四节 元素(同步提优学案) |  | |
| 格式 | doc | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-30 11:28:53 | ||
图片预览




文档简介
21世纪教育网 –中小学教育资源及组卷应用平台
第四节 元素
学习目标 中考考点关注
理解元素的概念,将物质的宏观组成与微观构成联系起来(难点)熟记常见元素符号及地壳中元素含量,掌握元素符号的写法和意义,(重点)能准确判断单质和化合物(重点)学会从元素周期表中获得信息(重点) 元素的概念(高频考点)判断物质的类别(必考点)元素符号及意义(必考点)元素周期(必考点)
教材知识精析
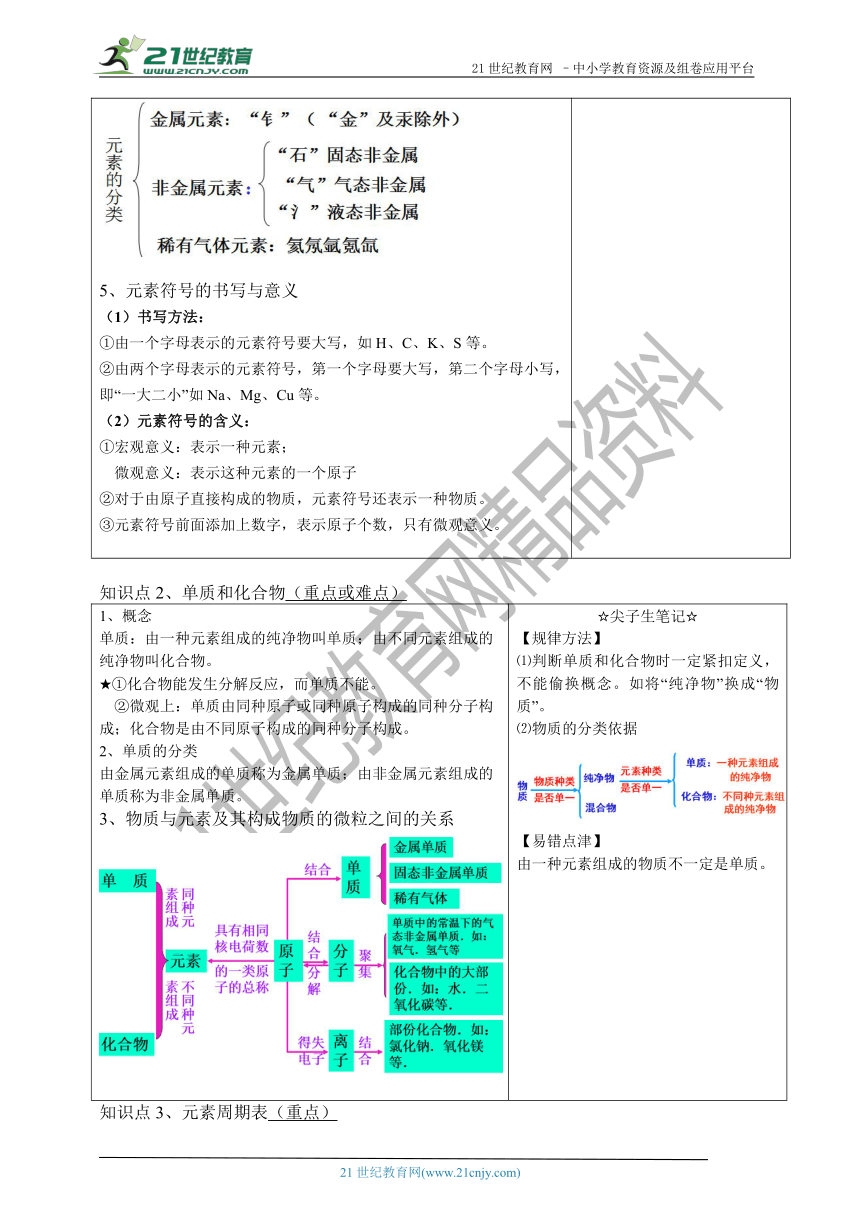
知识点1、元素与元素符号(重点、难点)
概念:元素是具有相同核电荷数(即相同质子数)的一类原子的总称。★质子数决定元素的种类,不同元素的本质区别是:质子数不同。元素与原子的比较地壳中元素含量前五位由多到少:氧、硅、铝、铁、钙元素的分类元素符号的书写与意义书写方法:①由一个字母表示的元素符号要大写,如H、C、K、S等。②由两个字母表示的元素符号,第一个字母要大写,第二个字母小写,即“一大二小”如Na、Mg、Cu等。(2)元素符号的含义:①宏观意义:表示一种元素;微观意义:表示这种元素的一个原子②对于由原子直接构成的物质,元素符号还表示一种物质。③元素符号前面添加上数字,表示原子个数,只有微观意义。 ☆尖子生笔记☆【规律方法】元素含量可按谐音记:养龟铝铁盖在元素的判断对错的题中,常将“原子”说成“微粒”,切记原子是微粒,但微粒不仅包括原子。元素只论种类,不论个数;而原子既论种类,又论个数。【易错点津】做题时注意看清楚问的是最多的元素、最多的金属元素、最多的非金属元素【化学小常识】【拓展延伸】元素之最地壳中最多:氧地壳中最多非金属:氧地壳中最多金属:铝空气中最多:氮人体中最多:氧海水中最多:氧人体中最多的金属元素:钙
知识点2、单质和化合物(重点或难点)
概念单质:由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物。★①化合物能发生分解反应,而单质不能。 ②微观上:单质由同种原子或同种原子构成的同种分子构成;化合物是由不同原子构成的同种分子构成。单质的分类由金属元素组成的单质称为金属单质;由非金属元素组成的单质称为非金属单质。物质与元素及其构成物质的微粒之间的关系 ☆尖子生笔记☆【规律方法】⑴判断单质和化合物时一定紧扣定义,不能偷换概念。如将“纯净物”换成“物质”。⑵物质的分类依据【易错点津】由一种元素组成的物质不一定是单质。
知识点3、元素周期表(重点)
简介按质子数由小到大的顺序将112中元素排列,电子层数相同的排在同一横行,称为周期,共7个周期,周期数等于电子层数;最外层电子数相同的原子排在同一纵行,称为族,共18个纵行,除8、9、10纵行合称一族外,其它每一个纵行为一个族。2、规律①同一周期从左向右质子数依次增大,最外层电子数从1依次递增到8(第一周期除外);每一周期都以金属元素开始,然后过渡到非金属元素,最后以稀有气体元素结束。②同一纵行最外层电子数相同,由上往下电子层数依次递增。单元格信息
解题能力突破
题型1、元素概念
【例1】(2017 玉林)不同元素最本质的区别是( )A.质子数不同 B.核外电子数不同 C.中子数不同 D.相对原子质量不同【答案】A【解析】元素是有相同质子数的同一类原子的总称,质子数决定元素的类别,所以一种元素与另一种元素本质的区别就是质子数不同。【解法归纳】 【题组训练1】(2017·盐城)硒有防癌、抗癌作用,这里的“硒”是指A.分子 B.原子 C.元素 D.离子【题组训练2】下列四种粒子的结构示意图中,说法正确的是( ) ① ② ③ ④A.它们表示四种不同的元素 B.②表示的原子在化学反应中常失去两个电子C.①③④表示的元素都是非金属元素 D.①④表示的是阳离子【题组训练3】常见的构成物质的粒子分别有分子、原子和离子。下列有关粒子的叙述正确的是( )A、若两种粒子的核外电子数相同,这两种粒子一定是同种元素。B、若两种粒子的质子数相同,这两种粒子一定是同种元素。C、若两种粒子是同种元素,这两种粒子的质子数一定相等。D、若两种粒子是同种元素,这两种粒子的最外层电子数一定相等
题型2、元素周期表
【例2】(2017 连云港)右图是元素周期表的一部分。下列说法正确的是A.硼为金属元素 B.碳的原子序数是12.01C.铝是地壳中含量最高的元素 D.三种原子中质量最大的是铝【答案】D【解析】根据所学知识和题中信息知,A.硼为非金属元素。故A错误。 B.碳的原子序数是6.故B错误。 C.铝不是地壳中含量最高的元素。故C错误。 D.三种原子中质量最大的是铝。故D正确。【解法归纳】知道原子序数=质子数=电子数=核电荷数;知道元素周期表中每个单元格的各部分内容表达的意思;熟记同一周期、一族中原子的规律性变化, 【题组训练4】(2017·安徽) 在最新公布中文名称的元素中,某元素相关信息如图所示。下列有说法正确的是( )元素符号为 uUO B. 原子序数为 118C. 原子的质数为 176 D. 相对原子质量为 294g【题组训练5】 (2017·深圳)碘是人体必需的微量元素之一,有“智力元素”之称。下图为碘在元素周期表中的相关信息及原子结构示意图,据此判断下列说法正确的是A、碘是一种金属元素 B.碘原子的核外有7个电子层C.碘原子的核电荷数为53 D.碘的相对原子质量为126.9g【题组训练6】(2017·临沂)下列是钠元素、氯元素在元素周期表中的信息及有关粒子的结构示意图,请回答下列问题:(1)D所表示的粒子是 (填化学符号),氯原子的结构示意图是 (填序号).(2)与元素的化学性质关系最密切的是 (填序号).①原子的核外电子数 ②元素的相对原子质量③元素的原子序数 ④原子的最外层电子数.
题型3、符号的意义和书写
【例3】 (2017 苏州)下列有关化学用语表示不正确的是A.2个铝离子:2Al3+ B.钠原子的结构示意图:C.氧分子:O D.保持氯化钠性质的微粒:Na+、Cl-【答案】C【解析】A离子符号前加数字表示离子个数;B、钠原子的质子数=核外电子数=11,B正确;C、O表示一个氧原子;D、率华南由钠离子和氯离子构成,所以保持氯化钠化学性质的微粒就是钠离子和氯离子。【解法归纳】(1)书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写.(2)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.(2)离子符号书写时应在元素符号右上角表示一个离子带电荷的数值, 【题组训练4】(2017·安顺)下列符号中,既表示一个原子,又表示一种元素,还能表示一种物质的是:A.He B.N2 C.H D. 2O【题组训练5】(2017 连云港)下列化学用语表示正确的是A.60个碳原子:C60 B.2个氢氧根离子:2OH C.金刚石:Au D.3个二氧化硫分子:3SO2 【题组训练6】(2017·葫芦岛改编)请用化学用语填空.(1)铝元素 Al ;(2)2个氟原子 2F .
题型4、 物质的分类
【例4】某物质经测定只含有一种元素,则关于该物质说法正确的是( )A、一定是纯净物 B一定不是化合物 C、一定是混合物 D一定是一种单质【答案】B【解析】一种元素组成的物质可能只有一种,也可能是多种,所以可能是纯净物也可能是混合物,当一种元素只组成一种物质时为单质,而化合物一定是由不同元素组成的纯净物。【解法归纳】①熟记纯净物、混合物、单质、化合物的定义;②微观上:由同种原子构成的一种分子构成的物质是单质;不同原子构成的一种分子构成的物质是化合物;同种分子构成的物质是纯净物,不同分子构成的是混合物。 【题组训练7】如下图所示,图中“○”和“●”分别表示两种质子数不同的原子,其中表示化合物的是:( ) A . B. C. D.【题组训练8】下列分别盛有不同物质的容器中,所盛物质属于单质的是 ,属于混合物的是 ,属于化合物的是 。【题组训练9】下列有关单质和化合物的说法中,你认为一定正确的是( )A.单质是由同种原子构成的物质,化合物是由不同种原子构成的物质 B.单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物 C.单质是由同种分子构成的纯净物,化合物是由不同种分子构成的混合物 D.单质是由同种物质组成的纯净物,化合物是由不同种物质组成的混合物
得分高手体验(可或缺)
【例题】(学科综合题)(2017·东营)元素周期表是学习和研究化学的重要工具。下图是元素周期表的一部分。
②
(1)很多科学家对元素周期期表的发现和完善做出了重大贡献,请写出其中一位科学家的名字:_________。
(2)学习化学后,我们学会了从微观角度认识事物。
根据下列四种粒子的结构示意图,回答问题。
①它们属于同种元素的是______(填序号,下同)。
②图C是某元素的原子结构示意图,该元素在元素周期表中的位置是______(选填①或②或③)。
(3)原子序数为12的元素的原子在化学反应中易_______(填“得”或“失”),形成离子符号是_______。
(4)探究金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声,向反应后溶液中滴加酚酞试剂,溶液呈红色。由以上信息,你对物质的结构与性质之间的关系有什么认识__________。
【解法归纳】
了解化学发展史的一些常识,熟悉元素周期表中各元素的排列规则,准确理解原子结构示意图中各部分的含义;会正确书写元素符号、离子符号等化学用语。
综合培优训练
能力通关
1、下列元素符号书写错误的是( )A 、氩Ar B.钙Ca C.氟f D.锌Zn
2、(2017·南京)地壳中含量最多的元素是( )
氧 B.硅 C.铝 D.钙
3、(2017·青岛)“含氟牙膏”中的“氟”指的是( )
A.分子 B.原子 C.离子 D.元素
4、单质和化合物的区别,在于是否由( )
A.同种物质组成 B.同种元素组成C.同种分子组成 D.同种离子组成
5、(2017·青岛)铬在元素周期表中信息如右图所示,下列有关铬元素的说法正确
的是( )
A.原子序数是24 B.属于非金属元素
C.一个铬原子核外有28个电子D.相对原子质量为52.00g
6、(2017·绥化)下列各图中●和○分别表示不同元素的原子,则其中表示化合物的是( )
A B C D
7、(2017 营口)用化学用语填空:
(1)两个氢原子 ;
(2)3个亚铁离子 .
(3)生理盐水中的溶质 .
8、 (2017·哈尔滨)右图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于________(填物质分类),从微观角度说明理由是
_________________________________;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图__________。
9、(2017 营口)如图是元素周期表中1﹣18号元素的原子结构示意图,请回答下列问题:
(1)原子序数为17的元素属于 (填“金属”或“非金属”)元素,表中与该元素化学性质相似的元素是 (填元素名称).
(2)X3﹣和氖原子的核外电子排布相同,则X的元素符号是 .
(3)同一周期,从左到右,各元素原子的 依次递增.
2、巅峰训练
(2017·泰安)如表是元素周期表中第2、3周期的元素,请回答有关问题.
(1)下列各组具有相似化学性质的元素是 (填字母序号);
A.Na、Cl B.O、S C.F、Cl D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律 ;
(3)第7号元素与第12号元素的原子形成化合物的化学式为 ;
(4)某离子的结构示意图如图2所示,当x﹣y=8时,该粒子的符号为 ;
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是 (填字母序号).
A.NO和O2 B.CO和N2
C.SO2和CO2 D.PO43﹣和SO42﹣.
参考答案
【题组训练】
1、【答案】C
【解析】元素是有相同质子数的同类原子的总称,这里的碘指元素。
2、【答案】B
【解析】A.元素是有相同质子数的同一类原子的总称,质子数决定元素的类别,它们表示三种不同的元素;
B.②表示的原子最外层电子数小于4,易失电子,在化学反应中常失去两个电子;C.①是氧元素,为非金属元素,③④表示的元素是钠元素和镁元素,为金属元素;
D.①表示的带负电荷是阴离子,④表示的微粒带正电荷是阳离子。
3、【答案】C
【解析】元素是有相同质子数的同一类原子的总称,质子数决定元素的类别。A、若两种粒子的核外电子数相同,这两种粒子不一定是同种元素,如钠离子和氖原子。
B、若两种粒子的质子数相同,这两种粒子不一定是同种元素,如水分子和氖原子。C、若两种粒子是同种元素,这两种粒子的质子数一定相等,正确。
D、若两种粒子是同种元素,这两种粒子的最外层电子数不一定相等,如钠原子和钠离子。
4、
【答案】B
【解析】该元素的符号为Uuo,其原子序数为118,原子的质子数等于原子序数,为118,其相对原子质量为294。故选B。
5、【答案】B
【解析】A、碘的字旁为“石”,可知碘是一种固体非金属元素 ; B.在原子结构示意图中弧线代表的是电子层,碘原子的核外有5个电子层;C.由图可知碘的原子序数是53,同一类原子,质子数=核电荷数,碘原子的核电荷数为53 ;D.碘的相对原子质量为126.9,相对原子质量在书写时不带单位。
6、【答案】(1)Na+;E;(2)④.
【解析】:(1)微粒D的核内质子数为11,核外电子数为10,是带有1个单位正电荷的钠离子,符号为Na+;氯是17号元素,氯原子核内质子数为17,核外电子排布为2、8、7,所以E是氯原子结构示意图;故填:Na+;E;
(2)D是带有一个单位正电荷的钠离子,F是带有一个单位负电荷的氯离子,二者组成的化合物的化学式为NaCl;故填:NaCl;(3)元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,所以决定元素化学性质的是最外层电子数,故填:④.
7、【答案】A
【解析】由一种元素组成的纯净物叫单质,由不同元素组成的纯净物叫化合物。由一种物质组成的物质叫纯净物。微观上,由不同原子构成的一种分子构成的物质是化合物。故A是化合物,BC是混合物;D是单质。
8、【答案】A,BCE,D
【解析】由不同物质组成的物质是混合物;由一种物质组成的物质叫纯净物;由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物。
9、【答案】B
【解析】A.单质是由同种原子构成的物质,化合物是由不同种原子构成的物质
B.单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物
C.单质是由同种分子构成的纯净物,化合物是由不同种分子构成的混合物
D.单质是由同种物质组成的纯净物,化合物是由不同种物质组成的混合物
得分高手体验(可或缺)
【例题】(学科综合题)
【答案】(1)门捷列夫或张青莲
(2)①AC ② ③(3)失,Mg2+(4)结构决定性质,性质反映结构
【解析】(1)张青莲为铕元素的相对原子质量的测定做出了卓越的贡献,、门捷列夫在化学学科中的主要成就,是发现了元素周期律,并首次编制了元素周期表,(2)①在原子结构示意图中,小圆圈表示原子核,圆圈内的数字表示质子数,质子数决定原子的类别,弧线表示电子层,最外层电子数决定原子的化学性质;(3)当最外层电子数小于4时,反应中易失去电子成为阳离子;当最外层电子数大于4时,反应中易得到电子成为阴离子;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构,不易得失电子。离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写; Mg2+;一个原子失去电子数等于正价的数值;+2;化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写; MgF2;(4)金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声,说明生成氢气;向反应后溶液中滴加酚酞试剂,溶液呈红色,说明生成氢氧化钠。由此推断,钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑。由以上信息可知,原子的结构决定性质,性质反映结构。
【解法归纳】
了解化学发展史的一些常识,熟悉元素周期表中各元素的排列规则,准确理解原子结构示意图中各部分的含义;会正确书写元素符号、离子符号等化学用语。
综合培优训练
能力通关
1、下列元素符号书写错误的是( )A 、氩Ar B.钙Ca C.氟f D.锌Zn
【答案】C
【解析】元素符号书写时如果只有一个字母要大写,如果两个字母,第一个字母大写,第二个字母小写。
2、【答案】A
【解析】地壳中元素的含量按照由多到少的顺序是氧、硅、铝、铁、钙……..。
3、【答案】D
【解析】牙膏中的“氟”指的元素
4、【答案】B
【解析】单质是一种元素组成的纯净物,化合物是由不同元素组成的纯净物;所以二者都是纯净物,区别是是否由同种元素组成。
5、【答案】A
【解析】根据元素周期表信息所示,原子序数为24。铬属于金属元素。一个铬原子核外有24个电子。相对原子质量为52.00
6、【答案】A
【解析】A选项为不同原子组成的化合物的分子,故是正确的叙述;B选项为两种单质和一种化合物组成的混合物;C选项为单质物质的分子;D选项为单质分子,表示单质;故答案选择A
7、【答案】(1)2H;(2)3Fe2+;(3)NaCl.
【解析】:(1)原子的表示方法:用元素符号来表示一个原子,表示多个原子,就在其元素符号前加上相应的数字,所以表示为两个氢原子表示为2H;
(2)离子的表示方法,在表示该离子的元素 ( http: / / www.21cnjy.com )符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,所以3个亚铁离子表示为3Fe2+;
(3)元素化合价的表示方法:确定出 ( http: / / www.21cnjy.com )化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铝中铝元素的化合价表示为2O3;
(4)生理盐水中的溶质是氯化钠,化学式为NaCl.
8、【答案】(1)一个氢分子,和一个水分子;(2)混合物,分子种类不同;
(3)
【解析】(1)化学反应过程是旧的分子分成原子,原子再重新组合成成新的分子,所以反应前后原子的种类个数不变,由于一个水分子由2个氢原子和1个氧原子构成;一个氢分子由两个氢原子构成;一个氧分子由两个氧原子构成,所以应该补充一个氢分子,和一个水分子;(2)同种分子构成同种物质,所以A图中有两种分子,说明A中有两种物质,是混合物。
(3)在元素周期表中,周期数等于电子层数;族数等于最外层电子数。氧原子有8个电子,根据核外电子的排列原则,氧原子有两个电子层位于第二周期;最外层电子数为6,在第六族。比氧元素多一个周期少一个族的元素的原子结构示意图为
9、【答案】:
(1)非金属;F;
(2)Al;
(3)最外层电子数,
【解析】:(1)17号元素是氯,氯 ( http: / / www.21cnjy.com )元素带气字旁,是非金属元素;最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似,氯元素原子最外层电子数为7,氟元素原子最外层电子数为4,因此氯、氟元素的化学性质相似;21世纪教育网版权所有
(2)氖原子核外有10个电子,X3+与氖原子的核外电子排布相同,则X是铝原子,其元素符号为Al;
(3)通过上表的分析可知:同一周期,从左到右,各元素原子的最外层电子数依次递增.
2、巅峰训练
【答案】(1)BC;
同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大等;
(3)Mg3N(4)S2﹣;(5)BD.
【解答】解:(1)最外层电子数相同,化学性质相似,其中O和S的最外层电子数都为6,F和Cl的最外层电子数都为7,所以化学性质相似.故填:BC;(2)在元素周期表中,处于同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大(合理即可).故填:同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大等;(3)7号是氮元素,常显﹣3价,12号是镁元素,常显+2价,二者组成的化合物是氮化镁,其化学式为Mg3N2;故答案为:Mg3N(4)由题意知X﹣Y=8,故X=8+Y;在原子中X=2+8+Y,故由此可知,图中微粒为离子,即Y=8,故X=8+8=16,因此该微粒为硫离子;故填:S2﹣;(5)A、一氧化氮和氧气的电子数分别是15和16,不属于等电子体.B、一氧化碳和氮气的原子个数和电子个数都相等,属于等电子体.C、二氧化硫和二氧化碳的电子数分别是32和22,不属于等电子体.D、磷酸根和硫酸根的原子个数和电子个数都相等,属于等电子体.故选BD.
备用题
(2017·绥化)含氟物质的合成,对推动科技进步发挥着巨大作用。
(1)图1是氟元素在元素周期表中的相关信息,若画出氟元素的原子结构示意图 。由氟原子结构示意图可知,氟原子在化学反应中易 电子(选填“失去”成“得到”)。
(2)氟原子的化学性质与图2中的 微粒的化学性质相似。 (选填字母序号)
【答案】(1) 得到 (2)D
(2017 玉林)元素周期表是学习和研究化学的重要工具。请分析图中信息回答相关问题。
(1)硫元素的质子数是______,它属于______(填“金属”或“非金属”)元素,在化学反应中容易______(填“得到”或“失去”)电子。
(2)原子序数为l、7、8的三种元素形成的碱的化学式为______。
(3)在同一族中,各元素的原子最外层电子数______ ( He除外)
(2017·威海)元素家族新成员——鉨()
2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号元素的元素符号为Nh,中文名称为“鉨”。图1中,甲为鉨原子结构示意图,乙为铝原子结枸示意图。请回答下列问题;
(1)甲中x=________。
(2) 铱元素与铝元素在元素周期表中处于同一_____________。
(3)在化学反应中,鉨原子形成离子的符号为___________。
(4)根据铱和铝的结构,理论上你的金属活动性比铝强,试预测钵可能与哪些物质反应?(写出两种不同类别的物质的化学式即可)_______________,____________________。
【答案】(1)3 (2)族(或纵行、或列、或竖行) (3)Nh3+
(4)O2、HCl、CuSO4 评分标准:能与其反应的非金属单质.酸和盐等三类物质中的两类均可
【解析】(1) 同一原子中,质子数=核外电子数=核电荷数=原子序数;甲中x 为3 (2) 鉨元素与铝元素原子的最外层电子数相同,在元素周期表中处于同一族(或纵行、或列、或竖行) (3) 原子的化学性质主要由最外层电子数决定,当最外层电子数小于4时,反应中易失去电子成为阳离子;正电荷数等于失电子数,离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写;Nh3+;(4)铝的活动性比铱弱,铝能与O2、HCl、CuSO4 等物质反应,所以铱也一定能与这类物质反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://www.21cnjy.com/" 21世纪教育网(www.21cnjy.com)
第四节 元素
学习目标 中考考点关注
理解元素的概念,将物质的宏观组成与微观构成联系起来(难点)熟记常见元素符号及地壳中元素含量,掌握元素符号的写法和意义,(重点)能准确判断单质和化合物(重点)学会从元素周期表中获得信息(重点) 元素的概念(高频考点)判断物质的类别(必考点)元素符号及意义(必考点)元素周期(必考点)
教材知识精析
知识点1、元素与元素符号(重点、难点)
概念:元素是具有相同核电荷数(即相同质子数)的一类原子的总称。★质子数决定元素的种类,不同元素的本质区别是:质子数不同。元素与原子的比较地壳中元素含量前五位由多到少:氧、硅、铝、铁、钙元素的分类元素符号的书写与意义书写方法:①由一个字母表示的元素符号要大写,如H、C、K、S等。②由两个字母表示的元素符号,第一个字母要大写,第二个字母小写,即“一大二小”如Na、Mg、Cu等。(2)元素符号的含义:①宏观意义:表示一种元素;微观意义:表示这种元素的一个原子②对于由原子直接构成的物质,元素符号还表示一种物质。③元素符号前面添加上数字,表示原子个数,只有微观意义。 ☆尖子生笔记☆【规律方法】元素含量可按谐音记:养龟铝铁盖在元素的判断对错的题中,常将“原子”说成“微粒”,切记原子是微粒,但微粒不仅包括原子。元素只论种类,不论个数;而原子既论种类,又论个数。【易错点津】做题时注意看清楚问的是最多的元素、最多的金属元素、最多的非金属元素【化学小常识】【拓展延伸】元素之最地壳中最多:氧地壳中最多非金属:氧地壳中最多金属:铝空气中最多:氮人体中最多:氧海水中最多:氧人体中最多的金属元素:钙
知识点2、单质和化合物(重点或难点)
概念单质:由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物。★①化合物能发生分解反应,而单质不能。 ②微观上:单质由同种原子或同种原子构成的同种分子构成;化合物是由不同原子构成的同种分子构成。单质的分类由金属元素组成的单质称为金属单质;由非金属元素组成的单质称为非金属单质。物质与元素及其构成物质的微粒之间的关系 ☆尖子生笔记☆【规律方法】⑴判断单质和化合物时一定紧扣定义,不能偷换概念。如将“纯净物”换成“物质”。⑵物质的分类依据【易错点津】由一种元素组成的物质不一定是单质。
知识点3、元素周期表(重点)
简介按质子数由小到大的顺序将112中元素排列,电子层数相同的排在同一横行,称为周期,共7个周期,周期数等于电子层数;最外层电子数相同的原子排在同一纵行,称为族,共18个纵行,除8、9、10纵行合称一族外,其它每一个纵行为一个族。2、规律①同一周期从左向右质子数依次增大,最外层电子数从1依次递增到8(第一周期除外);每一周期都以金属元素开始,然后过渡到非金属元素,最后以稀有气体元素结束。②同一纵行最外层电子数相同,由上往下电子层数依次递增。单元格信息
解题能力突破
题型1、元素概念
【例1】(2017 玉林)不同元素最本质的区别是( )A.质子数不同 B.核外电子数不同 C.中子数不同 D.相对原子质量不同【答案】A【解析】元素是有相同质子数的同一类原子的总称,质子数决定元素的类别,所以一种元素与另一种元素本质的区别就是质子数不同。【解法归纳】 【题组训练1】(2017·盐城)硒有防癌、抗癌作用,这里的“硒”是指A.分子 B.原子 C.元素 D.离子【题组训练2】下列四种粒子的结构示意图中,说法正确的是( ) ① ② ③ ④A.它们表示四种不同的元素 B.②表示的原子在化学反应中常失去两个电子C.①③④表示的元素都是非金属元素 D.①④表示的是阳离子【题组训练3】常见的构成物质的粒子分别有分子、原子和离子。下列有关粒子的叙述正确的是( )A、若两种粒子的核外电子数相同,这两种粒子一定是同种元素。B、若两种粒子的质子数相同,这两种粒子一定是同种元素。C、若两种粒子是同种元素,这两种粒子的质子数一定相等。D、若两种粒子是同种元素,这两种粒子的最外层电子数一定相等
题型2、元素周期表
【例2】(2017 连云港)右图是元素周期表的一部分。下列说法正确的是A.硼为金属元素 B.碳的原子序数是12.01C.铝是地壳中含量最高的元素 D.三种原子中质量最大的是铝【答案】D【解析】根据所学知识和题中信息知,A.硼为非金属元素。故A错误。 B.碳的原子序数是6.故B错误。 C.铝不是地壳中含量最高的元素。故C错误。 D.三种原子中质量最大的是铝。故D正确。【解法归纳】知道原子序数=质子数=电子数=核电荷数;知道元素周期表中每个单元格的各部分内容表达的意思;熟记同一周期、一族中原子的规律性变化, 【题组训练4】(2017·安徽) 在最新公布中文名称的元素中,某元素相关信息如图所示。下列有说法正确的是( )元素符号为 uUO B. 原子序数为 118C. 原子的质数为 176 D. 相对原子质量为 294g【题组训练5】 (2017·深圳)碘是人体必需的微量元素之一,有“智力元素”之称。下图为碘在元素周期表中的相关信息及原子结构示意图,据此判断下列说法正确的是A、碘是一种金属元素 B.碘原子的核外有7个电子层C.碘原子的核电荷数为53 D.碘的相对原子质量为126.9g【题组训练6】(2017·临沂)下列是钠元素、氯元素在元素周期表中的信息及有关粒子的结构示意图,请回答下列问题:(1)D所表示的粒子是 (填化学符号),氯原子的结构示意图是 (填序号).(2)与元素的化学性质关系最密切的是 (填序号).①原子的核外电子数 ②元素的相对原子质量③元素的原子序数 ④原子的最外层电子数.
题型3、符号的意义和书写
【例3】 (2017 苏州)下列有关化学用语表示不正确的是A.2个铝离子:2Al3+ B.钠原子的结构示意图:C.氧分子:O D.保持氯化钠性质的微粒:Na+、Cl-【答案】C【解析】A离子符号前加数字表示离子个数;B、钠原子的质子数=核外电子数=11,B正确;C、O表示一个氧原子;D、率华南由钠离子和氯离子构成,所以保持氯化钠化学性质的微粒就是钠离子和氯离子。【解法归纳】(1)书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写.(2)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.(2)离子符号书写时应在元素符号右上角表示一个离子带电荷的数值, 【题组训练4】(2017·安顺)下列符号中,既表示一个原子,又表示一种元素,还能表示一种物质的是:A.He B.N2 C.H D. 2O【题组训练5】(2017 连云港)下列化学用语表示正确的是A.60个碳原子:C60 B.2个氢氧根离子:2OH C.金刚石:Au D.3个二氧化硫分子:3SO2 【题组训练6】(2017·葫芦岛改编)请用化学用语填空.(1)铝元素 Al ;(2)2个氟原子 2F .
题型4、 物质的分类
【例4】某物质经测定只含有一种元素,则关于该物质说法正确的是( )A、一定是纯净物 B一定不是化合物 C、一定是混合物 D一定是一种单质【答案】B【解析】一种元素组成的物质可能只有一种,也可能是多种,所以可能是纯净物也可能是混合物,当一种元素只组成一种物质时为单质,而化合物一定是由不同元素组成的纯净物。【解法归纳】①熟记纯净物、混合物、单质、化合物的定义;②微观上:由同种原子构成的一种分子构成的物质是单质;不同原子构成的一种分子构成的物质是化合物;同种分子构成的物质是纯净物,不同分子构成的是混合物。 【题组训练7】如下图所示,图中“○”和“●”分别表示两种质子数不同的原子,其中表示化合物的是:( ) A . B. C. D.【题组训练8】下列分别盛有不同物质的容器中,所盛物质属于单质的是 ,属于混合物的是 ,属于化合物的是 。【题组训练9】下列有关单质和化合物的说法中,你认为一定正确的是( )A.单质是由同种原子构成的物质,化合物是由不同种原子构成的物质 B.单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物 C.单质是由同种分子构成的纯净物,化合物是由不同种分子构成的混合物 D.单质是由同种物质组成的纯净物,化合物是由不同种物质组成的混合物
得分高手体验(可或缺)
【例题】(学科综合题)(2017·东营)元素周期表是学习和研究化学的重要工具。下图是元素周期表的一部分。
②
(1)很多科学家对元素周期期表的发现和完善做出了重大贡献,请写出其中一位科学家的名字:_________。
(2)学习化学后,我们学会了从微观角度认识事物。
根据下列四种粒子的结构示意图,回答问题。
①它们属于同种元素的是______(填序号,下同)。
②图C是某元素的原子结构示意图,该元素在元素周期表中的位置是______(选填①或②或③)。
(3)原子序数为12的元素的原子在化学反应中易_______(填“得”或“失”),形成离子符号是_______。
(4)探究金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声,向反应后溶液中滴加酚酞试剂,溶液呈红色。由以上信息,你对物质的结构与性质之间的关系有什么认识__________。
【解法归纳】
了解化学发展史的一些常识,熟悉元素周期表中各元素的排列规则,准确理解原子结构示意图中各部分的含义;会正确书写元素符号、离子符号等化学用语。
综合培优训练
能力通关
1、下列元素符号书写错误的是( )A 、氩Ar B.钙Ca C.氟f D.锌Zn
2、(2017·南京)地壳中含量最多的元素是( )
氧 B.硅 C.铝 D.钙
3、(2017·青岛)“含氟牙膏”中的“氟”指的是( )
A.分子 B.原子 C.离子 D.元素
4、单质和化合物的区别,在于是否由( )
A.同种物质组成 B.同种元素组成C.同种分子组成 D.同种离子组成
5、(2017·青岛)铬在元素周期表中信息如右图所示,下列有关铬元素的说法正确
的是( )
A.原子序数是24 B.属于非金属元素
C.一个铬原子核外有28个电子D.相对原子质量为52.00g
6、(2017·绥化)下列各图中●和○分别表示不同元素的原子,则其中表示化合物的是( )
A B C D
7、(2017 营口)用化学用语填空:
(1)两个氢原子 ;
(2)3个亚铁离子 .
(3)生理盐水中的溶质 .
8、 (2017·哈尔滨)右图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于________(填物质分类),从微观角度说明理由是
_________________________________;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图__________。
9、(2017 营口)如图是元素周期表中1﹣18号元素的原子结构示意图,请回答下列问题:
(1)原子序数为17的元素属于 (填“金属”或“非金属”)元素,表中与该元素化学性质相似的元素是 (填元素名称).
(2)X3﹣和氖原子的核外电子排布相同,则X的元素符号是 .
(3)同一周期,从左到右,各元素原子的 依次递增.
2、巅峰训练
(2017·泰安)如表是元素周期表中第2、3周期的元素,请回答有关问题.
(1)下列各组具有相似化学性质的元素是 (填字母序号);
A.Na、Cl B.O、S C.F、Cl D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律 ;
(3)第7号元素与第12号元素的原子形成化合物的化学式为 ;
(4)某离子的结构示意图如图2所示,当x﹣y=8时,该粒子的符号为 ;
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是 (填字母序号).
A.NO和O2 B.CO和N2
C.SO2和CO2 D.PO43﹣和SO42﹣.
参考答案
【题组训练】
1、【答案】C
【解析】元素是有相同质子数的同类原子的总称,这里的碘指元素。
2、【答案】B
【解析】A.元素是有相同质子数的同一类原子的总称,质子数决定元素的类别,它们表示三种不同的元素;
B.②表示的原子最外层电子数小于4,易失电子,在化学反应中常失去两个电子;C.①是氧元素,为非金属元素,③④表示的元素是钠元素和镁元素,为金属元素;
D.①表示的带负电荷是阴离子,④表示的微粒带正电荷是阳离子。
3、【答案】C
【解析】元素是有相同质子数的同一类原子的总称,质子数决定元素的类别。A、若两种粒子的核外电子数相同,这两种粒子不一定是同种元素,如钠离子和氖原子。
B、若两种粒子的质子数相同,这两种粒子不一定是同种元素,如水分子和氖原子。C、若两种粒子是同种元素,这两种粒子的质子数一定相等,正确。
D、若两种粒子是同种元素,这两种粒子的最外层电子数不一定相等,如钠原子和钠离子。
4、
【答案】B
【解析】该元素的符号为Uuo,其原子序数为118,原子的质子数等于原子序数,为118,其相对原子质量为294。故选B。
5、【答案】B
【解析】A、碘的字旁为“石”,可知碘是一种固体非金属元素 ; B.在原子结构示意图中弧线代表的是电子层,碘原子的核外有5个电子层;C.由图可知碘的原子序数是53,同一类原子,质子数=核电荷数,碘原子的核电荷数为53 ;D.碘的相对原子质量为126.9,相对原子质量在书写时不带单位。
6、【答案】(1)Na+;E;(2)④.
【解析】:(1)微粒D的核内质子数为11,核外电子数为10,是带有1个单位正电荷的钠离子,符号为Na+;氯是17号元素,氯原子核内质子数为17,核外电子排布为2、8、7,所以E是氯原子结构示意图;故填:Na+;E;
(2)D是带有一个单位正电荷的钠离子,F是带有一个单位负电荷的氯离子,二者组成的化合物的化学式为NaCl;故填:NaCl;(3)元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,所以决定元素化学性质的是最外层电子数,故填:④.
7、【答案】A
【解析】由一种元素组成的纯净物叫单质,由不同元素组成的纯净物叫化合物。由一种物质组成的物质叫纯净物。微观上,由不同原子构成的一种分子构成的物质是化合物。故A是化合物,BC是混合物;D是单质。
8、【答案】A,BCE,D
【解析】由不同物质组成的物质是混合物;由一种物质组成的物质叫纯净物;由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物。
9、【答案】B
【解析】A.单质是由同种原子构成的物质,化合物是由不同种原子构成的物质
B.单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物
C.单质是由同种分子构成的纯净物,化合物是由不同种分子构成的混合物
D.单质是由同种物质组成的纯净物,化合物是由不同种物质组成的混合物
得分高手体验(可或缺)
【例题】(学科综合题)
【答案】(1)门捷列夫或张青莲
(2)①AC ② ③(3)失,Mg2+(4)结构决定性质,性质反映结构
【解析】(1)张青莲为铕元素的相对原子质量的测定做出了卓越的贡献,、门捷列夫在化学学科中的主要成就,是发现了元素周期律,并首次编制了元素周期表,(2)①在原子结构示意图中,小圆圈表示原子核,圆圈内的数字表示质子数,质子数决定原子的类别,弧线表示电子层,最外层电子数决定原子的化学性质;(3)当最外层电子数小于4时,反应中易失去电子成为阳离子;当最外层电子数大于4时,反应中易得到电子成为阴离子;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构,不易得失电子。离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写; Mg2+;一个原子失去电子数等于正价的数值;+2;化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写; MgF2;(4)金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声,说明生成氢气;向反应后溶液中滴加酚酞试剂,溶液呈红色,说明生成氢氧化钠。由此推断,钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑。由以上信息可知,原子的结构决定性质,性质反映结构。
【解法归纳】
了解化学发展史的一些常识,熟悉元素周期表中各元素的排列规则,准确理解原子结构示意图中各部分的含义;会正确书写元素符号、离子符号等化学用语。
综合培优训练
能力通关
1、下列元素符号书写错误的是( )A 、氩Ar B.钙Ca C.氟f D.锌Zn
【答案】C
【解析】元素符号书写时如果只有一个字母要大写,如果两个字母,第一个字母大写,第二个字母小写。
2、【答案】A
【解析】地壳中元素的含量按照由多到少的顺序是氧、硅、铝、铁、钙……..。
3、【答案】D
【解析】牙膏中的“氟”指的元素
4、【答案】B
【解析】单质是一种元素组成的纯净物,化合物是由不同元素组成的纯净物;所以二者都是纯净物,区别是是否由同种元素组成。
5、【答案】A
【解析】根据元素周期表信息所示,原子序数为24。铬属于金属元素。一个铬原子核外有24个电子。相对原子质量为52.00
6、【答案】A
【解析】A选项为不同原子组成的化合物的分子,故是正确的叙述;B选项为两种单质和一种化合物组成的混合物;C选项为单质物质的分子;D选项为单质分子,表示单质;故答案选择A
7、【答案】(1)2H;(2)3Fe2+;(3)NaCl.
【解析】:(1)原子的表示方法:用元素符号来表示一个原子,表示多个原子,就在其元素符号前加上相应的数字,所以表示为两个氢原子表示为2H;
(2)离子的表示方法,在表示该离子的元素 ( http: / / www.21cnjy.com )符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,所以3个亚铁离子表示为3Fe2+;
(3)元素化合价的表示方法:确定出 ( http: / / www.21cnjy.com )化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铝中铝元素的化合价表示为2O3;
(4)生理盐水中的溶质是氯化钠,化学式为NaCl.
8、【答案】(1)一个氢分子,和一个水分子;(2)混合物,分子种类不同;
(3)
【解析】(1)化学反应过程是旧的分子分成原子,原子再重新组合成成新的分子,所以反应前后原子的种类个数不变,由于一个水分子由2个氢原子和1个氧原子构成;一个氢分子由两个氢原子构成;一个氧分子由两个氧原子构成,所以应该补充一个氢分子,和一个水分子;(2)同种分子构成同种物质,所以A图中有两种分子,说明A中有两种物质,是混合物。
(3)在元素周期表中,周期数等于电子层数;族数等于最外层电子数。氧原子有8个电子,根据核外电子的排列原则,氧原子有两个电子层位于第二周期;最外层电子数为6,在第六族。比氧元素多一个周期少一个族的元素的原子结构示意图为
9、【答案】:
(1)非金属;F;
(2)Al;
(3)最外层电子数,
【解析】:(1)17号元素是氯,氯 ( http: / / www.21cnjy.com )元素带气字旁,是非金属元素;最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似,氯元素原子最外层电子数为7,氟元素原子最外层电子数为4,因此氯、氟元素的化学性质相似;21世纪教育网版权所有
(2)氖原子核外有10个电子,X3+与氖原子的核外电子排布相同,则X是铝原子,其元素符号为Al;
(3)通过上表的分析可知:同一周期,从左到右,各元素原子的最外层电子数依次递增.
2、巅峰训练
【答案】(1)BC;
同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大等;
(3)Mg3N(4)S2﹣;(5)BD.
【解答】解:(1)最外层电子数相同,化学性质相似,其中O和S的最外层电子数都为6,F和Cl的最外层电子数都为7,所以化学性质相似.故填:BC;(2)在元素周期表中,处于同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大(合理即可).故填:同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大等;(3)7号是氮元素,常显﹣3价,12号是镁元素,常显+2价,二者组成的化合物是氮化镁,其化学式为Mg3N2;故答案为:Mg3N(4)由题意知X﹣Y=8,故X=8+Y;在原子中X=2+8+Y,故由此可知,图中微粒为离子,即Y=8,故X=8+8=16,因此该微粒为硫离子;故填:S2﹣;(5)A、一氧化氮和氧气的电子数分别是15和16,不属于等电子体.B、一氧化碳和氮气的原子个数和电子个数都相等,属于等电子体.C、二氧化硫和二氧化碳的电子数分别是32和22,不属于等电子体.D、磷酸根和硫酸根的原子个数和电子个数都相等,属于等电子体.故选BD.
备用题
(2017·绥化)含氟物质的合成,对推动科技进步发挥着巨大作用。
(1)图1是氟元素在元素周期表中的相关信息,若画出氟元素的原子结构示意图 。由氟原子结构示意图可知,氟原子在化学反应中易 电子(选填“失去”成“得到”)。
(2)氟原子的化学性质与图2中的 微粒的化学性质相似。 (选填字母序号)
【答案】(1) 得到 (2)D
(2017 玉林)元素周期表是学习和研究化学的重要工具。请分析图中信息回答相关问题。
(1)硫元素的质子数是______,它属于______(填“金属”或“非金属”)元素,在化学反应中容易______(填“得到”或“失去”)电子。
(2)原子序数为l、7、8的三种元素形成的碱的化学式为______。
(3)在同一族中,各元素的原子最外层电子数______ ( He除外)
(2017·威海)元素家族新成员——鉨()
2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号元素的元素符号为Nh,中文名称为“鉨”。图1中,甲为鉨原子结构示意图,乙为铝原子结枸示意图。请回答下列问题;
(1)甲中x=________。
(2) 铱元素与铝元素在元素周期表中处于同一_____________。
(3)在化学反应中,鉨原子形成离子的符号为___________。
(4)根据铱和铝的结构,理论上你的金属活动性比铝强,试预测钵可能与哪些物质反应?(写出两种不同类别的物质的化学式即可)_______________,____________________。
【答案】(1)3 (2)族(或纵行、或列、或竖行) (3)Nh3+
(4)O2、HCl、CuSO4 评分标准:能与其反应的非金属单质.酸和盐等三类物质中的两类均可
【解析】(1) 同一原子中,质子数=核外电子数=核电荷数=原子序数;甲中x 为3 (2) 鉨元素与铝元素原子的最外层电子数相同,在元素周期表中处于同一族(或纵行、或列、或竖行) (3) 原子的化学性质主要由最外层电子数决定,当最外层电子数小于4时,反应中易失去电子成为阳离子;正电荷数等于失电子数,离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写;Nh3+;(4)铝的活动性比铱弱,铝能与O2、HCl、CuSO4 等物质反应,所以铱也一定能与这类物质反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://www.21cnjy.com/" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
