1-1-3物质的聚集状态
图片预览







文档简介
课件21张PPT。
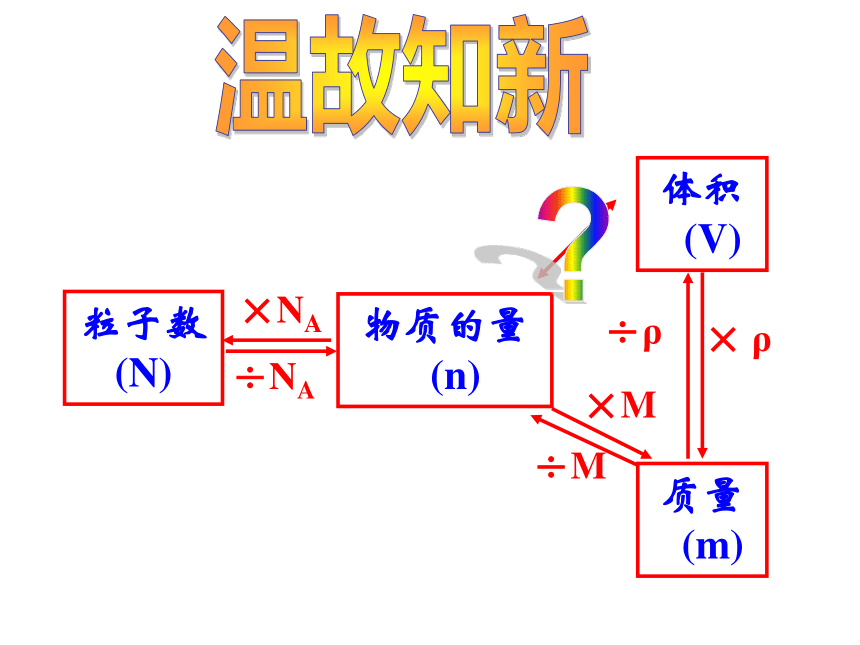
1-1-3物质的聚集状态物质的量
(n)粒子数
(N)×NA÷NA温故知新质量
(m)×M÷M体积
(V)÷ρ× ρ?学习目标
1. 知道固态、液态、气态物质的一些特性。
2.了解不同聚集状态的物质在微观结构上的差异,导致了物质性质的不同。
3.知道气体摩尔体积的概念,并能运用气体摩尔体积进行简单的计算。7.1 cm318 cm358.4 cm322.4L22.4L22.4L温度为293k温度为273k,压强为1.01×105Pa10 cm3相同条件下,1mol的气体体积要比固体、液体大得多。相同条件下, 1mol不同固体、液体的体积一般是不同的。
而相同条件下,1mol不同气体的体积几乎相同,均约为22.4L。所得规律:?三种状态性质上有何差异?从微观角度解释这三种状态存在差异的原因。 [探究] 决定物质体积大小的因素有哪些呢?不同聚集状态物质的结构与性质(2)微粒本身大小(1)微粒数目(3)微粒间距离4个篮球与12篮球分别紧密堆在一起,哪个体积大?12个乒乓球与12篮球分别紧密堆在一起,哪个体积大?
12篮球分散放与紧密堆在一起,哪个占据空间体积大?
决定物质体积大小因素固体干冰CO2气体1、为什么1mol固体或液体的体积较小,而气体较大?2、为什么在相同状况下1mol固体或液体的体积不相同?3、而为什么在相同状况下1mol气体的体积相同?探究:粒子大小和粒子间距
对物质体积的影响示意图气体摩尔体积 1.定义:3.公式:单位物质的量的气体所占的体积。2.符号:Vm4.单位:L/mol 或 m3/mol等5.对象:任何气体(纯净或混合气体)6.数值:标准状况( 温度0 oC、压强 1.01×105 Pa)下
气体摩尔体积Vm约为22.4L/molV =n·Vm气体在不同状况下的气体摩尔体积是不同的特例: 辨析和应用1mol任何物质的体积在标准状况下都约为22.4 L。1mol气体的体积约为22.4 L。任何气体的体积在标准状况约为22.4 L 。1mol空气的体积在标准状况下约是22.4 L。在标准状况下,1 mol O2和N2的混合气体(任意比)的体积约为22.4L22.4 L气体所含分子数一定大于11.2 L气体所含分子数
错错错对错对1、条件:标准状况,简称标况,
指的是温度0 oC、压强 1.01×105 Pa
通常状况,又叫常温常压,
指的是温度20 oC、压强1.01×105Pa
2、定量:物质的量为1mol
3、状态:必须为气体,固体和液体不适用
4、对象:任何气体,既可以是单一气体,
也可以是混合气体
5、数值: 22.4L,且与气体种类无关。
6、有关计算:(标准状况下) V=n×22.4L/mol重要结论: 在标准状况下,1mol任何气体所占的体积都约为22 .4L。注意点:(1)标准状况下,0.5mol H2 占有的体积约是 L。 11.2(2)标准状况下,2 mol O2 占有的体积约是 L。 44.8(3)标准状况下,4.48L CO2 的物质的量约是 mol。 0.2(4)标准状况下,33.6L H2 的物质的量约是 mol。 1.5物质的量(摩)= 气体体积(升)气体摩尔体积(升/摩)符号表示: n = V/Vm
标准状况下:n=V/(22.4L/mol) 计算和总结 在同温同压下,相同质量的下列气体,
占有的体积由大到小的顺序是 ①Cl2 ②N2 ③H2 ④CO2 ⑤O2 灵活应用③ ② ⑤ ④ ①Zn + 2HCl === ZnCl2 + H2↑答:最多可收集到4.48L(标准状况)氢气。 13克锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢气?解法1:13克锌的物质的量为0.2mol 关于化学方程式的计算Zn + 2HCl === ZnCl2 + H2↑答:最多可收集到4.48L(标准状况)氢气。 13克锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢气?22.4L22.4LV(H2)解法2:13克锌的物质的量为0.2molZn + 2HCl === ZnCl2 + H2↑答:最多可收集到4.48L(标准状况)氢气。 13克锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢气?解法3:22.4L22.4LV(H2)65g65 g13 g总结:物质的量在化学方程式中的计算,应该遵循------ “左右单位配套(g—mol--L),上下单位相同”的原则
在反应3Cl2 + 8NH3 == 6NH4Cl + N2中,标准状况下有33.6L的氯气参加 反应,求:
(1)参加反应的氨的质量是多少?
(2)产生氮气的分子数目是多少? 学以致用
(n)粒子数
(N)×NA÷NA温故知新质量
(m)×M÷M体积
(V)÷ρ× ρ?学习目标
1. 知道固态、液态、气态物质的一些特性。
2.了解不同聚集状态的物质在微观结构上的差异,导致了物质性质的不同。
3.知道气体摩尔体积的概念,并能运用气体摩尔体积进行简单的计算。7.1 cm318 cm358.4 cm322.4L22.4L22.4L温度为293k温度为273k,压强为1.01×105Pa10 cm3相同条件下,1mol的气体体积要比固体、液体大得多。相同条件下, 1mol不同固体、液体的体积一般是不同的。
而相同条件下,1mol不同气体的体积几乎相同,均约为22.4L。所得规律:?三种状态性质上有何差异?从微观角度解释这三种状态存在差异的原因。 [探究] 决定物质体积大小的因素有哪些呢?不同聚集状态物质的结构与性质(2)微粒本身大小(1)微粒数目(3)微粒间距离4个篮球与12篮球分别紧密堆在一起,哪个体积大?12个乒乓球与12篮球分别紧密堆在一起,哪个体积大?
12篮球分散放与紧密堆在一起,哪个占据空间体积大?
决定物质体积大小因素固体干冰CO2气体1、为什么1mol固体或液体的体积较小,而气体较大?2、为什么在相同状况下1mol固体或液体的体积不相同?3、而为什么在相同状况下1mol气体的体积相同?探究:粒子大小和粒子间距
对物质体积的影响示意图气体摩尔体积 1.定义:3.公式:单位物质的量的气体所占的体积。2.符号:Vm4.单位:L/mol 或 m3/mol等5.对象:任何气体(纯净或混合气体)6.数值:标准状况( 温度0 oC、压强 1.01×105 Pa)下
气体摩尔体积Vm约为22.4L/molV =n·Vm气体在不同状况下的气体摩尔体积是不同的特例: 辨析和应用1mol任何物质的体积在标准状况下都约为22.4 L。1mol气体的体积约为22.4 L。任何气体的体积在标准状况约为22.4 L 。1mol空气的体积在标准状况下约是22.4 L。在标准状况下,1 mol O2和N2的混合气体(任意比)的体积约为22.4L22.4 L气体所含分子数一定大于11.2 L气体所含分子数
错错错对错对1、条件:标准状况,简称标况,
指的是温度0 oC、压强 1.01×105 Pa
通常状况,又叫常温常压,
指的是温度20 oC、压强1.01×105Pa
2、定量:物质的量为1mol
3、状态:必须为气体,固体和液体不适用
4、对象:任何气体,既可以是单一气体,
也可以是混合气体
5、数值: 22.4L,且与气体种类无关。
6、有关计算:(标准状况下) V=n×22.4L/mol重要结论: 在标准状况下,1mol任何气体所占的体积都约为22 .4L。注意点:(1)标准状况下,0.5mol H2 占有的体积约是 L。 11.2(2)标准状况下,2 mol O2 占有的体积约是 L。 44.8(3)标准状况下,4.48L CO2 的物质的量约是 mol。 0.2(4)标准状况下,33.6L H2 的物质的量约是 mol。 1.5物质的量(摩)= 气体体积(升)气体摩尔体积(升/摩)符号表示: n = V/Vm
标准状况下:n=V/(22.4L/mol) 计算和总结 在同温同压下,相同质量的下列气体,
占有的体积由大到小的顺序是 ①Cl2 ②N2 ③H2 ④CO2 ⑤O2 灵活应用③ ② ⑤ ④ ①Zn + 2HCl === ZnCl2 + H2↑答:最多可收集到4.48L(标准状况)氢气。 13克锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢气?解法1:13克锌的物质的量为0.2mol 关于化学方程式的计算Zn + 2HCl === ZnCl2 + H2↑答:最多可收集到4.48L(标准状况)氢气。 13克锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢气?22.4L22.4LV(H2)解法2:13克锌的物质的量为0.2molZn + 2HCl === ZnCl2 + H2↑答:最多可收集到4.48L(标准状况)氢气。 13克锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢气?解法3:22.4L22.4LV(H2)65g65 g13 g总结:物质的量在化学方程式中的计算,应该遵循------ “左右单位配套(g—mol--L),上下单位相同”的原则
在反应3Cl2 + 8NH3 == 6NH4Cl + N2中,标准状况下有33.6L的氯气参加 反应,求:
(1)参加反应的氨的质量是多少?
(2)产生氮气的分子数目是多少? 学以致用
