高中化学苏教版必修1课件专题二:第二单元碳酸钠的性质与应用(共19张ppt)
文档属性
| 名称 | 高中化学苏教版必修1课件专题二:第二单元碳酸钠的性质与应用(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 329.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-09 21:10:22 | ||
图片预览


文档简介
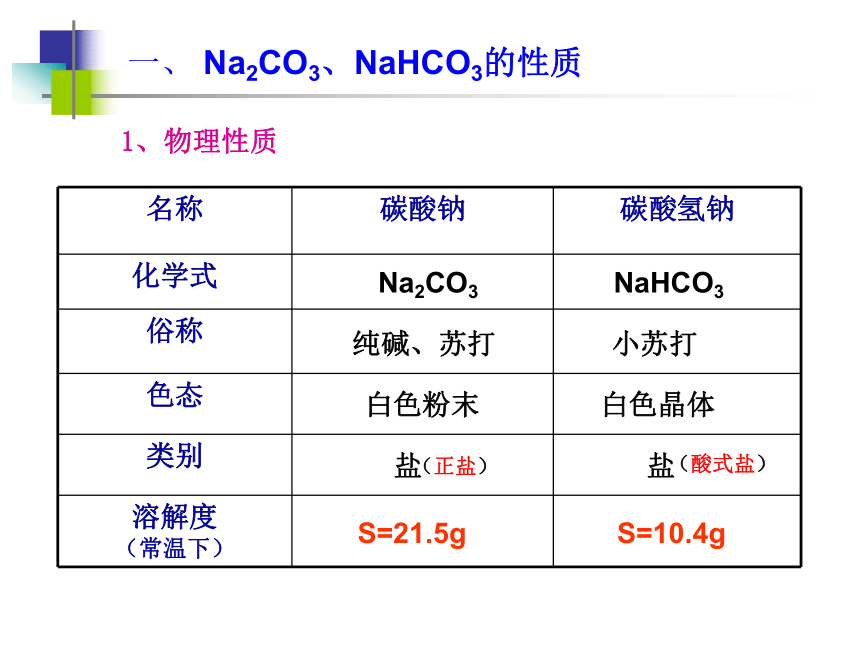
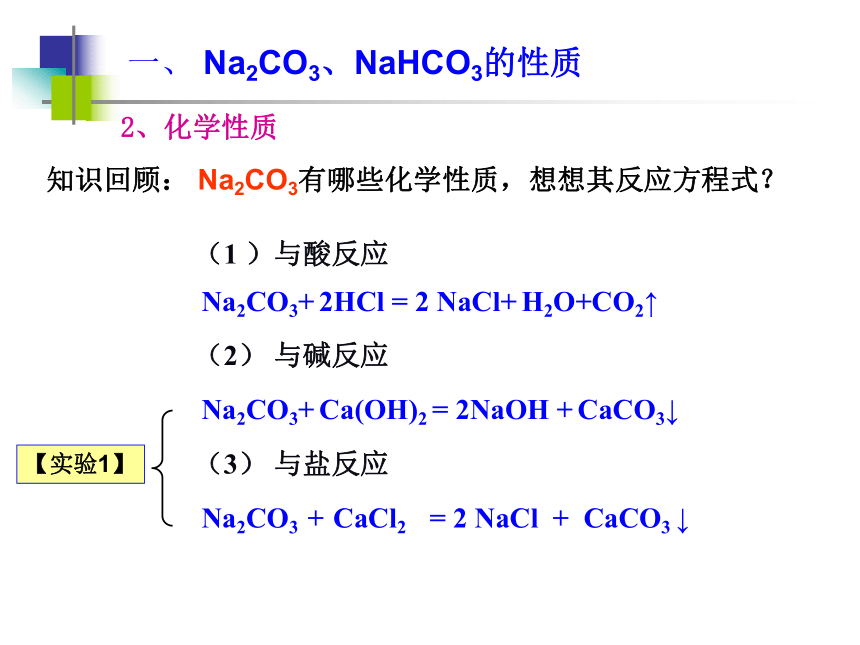
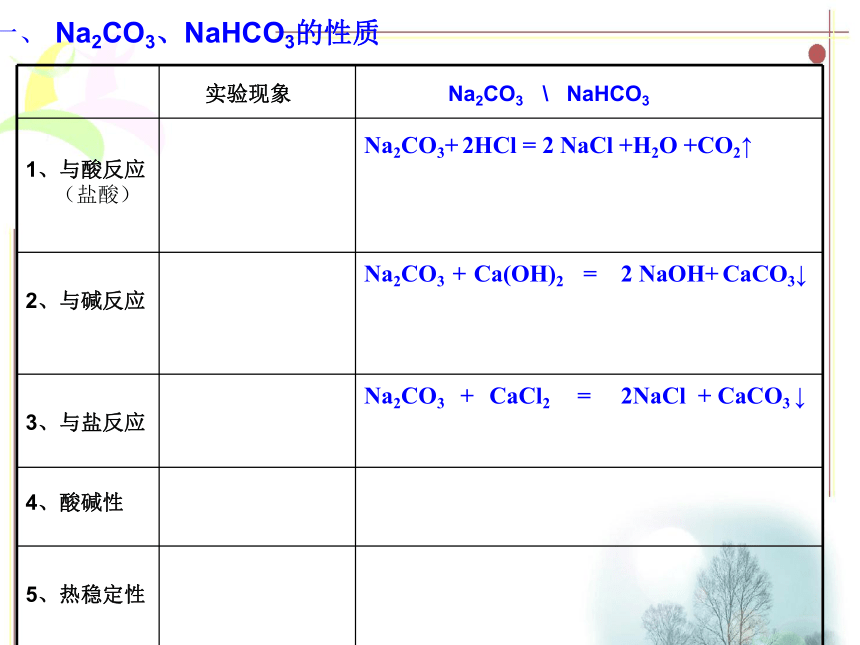
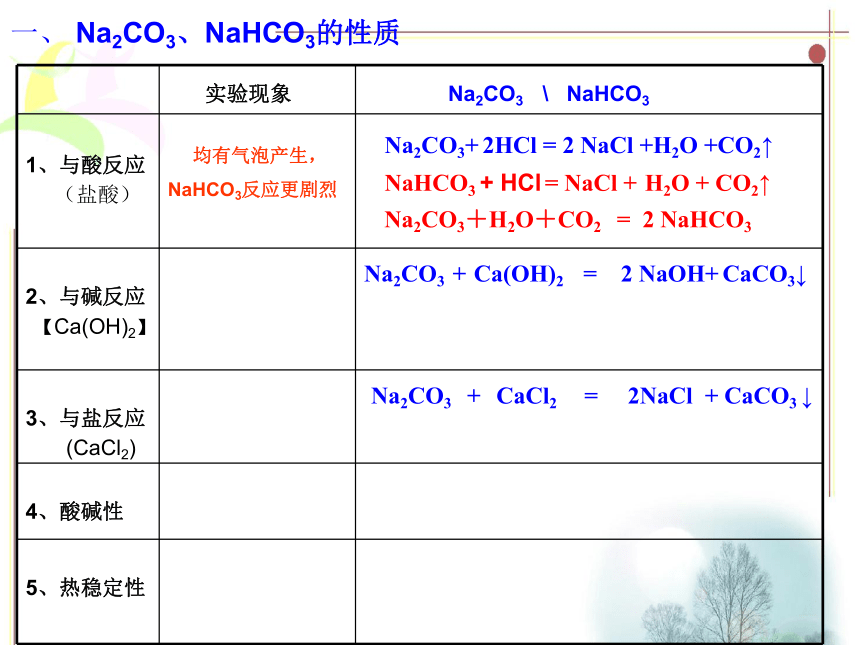
课件19张PPT。专题二:第二单元碳酸钠的性质与应用学习任务一、 Na2CO3、NaHCO3的性质二、 Na2CO3、NaHCO3的应用一、 Na2CO3、NaHCO3的性质Na2CO3 NaHCO3 纯碱、苏打 小苏打白色粉末 白色晶体 盐 盐S=21.5g S=10.4g1、物理性质(酸式盐)(正盐)一、 Na2CO3、NaHCO3的性质Na2CO3+ Ca(OH)2 = 2NaOH + CaCO3↓Na2CO3 + CaCl2 = 2 NaCl + CaCO3 ↓(2) 与碱反应(3) 与盐反应知识回顾: Na2CO3有哪些化学性质,想想其反应方程式?(1 )与酸反应Na2CO3+ 2HCl = 2 NaCl+ H2O+CO2↑2、化学性质一、 Na2CO3、NaHCO3的性质(盐酸)Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓4、酸碱性一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(1) 与酸反应 知识回顾【实验2】观察比较Na2CO3、NaHCO3固体分别与等体积、
等物质的量浓度的盐酸溶液反应现象。现象:澄清又变澄清变浑浊CaCO3 ↓Ca(HCO3)2一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑ 均有气泡产生,(盐酸)【Ca(OH)2】NaHCO3反应更剧烈Na2CO3+H2O+CO2 = 2 NaHCO3(CaCl2)Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(2) 与碱反应Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓CaCO3↓ (3) 与盐反应无现象Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓NaHCO3+ Ca(OH)2 = + CaCO3 ↓均有白色沉淀产生(盐酸)【Ca(OH)2】(CaCl2)Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓前者产生白色沉淀,
后者无现象(固体)Na2CO3+H2O+CO2 = 2 NaHCO3HCO3 - + OH- = H2O + CO3 2- 均有气泡产生,NaHCO3反应更剧烈一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(4) 酸碱性【实验3】 分别测定相同物质的量浓度Na2CO3、NaHCO3溶液的PH。 随堂探究【实验4】 仔细阅读,再结合生活实际,推测该实验的现象是什么? 为什么?一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓NaHCO3+ Ca(OH)2 = + CaCO3 ↓均有白色沉淀产生(盐酸)【Ca(OH)2】(CaCl2)Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓前者产生白色沉淀,
后者无现象相同浓度时,
前者碱性更强热的Na2CO3溶液可用于洗涤油污(固体)Na2CO3+H2O+CO2 = 2 NaHCO3HCO3 - + OH- = H2O + CO3 2-(水溶液) 均有气泡产生,NaHCO3反应更剧烈NaOH+H2O一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(5) 热稳定性 套管实验一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓NaHCO3+ Ca(OH)2 = + CaCO3 ↓均有白色沉淀产生(盐酸)【Ca(OH)2】(CaCl2)Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓前者产生白色沉淀,相同浓度时,
Na2CO3碱性更强热的纯碱溶液可用于洗涤油污(固体)Na2CO3+H2O+CO2 = 2 NaHCO3HCO3 - + OH- = H2O + CO3 2-NaHCO3固体
受热易分解NaOH+H2O(水溶液) 均有气泡产生,NaHCO3反应更剧烈后者无现象例1.鉴别Na2CO3和NaHCO3的方法有很多,下列方法中,
哪些方法为较佳选择? ( )
A.加热
B.两者分别与同浓度的稀盐酸反应
C.溶于水,比较其溶解度大小
D.两者分别加入石灰水或Ba(OH)2
E.加BaCl2或CaCl2稀溶液
F. 测定相同浓度溶液的PH随堂练一练B、E、F随堂练一练例题2、为除去CO2气体中少量的HCl,最好选用
下列哪种试剂 ( )A、饱和食盐水B、NaOH溶液C、饱和Na2CO3溶液D、饱和NaHCO3溶液D随堂练一练例题3、有一包白色Na2CO3粉末,如何证明里面是否混有
NaHCO3?如果有NaHCO3 ,如何除去?例题4、有一瓶无色的NaHCO3溶液,如何证明NaHCO3溶液中
是否混有Na2CO3 ?如果有Na2CO3 ,如何除去?1、取适量样品加热,观察是否能产生使澄清石灰水变浑浊的气体。2、加热样品,直至固体质量不再变化为止。1、取适量样品,滴加适量的CaCl2稀溶液,观察溶液是否变浑浊。2、向样品溶液中通入过量的CO2气体。二、 Na2CO3、NaHCO3的应用玻璃制品造纸、纺 织制 皂、洗涤剂阅读课本P52Na2CO3 :NaHCO3 :发 酵 剂 制药
(治疗胃酸过多)灭火 剂谢谢各位莅临指导! 再 见! 回顾要点内容酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl Na2CO3、 NaHCO3的化学性质
等物质的量浓度的盐酸溶液反应现象。现象:澄清又变澄清变浑浊CaCO3 ↓Ca(HCO3)2一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑ 均有气泡产生,(盐酸)【Ca(OH)2】NaHCO3反应更剧烈Na2CO3+H2O+CO2 = 2 NaHCO3(CaCl2)Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(2) 与碱反应Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓CaCO3↓ (3) 与盐反应无现象Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓NaHCO3+ Ca(OH)2 = + CaCO3 ↓均有白色沉淀产生(盐酸)【Ca(OH)2】(CaCl2)Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓前者产生白色沉淀,
后者无现象(固体)Na2CO3+H2O+CO2 = 2 NaHCO3HCO3 - + OH- = H2O + CO3 2- 均有气泡产生,NaHCO3反应更剧烈一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(4) 酸碱性【实验3】 分别测定相同物质的量浓度Na2CO3、NaHCO3溶液的PH。 随堂探究【实验4】 仔细阅读,再结合生活实际,推测该实验的现象是什么? 为什么?一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓NaHCO3+ Ca(OH)2 = + CaCO3 ↓均有白色沉淀产生(盐酸)【Ca(OH)2】(CaCl2)Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓前者产生白色沉淀,
后者无现象相同浓度时,
前者碱性更强热的Na2CO3溶液可用于洗涤油污(固体)Na2CO3+H2O+CO2 = 2 NaHCO3HCO3 - + OH- = H2O + CO3 2-(水溶液) 均有气泡产生,NaHCO3反应更剧烈NaOH+H2O一、 Na2CO3、NaHCO3的性质酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl2、化学性质(5) 热稳定性 套管实验一、 Na2CO3、NaHCO3的性质Na2CO3+ 2HCl = 2 NaCl +H2O +CO2↑Na2CO3 + Ca(OH)2 = 2 NaOH+ CaCO3↓NaHCO3+ Ca(OH)2 = + CaCO3 ↓均有白色沉淀产生(盐酸)【Ca(OH)2】(CaCl2)Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓前者产生白色沉淀,相同浓度时,
Na2CO3碱性更强热的纯碱溶液可用于洗涤油污(固体)Na2CO3+H2O+CO2 = 2 NaHCO3HCO3 - + OH- = H2O + CO3 2-NaHCO3固体
受热易分解NaOH+H2O(水溶液) 均有气泡产生,NaHCO3反应更剧烈后者无现象例1.鉴别Na2CO3和NaHCO3的方法有很多,下列方法中,
哪些方法为较佳选择? ( )
A.加热
B.两者分别与同浓度的稀盐酸反应
C.溶于水,比较其溶解度大小
D.两者分别加入石灰水或Ba(OH)2
E.加BaCl2或CaCl2稀溶液
F. 测定相同浓度溶液的PH随堂练一练B、E、F随堂练一练例题2、为除去CO2气体中少量的HCl,最好选用
下列哪种试剂 ( )A、饱和食盐水B、NaOH溶液C、饱和Na2CO3溶液D、饱和NaHCO3溶液D随堂练一练例题3、有一包白色Na2CO3粉末,如何证明里面是否混有
NaHCO3?如果有NaHCO3 ,如何除去?例题4、有一瓶无色的NaHCO3溶液,如何证明NaHCO3溶液中
是否混有Na2CO3 ?如果有Na2CO3 ,如何除去?1、取适量样品加热,观察是否能产生使澄清石灰水变浑浊的气体。2、加热样品,直至固体质量不再变化为止。1、取适量样品,滴加适量的CaCl2稀溶液,观察溶液是否变浑浊。2、向样品溶液中通入过量的CO2气体。二、 Na2CO3、NaHCO3的应用玻璃制品造纸、纺 织制 皂、洗涤剂阅读课本P52Na2CO3 :NaHCO3 :发 酵 剂 制药
(治疗胃酸过多)灭火 剂谢谢各位莅临指导! 再 见! 回顾要点内容酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl Na2CO3、 NaHCO3的化学性质
