高中化学苏教版必修1课件专题三:第1单元铝的氧化物与氢氧化物 (共26张ppt)
文档属性
| 名称 | 高中化学苏教版必修1课件专题三:第1单元铝的氧化物与氢氧化物 (共26张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 483.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-10 14:45:28 | ||
图片预览




文档简介
课件26张PPT。专题三 从矿物到基础材料第一单元: 从铝土矿到铝合金
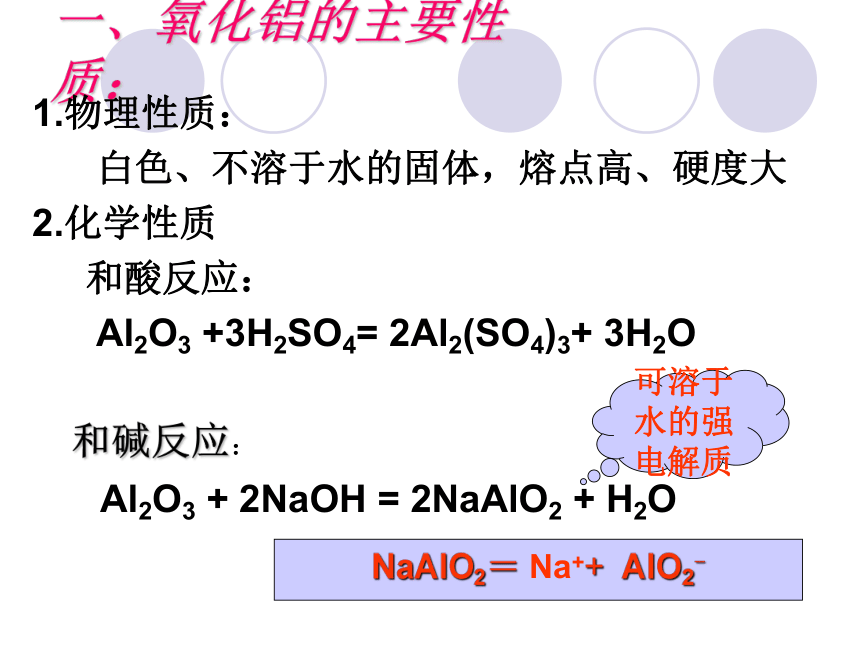
铝的氧化物与氢氧化物 世界上最大的蓝宝石--“东方蓝巨人” 重达486.52克拉 估价为100到150万美元世界上最大的红宝石—卡门-露希娅 重达23.1克拉一、氧化铝的主要性质:1.物理性质:
白色、不溶于水的固体,熔点高、硬度大
2.化学性质
和酸反应:
Al2O3 +3H2SO4= 2Al2(SO4)3+ 3H2O
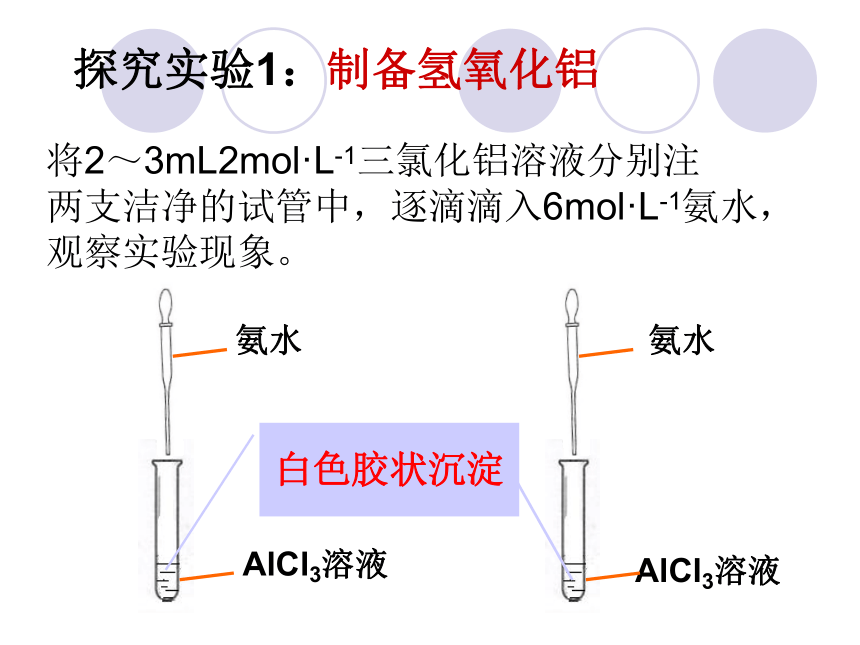
和碱反应: Al2O3 + 2NaOH = 2NaAlO2 + H2ONaAlO2= Na++ AlO2-可溶于水的强电解质酸性氧化物 碱性氧化物既能与酸反应又能与碱反应生成盐和水的氧化物.氧化铝性质归属两性氧化物氢氧化铝探究实验1:制备氢氧化铝将2~3mL2mol·L-1三氯化铝溶液分别注
两支洁净的试管中,逐滴滴入6mol·L-1氨水,
观察实验现象。氨水AlCl3溶液白色胶状沉淀氨水AlCl3溶液1.氢氧化铝的制取
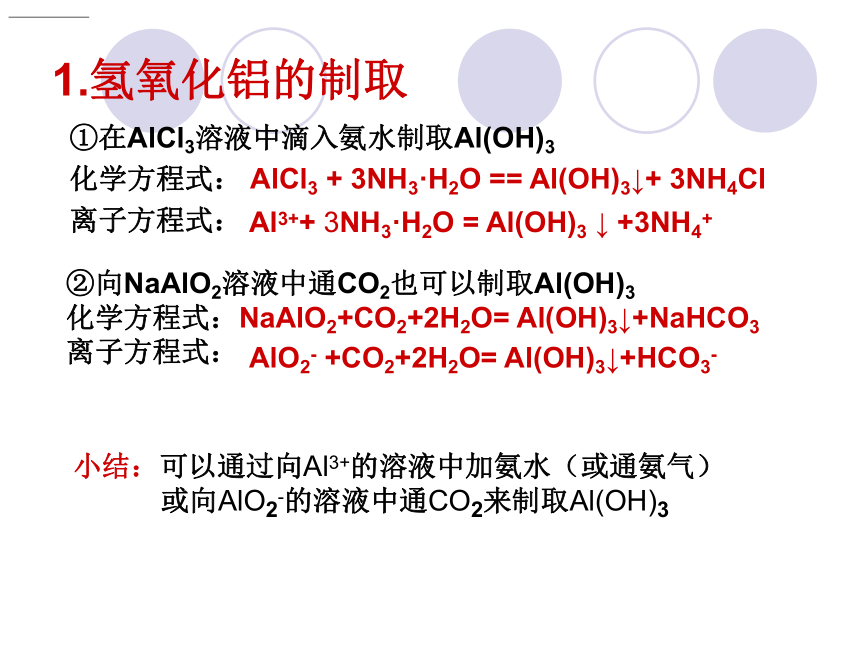
①在AlCl3溶液中滴入氨水制取Al(OH)3
化学方程式: AlCl3 + 3NH3·H2O == Al(OH)3↓+ 3NH4Cl
离子方程式: 小结:可以通过向Al3+的溶液中加氨水(或通氨气)
或向AlO2-的溶液中通CO2来制取Al(OH)3Al3++ 3NH3·H2O = Al(OH)3 ↓ +3NH4+AlO2- +CO2+2H2O= Al(OH)3↓+HCO3-②向NaAlO2溶液中通CO2也可以制取Al(OH)3
化学方程式:NaAlO2+CO2+2H2O= Al(OH)3↓+NaHCO3
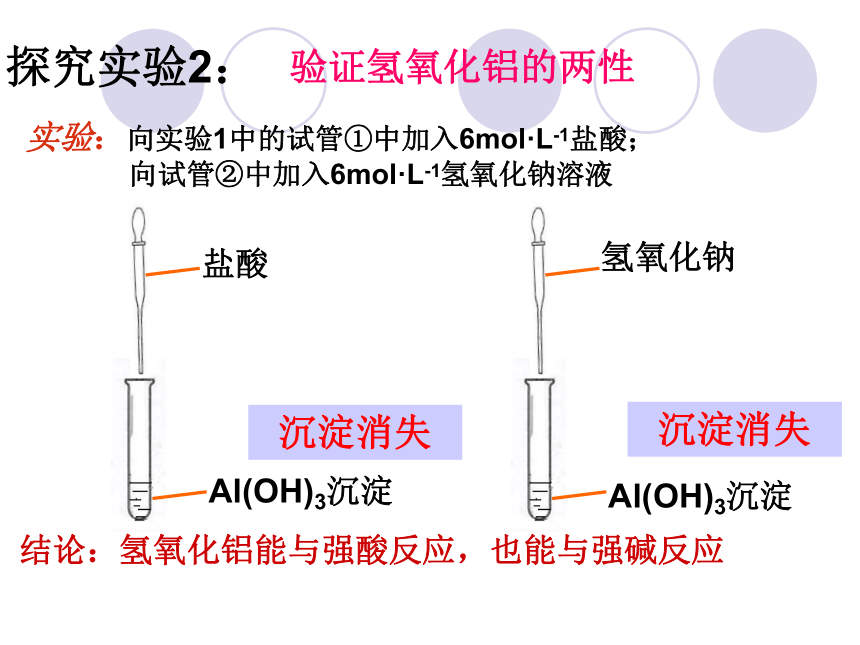
离子方程式:验证氢氧化铝的两性探究实验2: Al(OH)3沉淀盐酸实验:向实验1中的试管①中加入6mol·L-1盐酸;
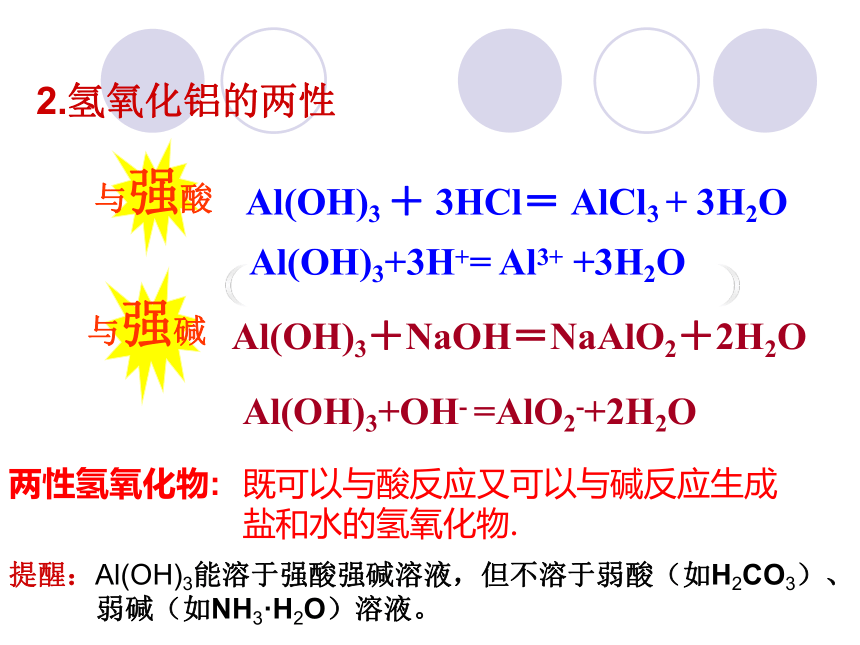
向试管②中加入6mol·L-1氢氧化钠溶液 Al(OH)3沉淀氢氧化钠沉淀消失沉淀消失结论:氢氧化铝能与强酸反应,也能与强碱反应2.氢氧化铝的两性Al(OH)3 + 3HCl= AlCl3 + 3H2O Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH- =AlO2-+2H2OAl(OH)3+3H+= Al3+ +3H2O与强酸:与强碱:两性氢氧化物:既可以与酸反应又可以与碱反应生成盐和水的氢氧化物.提醒:Al(OH)3能溶于强酸强碱溶液,但不溶于弱酸(如H2CO3)、
弱碱(如NH3·H2O)溶液。3.Al(OH)3受热分解为氧化铝和水
规律:难溶性的氢氧化物受热易分解为对应的氧化物和水。
如Fe(OH)3、 Cu(OH)2、 Mg(OH)2 △
2Al(OH)3 == Al2O3+ 3H2O思考:如何除去下列括号内的杂质
Fe2O3(Al2O3)
Fe(OH)3(Al(OH)3)
Al2O3(Al(OH)3)加入NaOH溶液,过滤加入NaOH溶液,过滤加热向实验2得到的AlCl3溶液中不断滴6mol·L-1NaOH溶液
向实验2得到的NaAlO2溶液中不断滴6mol·L-1盐酸AlCl3溶液氢氧化钠NaAlO2溶液盐酸
先沉淀后溶解探究实验3:Al3+和AlO2- 的性质先沉淀后溶解NaAlO2 +HCl+H2O = Al(OH)3 ↓+NaClAlCl3+3NaOH=3NaCl+Al(OH)3↓Al(OH)3+NaOH= NaAlO2+2H2OAl(OH)3 +3HCl = AlCl3 +3H2O4.Al3+和AlO2- 的性质向Al3+的溶液中加氨水: Al3++ 3NH3·H2O = Al(OH)3 ↓ +3NH4+
向Al3+的溶液中加NaOH: Al3++3OH- = Al(OH)3 ↓
Al(OH)3 +OH- = AlO2- +2H2O
向AlO2-的溶液中通CO2: AlO2- +CO2+2H2O= Al(OH)3↓+HCO3-
向AlO2-的溶液中加盐酸: AlO2- +H++H2O = Al(OH)3 ↓
Al(OH)3 +3H+ = Al3++3H2ONaOH过量总反应: Al3++4OH- = AlO2-+2H2O盐酸过量总反应: AlO2- +4H+ = Al3++3H2O 讨论:在用Al3+或AlO2-的溶液来制取Al(OH)3时,
如果用NaOH溶液和盐酸代替氨水和CO2好不好,为什么?5.Al(OH)3的应用1 、 在医学上的应用2 、净水剂中和过多胃酸 ——复方氢氧化铝[商品名称]斯达舒
[成份]本品每粒含氢氧化铝 140毫克,
[药理作用]本品中氢氧化铝 为抗酸药,能中和胃酸并保护 溃疡面;Al(OH)3 +3H+ = Al3++3H2OKAl(SO4)2·12H2O复盐:由两种或两种以上阳离子和一种阴离子组成的盐明矾KAl(SO4)2 = K++ Al3+ + 2SO42-Al3+ + 3H2O Al(OH)3(胶体) + 3H+课堂小结:一、氧化铝
1、物理性质
2、两性氧化物
二、氢氧化铝
1、物理性质
2、两性氢氧化物
三、Al3+和AlO2- 的性质
四、氢氧化铝的应用Al Cl3+ 3NH3·H2O = Al(OH)3 ↓+ 3 NH4 Cln(沉淀) n(NH3·H2O)能否用图像表示出向AlCl3溶液中滴加氨水时,
随着氨水的滴加,Al(OH)3沉淀量的变化情况?学以致用化学方程式:⑴AlCl3+3NaOH=Al(OH)3↓+3NaCln(沉淀)n(沉淀) n(NaOH)n(沉淀)⑵Al(OH)3+NaOH=NaAlO2+2H2O学以致用1 3 11 1如果向AlCl3溶液中滴加NaOH溶液则图像又是如何呢?化学方程式:⑴ NaAlO2 +HCl+H2O = Al(OH)3 ↓+NaCln(沉淀)n(沉淀) n(HCl)n(沉淀)⑵Al(OH)3 +3HCl = AlCl3 +3H2O
1 1 11 3学以致用如果向NaAlO2溶液中滴加盐酸则图像又是如何呢?谢大家谢探究实验2: 实验: 取1~2mL AlCl3溶液,向其中逐滴滴入氨水和氢氧化钠AlCl3溶液氨水制备氢氧化铝AlCl3溶液氢氧化钠
白色胶状沉淀结论:铝盐溶液能与碱溶液反应,生成氢氧化铝白色胶状沉淀。验证氢氧化铝的两性活动探究二Al(OH)3沉淀氨水实验:分别向 Al(OH)3中滴加氨水和NaOH溶液Al(OH)3沉淀NaOH沉淀消失沉淀消失结论:氢氧化铝能与强碱反应,但不与弱碱反应,有酸性。四.明矾的净水作用
1.复盐:有两种或两种以上的 和一种 组成的盐,明矾的化学式是
2.明矾的净水原理
电离→明矾溶于水电离出K+、Al3+、SO42-
↓
生成胶体→
↓
吸附杂质→能吸附水中悬浮物使之沉降,
达到净水的目的【问题讨论 】
请你根据所学的内容,讨论实验室制备氢氧化铝的合适的方法。 答案:实验室一般用铝盐溶液与氨水反应,制备氢氧化铝。AlCl3+3NaOH=3NaCl+Al(OH)3↓Al(OH)3+NaOH= NaAlO2+2H2OAlCl3+4NaOH=3NaCl+ NaAlO2+2H2O氢氧化铝的实验室制备课堂小结Al(OH)3Al3+AlO2-H+氨水或适量OH-OH-适量H+或通入CO2过量OH-过量H+“铝三角”
铝的氧化物与氢氧化物 世界上最大的蓝宝石--“东方蓝巨人” 重达486.52克拉 估价为100到150万美元世界上最大的红宝石—卡门-露希娅 重达23.1克拉一、氧化铝的主要性质:1.物理性质:
白色、不溶于水的固体,熔点高、硬度大
2.化学性质
和酸反应:
Al2O3 +3H2SO4= 2Al2(SO4)3+ 3H2O
和碱反应: Al2O3 + 2NaOH = 2NaAlO2 + H2ONaAlO2= Na++ AlO2-可溶于水的强电解质酸性氧化物 碱性氧化物既能与酸反应又能与碱反应生成盐和水的氧化物.氧化铝性质归属两性氧化物氢氧化铝探究实验1:制备氢氧化铝将2~3mL2mol·L-1三氯化铝溶液分别注
两支洁净的试管中,逐滴滴入6mol·L-1氨水,
观察实验现象。氨水AlCl3溶液白色胶状沉淀氨水AlCl3溶液1.氢氧化铝的制取
①在AlCl3溶液中滴入氨水制取Al(OH)3
化学方程式: AlCl3 + 3NH3·H2O == Al(OH)3↓+ 3NH4Cl
离子方程式: 小结:可以通过向Al3+的溶液中加氨水(或通氨气)
或向AlO2-的溶液中通CO2来制取Al(OH)3Al3++ 3NH3·H2O = Al(OH)3 ↓ +3NH4+AlO2- +CO2+2H2O= Al(OH)3↓+HCO3-②向NaAlO2溶液中通CO2也可以制取Al(OH)3
化学方程式:NaAlO2+CO2+2H2O= Al(OH)3↓+NaHCO3
离子方程式:验证氢氧化铝的两性探究实验2: Al(OH)3沉淀盐酸实验:向实验1中的试管①中加入6mol·L-1盐酸;
向试管②中加入6mol·L-1氢氧化钠溶液 Al(OH)3沉淀氢氧化钠沉淀消失沉淀消失结论:氢氧化铝能与强酸反应,也能与强碱反应2.氢氧化铝的两性Al(OH)3 + 3HCl= AlCl3 + 3H2O Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH- =AlO2-+2H2OAl(OH)3+3H+= Al3+ +3H2O与强酸:与强碱:两性氢氧化物:既可以与酸反应又可以与碱反应生成盐和水的氢氧化物.提醒:Al(OH)3能溶于强酸强碱溶液,但不溶于弱酸(如H2CO3)、
弱碱(如NH3·H2O)溶液。3.Al(OH)3受热分解为氧化铝和水
规律:难溶性的氢氧化物受热易分解为对应的氧化物和水。
如Fe(OH)3、 Cu(OH)2、 Mg(OH)2 △
2Al(OH)3 == Al2O3+ 3H2O思考:如何除去下列括号内的杂质
Fe2O3(Al2O3)
Fe(OH)3(Al(OH)3)
Al2O3(Al(OH)3)加入NaOH溶液,过滤加入NaOH溶液,过滤加热向实验2得到的AlCl3溶液中不断滴6mol·L-1NaOH溶液
向实验2得到的NaAlO2溶液中不断滴6mol·L-1盐酸AlCl3溶液氢氧化钠NaAlO2溶液盐酸
先沉淀后溶解探究实验3:Al3+和AlO2- 的性质先沉淀后溶解NaAlO2 +HCl+H2O = Al(OH)3 ↓+NaClAlCl3+3NaOH=3NaCl+Al(OH)3↓Al(OH)3+NaOH= NaAlO2+2H2OAl(OH)3 +3HCl = AlCl3 +3H2O4.Al3+和AlO2- 的性质向Al3+的溶液中加氨水: Al3++ 3NH3·H2O = Al(OH)3 ↓ +3NH4+
向Al3+的溶液中加NaOH: Al3++3OH- = Al(OH)3 ↓
Al(OH)3 +OH- = AlO2- +2H2O
向AlO2-的溶液中通CO2: AlO2- +CO2+2H2O= Al(OH)3↓+HCO3-
向AlO2-的溶液中加盐酸: AlO2- +H++H2O = Al(OH)3 ↓
Al(OH)3 +3H+ = Al3++3H2ONaOH过量总反应: Al3++4OH- = AlO2-+2H2O盐酸过量总反应: AlO2- +4H+ = Al3++3H2O 讨论:在用Al3+或AlO2-的溶液来制取Al(OH)3时,
如果用NaOH溶液和盐酸代替氨水和CO2好不好,为什么?5.Al(OH)3的应用1 、 在医学上的应用2 、净水剂中和过多胃酸 ——复方氢氧化铝[商品名称]斯达舒
[成份]本品每粒含氢氧化铝 140毫克,
[药理作用]本品中氢氧化铝 为抗酸药,能中和胃酸并保护 溃疡面;Al(OH)3 +3H+ = Al3++3H2OKAl(SO4)2·12H2O复盐:由两种或两种以上阳离子和一种阴离子组成的盐明矾KAl(SO4)2 = K++ Al3+ + 2SO42-Al3+ + 3H2O Al(OH)3(胶体) + 3H+课堂小结:一、氧化铝
1、物理性质
2、两性氧化物
二、氢氧化铝
1、物理性质
2、两性氢氧化物
三、Al3+和AlO2- 的性质
四、氢氧化铝的应用Al Cl3+ 3NH3·H2O = Al(OH)3 ↓+ 3 NH4 Cln(沉淀) n(NH3·H2O)能否用图像表示出向AlCl3溶液中滴加氨水时,
随着氨水的滴加,Al(OH)3沉淀量的变化情况?学以致用化学方程式:⑴AlCl3+3NaOH=Al(OH)3↓+3NaCln(沉淀)n(沉淀) n(NaOH)n(沉淀)⑵Al(OH)3+NaOH=NaAlO2+2H2O学以致用1 3 11 1如果向AlCl3溶液中滴加NaOH溶液则图像又是如何呢?化学方程式:⑴ NaAlO2 +HCl+H2O = Al(OH)3 ↓+NaCln(沉淀)n(沉淀) n(HCl)n(沉淀)⑵Al(OH)3 +3HCl = AlCl3 +3H2O
1 1 11 3学以致用如果向NaAlO2溶液中滴加盐酸则图像又是如何呢?谢大家谢探究实验2: 实验: 取1~2mL AlCl3溶液,向其中逐滴滴入氨水和氢氧化钠AlCl3溶液氨水制备氢氧化铝AlCl3溶液氢氧化钠
白色胶状沉淀结论:铝盐溶液能与碱溶液反应,生成氢氧化铝白色胶状沉淀。验证氢氧化铝的两性活动探究二Al(OH)3沉淀氨水实验:分别向 Al(OH)3中滴加氨水和NaOH溶液Al(OH)3沉淀NaOH沉淀消失沉淀消失结论:氢氧化铝能与强碱反应,但不与弱碱反应,有酸性。四.明矾的净水作用
1.复盐:有两种或两种以上的 和一种 组成的盐,明矾的化学式是
2.明矾的净水原理
电离→明矾溶于水电离出K+、Al3+、SO42-
↓
生成胶体→
↓
吸附杂质→能吸附水中悬浮物使之沉降,
达到净水的目的【问题讨论 】
请你根据所学的内容,讨论实验室制备氢氧化铝的合适的方法。 答案:实验室一般用铝盐溶液与氨水反应,制备氢氧化铝。AlCl3+3NaOH=3NaCl+Al(OH)3↓Al(OH)3+NaOH= NaAlO2+2H2OAlCl3+4NaOH=3NaCl+ NaAlO2+2H2O氢氧化铝的实验室制备课堂小结Al(OH)3Al3+AlO2-H+氨水或适量OH-OH-适量H+或通入CO2过量OH-过量H+“铝三角”
