高中化学苏教版必修1课件专题四:第1单元二氧化硫的性质和作用(共20张ppt)
文档属性
| 名称 | 高中化学苏教版必修1课件专题四:第1单元二氧化硫的性质和作用(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-10 17:29:42 | ||
图片预览








文档简介
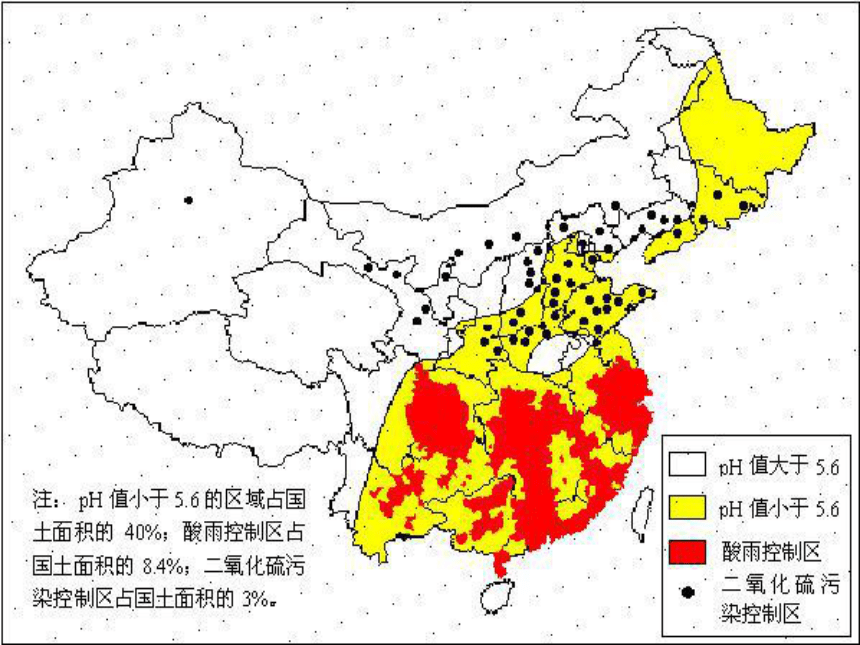
课件20张PPT。诵读预热 酸雨被称为“天堂的眼泪”,因为它给我们带来了多方面的危害。它进入江河湖泊,会导致鱼类难以生存,影响水生生物的繁殖;它落至于土壤中,使土壤营养元素流失,肥力下降、酸化,农作物和树木生长遭破坏;它使桥梁、雕塑等建筑物的腐蚀速度加快,许多古迹遭到严重破坏。二氧化硫的性质和作用【学习目标】
1、了解二氧化硫的物理性质和用途,掌握二氧化硫的化学性质。
2、了解硫酸型酸雨的形成原因、危害及其防治的原理。观察与思考 先观察袋中SO2,再用排尽空气的针筒吸入蒸馏水约10ml,穿透橡胶塞注入袋中,拔出针筒震荡,观察袋子的变化。
实验完毕后,用排尽空气的针筒抽取约6ml袋中的溶液,盖上针盖备用。SO2能否溶于水?一、SO2的物理性质 1、无色气体 2、易溶于水 ( 1 : 40 ) 3、比空气密度大有刺激性气味有毒观察与思考:SO2+H2O H2SO3 将一小块PH试纸和石蕊试纸放在点滴板上,再将针筒中少量SO2水溶液注射到试纸上。实验完毕后盖上针盖。弱酸
比碳酸酸性强SO2溶于水后,能否使水溶液成酸性呢? 二. 化学性质:1、 酸性氧化物的性质
SO2与NaOH反应:SO2与澄清石灰水反应:交流与讨论某学习小组在一硫酸厂附近采集了酸雨样品,数据如下表,请大家探究一下为什么PH值发生变化
2H2SO3 + O2 = 2H2SO4+4 +6 活动与探究请设计实验证明SO2的还原性 注意:实验是在点滴板中进行的微量实验,在点滴板中加1滴你选择的溶液,再将针筒中少量SO2水溶液注射到你需要反应的试剂里(针头不要与试剂接触)。实验完毕后盖上针盖。SO2能使酸性 KMnO4溶液褪色SO2能使溴水褪色 2、还原性SO2+Br2+ H2O=+4H2SO4+6+ HBr0-12 2BaCl2+ H2SO4==BaSO4 ↓+2HCl小结: SO2具有较强的还原性,可以被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化SO2+H2O+ BaCl2=BaSO3 ↓ +2HCl 2H2SO3 + O2 = 2H2SO4 在装有少量(约1cm高度)BaCl2溶液的试管中,注射SO2水溶液约2ml,多次震荡,观察现象,分析原因。活动与探究 请大家回顾我们的学习过程,写出SO2排放到大气中形成酸雨的方程式。SO3 + H2O = H2SO42H2SO3 + O2= 2H2SO4SO2 + H2O H2SO3①②交流与讨论(1)火山的爆发(3)含硫矿石的冶炼(4)硫酸、磷酸、纸浆生产的工业废气(2)主要来自化石燃料的燃烧SO2主要来源于哪里?酸雨的防治 ①研究开发能代替化石燃料的新能源;氢能、太阳能、核能。②对含硫燃料进行预先脱硫处理;③对释放的二氧化硫进行处理或回收利用;④提高全民的环保意识,加强国际合作。SO2的应用 在试管中滴入2滴品红溶液,注射SO2的水溶液约2ml,立即在试管口套上气球,震荡试管,观察溶液颜色的变化。 再将反应后溶液加热,观察溶液颜色的变化。观察与思考:氯水的漂白与SO2漂白有何不同呢?氧化漂白永久性漂白漂白大多数有色物质,能漂白酸碱指示剂暂时性,长时间或加热可恢复漂白某些有色物质,不能使酸碱指示剂褪色
化合漂白 3、漂白性物理性质化学性质2、还原性:会被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化
SO2+X2+2H2O=H2SO4+2HX
二氧化硫1、具有酸性氧化物的性质A、与水反应生成酸 SO2 + H2O H2SO3
B、与碱Ca(OH)2或NaOH反应生成盐和水 SO2 + 2 NaOH Na2SO3 + H2O
3、漂白性:暂时性漂白
无色、有刺激性气味、
有毒、密度比空气大、
易溶于水
1、SO2有漂白性,氯水有漂白性,如果将二者等物质的量混合,漂白性是不是更强?当堂检测
2、向一瓶未知的红色溶液中通入SO2,红色褪去,请你猜想红色溶液可能是什么溶液?并设计实验证明你的猜想。品红溶液滴有酚酞的NaOH溶液酸性KMnO4溶液
1、了解二氧化硫的物理性质和用途,掌握二氧化硫的化学性质。
2、了解硫酸型酸雨的形成原因、危害及其防治的原理。观察与思考 先观察袋中SO2,再用排尽空气的针筒吸入蒸馏水约10ml,穿透橡胶塞注入袋中,拔出针筒震荡,观察袋子的变化。
实验完毕后,用排尽空气的针筒抽取约6ml袋中的溶液,盖上针盖备用。SO2能否溶于水?一、SO2的物理性质 1、无色气体 2、易溶于水 ( 1 : 40 ) 3、比空气密度大有刺激性气味有毒观察与思考:SO2+H2O H2SO3 将一小块PH试纸和石蕊试纸放在点滴板上,再将针筒中少量SO2水溶液注射到试纸上。实验完毕后盖上针盖。弱酸
比碳酸酸性强SO2溶于水后,能否使水溶液成酸性呢? 二. 化学性质:1、 酸性氧化物的性质
SO2与NaOH反应:SO2与澄清石灰水反应:交流与讨论某学习小组在一硫酸厂附近采集了酸雨样品,数据如下表,请大家探究一下为什么PH值发生变化
2H2SO3 + O2 = 2H2SO4+4 +6 活动与探究请设计实验证明SO2的还原性 注意:实验是在点滴板中进行的微量实验,在点滴板中加1滴你选择的溶液,再将针筒中少量SO2水溶液注射到你需要反应的试剂里(针头不要与试剂接触)。实验完毕后盖上针盖。SO2能使酸性 KMnO4溶液褪色SO2能使溴水褪色 2、还原性SO2+Br2+ H2O=+4H2SO4+6+ HBr0-12 2BaCl2+ H2SO4==BaSO4 ↓+2HCl小结: SO2具有较强的还原性,可以被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化SO2+H2O+ BaCl2=BaSO3 ↓ +2HCl 2H2SO3 + O2 = 2H2SO4 在装有少量(约1cm高度)BaCl2溶液的试管中,注射SO2水溶液约2ml,多次震荡,观察现象,分析原因。活动与探究 请大家回顾我们的学习过程,写出SO2排放到大气中形成酸雨的方程式。SO3 + H2O = H2SO42H2SO3 + O2= 2H2SO4SO2 + H2O H2SO3①②交流与讨论(1)火山的爆发(3)含硫矿石的冶炼(4)硫酸、磷酸、纸浆生产的工业废气(2)主要来自化石燃料的燃烧SO2主要来源于哪里?酸雨的防治 ①研究开发能代替化石燃料的新能源;氢能、太阳能、核能。②对含硫燃料进行预先脱硫处理;③对释放的二氧化硫进行处理或回收利用;④提高全民的环保意识,加强国际合作。SO2的应用 在试管中滴入2滴品红溶液,注射SO2的水溶液约2ml,立即在试管口套上气球,震荡试管,观察溶液颜色的变化。 再将反应后溶液加热,观察溶液颜色的变化。观察与思考:氯水的漂白与SO2漂白有何不同呢?氧化漂白永久性漂白漂白大多数有色物质,能漂白酸碱指示剂暂时性,长时间或加热可恢复漂白某些有色物质,不能使酸碱指示剂褪色
化合漂白 3、漂白性物理性质化学性质2、还原性:会被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化
SO2+X2+2H2O=H2SO4+2HX
二氧化硫1、具有酸性氧化物的性质A、与水反应生成酸 SO2 + H2O H2SO3
B、与碱Ca(OH)2或NaOH反应生成盐和水 SO2 + 2 NaOH Na2SO3 + H2O
3、漂白性:暂时性漂白
无色、有刺激性气味、
有毒、密度比空气大、
易溶于水
1、SO2有漂白性,氯水有漂白性,如果将二者等物质的量混合,漂白性是不是更强?当堂检测
2、向一瓶未知的红色溶液中通入SO2,红色褪去,请你猜想红色溶液可能是什么溶液?并设计实验证明你的猜想。品红溶液滴有酚酞的NaOH溶液酸性KMnO4溶液
