选修4原电池
图片预览











文档简介
课件33张PPT。第四章 电化学基础第一节 原电池高二化学选修四病 例 分 析病 例 分 析一位年轻的化学家来看望格林太太,并为格林太太揭开了病因。病 例 分 析化学家发现了什么?你能为格林太太开一个药方吗?由于金与铁(钢的主要成分)
是活动性不同的两种金属,
唾液中含有电解质,故构成了
原电池,产生了微小的电流,
使得格林太太头痛,因此必须
换掉其中的一颗假牙。学习目标1.了解盐桥的作用,了解双池原电池的优点
2. 会正确判断原电池的正极和负极。
3. 学会原电池电极反应式的书写方法
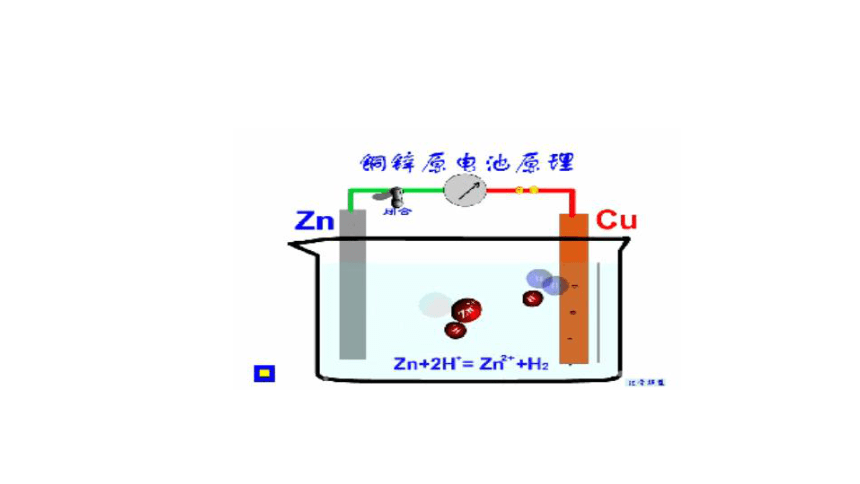
4.理解原电池的工作原理稀硫酸锌铜复习回顾1定义:原电池是______________________的装置。原电池反应的本质是____________________反应。将化学能转化为电能氧化还原反应2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:Zn电极是____(填正”或“负”)极,其电极反应为_______________,反应
是______(填“氧化”或“还原”,下同)反应;Cu
电极是______极,其电极反应为_______________,该反
应是_________反应。(2)当电解质溶液为CuSO4溶液时: Zn电极是____极,其电极反应为_____________,该反应是________反应;Cu电极是____极,其电极反应为_______________,该反应_____反应.负Zn-2e- = Zn2+氧化正2H+ +2e- =H2↑还原负Zn-2e- =Zn2+氧化正Cu2+ +2e- = Cu还原氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液
失e,沿导线传递,有电流产生还原反应Cu2++2e- =Cu阴离子阳离子负极正极 阳离子外电路内电路原 电 池 原 理提出问题:
上面是我们在必修2中学习过的将锌片和铜片置于稀硫酸
的原电池,如果用它做电源,不但效率低,而且时间稍长
电流就很快减弱,因此不适合实际应用。这是什么原因造
成的呢?有没有什么改进措施?造成的主要原因:由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。且锌
和硫酸直接接触,电池不工作,反应也会进行。讨论交流硫酸锌改进后的装置有电流通过吗?
怎么改进装置此电池的优点:
能产生持续、稳定的电流。设计如下图(书P71图4-1)所示的原电池装置盐桥制法:
1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。实验(书71页实验4-1)实验探索实验现象:分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?参考教材72页 第三段 有盐桥存在时电流计指针发生偏转,即有电流通过电路。
取出盐桥,电流计指针即回到零点,说明没有电流通过。盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。 由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。(2)平衡电荷。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。工作原理图请同学们思考:指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。ZnSO4溶液 CuSO4溶液负极(锌片): Zn-2e- =Zn2+ (氧化反应)正极(铜片): Cu2+ +2e-=Cu (还原反应)电池反应(总离子方程式):Zn + Cu2+ = Zn 2+ + Cu 一、对锌铜原电 池工作原理的进一步探究? 氯化铁溶液碳铜三、由两个半电池组成原电池的特点1、把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
2、在原电池的内部,两极浸在电解质溶液中,并通过盐桥中阴阳离子的定向运动而形成内电路。实验探究形成原电池的条件(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等第一组实验(可以)(不可以)形成条件二:电极需插进电解质溶液中
第二组实验实验探究形成原电池的条件第三组实验实验探究形成原电池的条件形成条件三:必须形成闭合回路(不可以)条件四个两个活泼性不同的电极电解质溶液闭合回路自发进行氧化还原反应四、原电池的构成条件ABCDEFMN1.下列哪几个装置能形成原电池?OVXVVXXXXV五、原电池的正负极的判断方法 微观判断
(根据电子流动方向)电子流出的极
电子流入的极——负极
——正极较活泼的电极材料
较不活泼的电极材料 质量增加的电极
工作后
质量减少的电极——负极
——正极——正极
——负极工作后,有气泡冒出的电极为正极发生氧化反应的极
发生还原反应的极宏观判断:
①根据电极材料
②根据原电池电极发生
的反应
③根据电极增重还是减重
④根据电极有气泡冒出:——负极
——正极例题B池:因为Al可以与NaOH溶液反应而Mg不能,所以负极是Al,正极是Mg。
A池:Mg是负极,Al是正极。1.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小C把a、b、c、d四块金属片浸入稀酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡产生.则四种金属的活动性顺序由强到弱为( )
A.a>b>c>d
B.c>a>b>d
C.a>c>d>b
D.b>d>c>ac
例题原电池小结定义形成条件正负极判断工作原理(氧化还原反应,熟写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢判断溶液pH变化金属的电化学腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(四点记住)课后作业
完成书上课后习题P73
1--6谢谢观赏
是活动性不同的两种金属,
唾液中含有电解质,故构成了
原电池,产生了微小的电流,
使得格林太太头痛,因此必须
换掉其中的一颗假牙。学习目标1.了解盐桥的作用,了解双池原电池的优点
2. 会正确判断原电池的正极和负极。
3. 学会原电池电极反应式的书写方法
4.理解原电池的工作原理稀硫酸锌铜复习回顾1定义:原电池是______________________的装置。原电池反应的本质是____________________反应。将化学能转化为电能氧化还原反应2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:Zn电极是____(填正”或“负”)极,其电极反应为_______________,反应
是______(填“氧化”或“还原”,下同)反应;Cu
电极是______极,其电极反应为_______________,该反
应是_________反应。(2)当电解质溶液为CuSO4溶液时: Zn电极是____极,其电极反应为_____________,该反应是________反应;Cu电极是____极,其电极反应为_______________,该反应_____反应.负Zn-2e- = Zn2+氧化正2H+ +2e- =H2↑还原负Zn-2e- =Zn2+氧化正Cu2+ +2e- = Cu还原氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液
失e,沿导线传递,有电流产生还原反应Cu2++2e- =Cu阴离子阳离子负极正极 阳离子外电路内电路原 电 池 原 理提出问题:
上面是我们在必修2中学习过的将锌片和铜片置于稀硫酸
的原电池,如果用它做电源,不但效率低,而且时间稍长
电流就很快减弱,因此不适合实际应用。这是什么原因造
成的呢?有没有什么改进措施?造成的主要原因:由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。且锌
和硫酸直接接触,电池不工作,反应也会进行。讨论交流硫酸锌改进后的装置有电流通过吗?
怎么改进装置此电池的优点:
能产生持续、稳定的电流。设计如下图(书P71图4-1)所示的原电池装置盐桥制法:
1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。实验(书71页实验4-1)实验探索实验现象:分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?参考教材72页 第三段 有盐桥存在时电流计指针发生偏转,即有电流通过电路。
取出盐桥,电流计指针即回到零点,说明没有电流通过。盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。 由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。(2)平衡电荷。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。工作原理图请同学们思考:指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。ZnSO4溶液 CuSO4溶液负极(锌片): Zn-2e- =Zn2+ (氧化反应)正极(铜片): Cu2+ +2e-=Cu (还原反应)电池反应(总离子方程式):Zn + Cu2+ = Zn 2+ + Cu 一、对锌铜原电 池工作原理的进一步探究? 氯化铁溶液碳铜三、由两个半电池组成原电池的特点1、把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
2、在原电池的内部,两极浸在电解质溶液中,并通过盐桥中阴阳离子的定向运动而形成内电路。实验探究形成原电池的条件(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等第一组实验(可以)(不可以)形成条件二:电极需插进电解质溶液中
第二组实验实验探究形成原电池的条件第三组实验实验探究形成原电池的条件形成条件三:必须形成闭合回路(不可以)条件四个两个活泼性不同的电极电解质溶液闭合回路自发进行氧化还原反应四、原电池的构成条件ABCDEFMN1.下列哪几个装置能形成原电池?OVXVVXXXXV五、原电池的正负极的判断方法 微观判断
(根据电子流动方向)电子流出的极
电子流入的极——负极
——正极较活泼的电极材料
较不活泼的电极材料 质量增加的电极
工作后
质量减少的电极——负极
——正极——正极
——负极工作后,有气泡冒出的电极为正极发生氧化反应的极
发生还原反应的极宏观判断:
①根据电极材料
②根据原电池电极发生
的反应
③根据电极增重还是减重
④根据电极有气泡冒出:——负极
——正极例题B池:因为Al可以与NaOH溶液反应而Mg不能,所以负极是Al,正极是Mg。
A池:Mg是负极,Al是正极。1.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小C把a、b、c、d四块金属片浸入稀酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡产生.则四种金属的活动性顺序由强到弱为( )
A.a>b>c>d
B.c>a>b>d
C.a>c>d>b
D.b>d>c>ac
例题原电池小结定义形成条件正负极判断工作原理(氧化还原反应,熟写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢判断溶液pH变化金属的电化学腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(四点记住)课后作业
完成书上课后习题P73
1--6谢谢观赏
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
