高中化学人教版(新课程标准)必修1部分酸、碱和盐的溶解性表(39张)
文档属性
| 名称 | 高中化学人教版(新课程标准)必修1部分酸、碱和盐的溶解性表(39张) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-19 22:39:26 | ||
图片预览








文档简介
课件39张PPT。人教版化学必修1附录Ⅱ
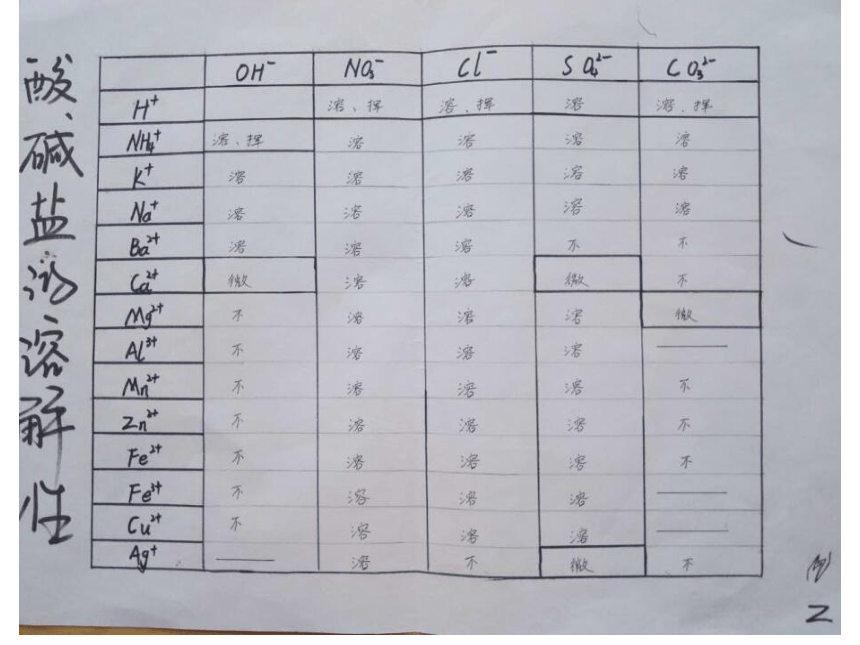
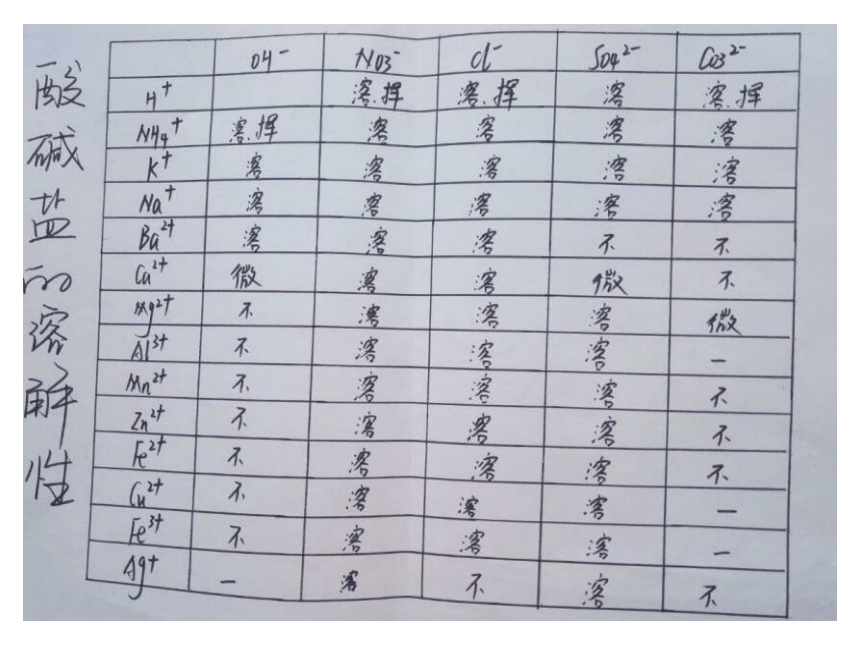
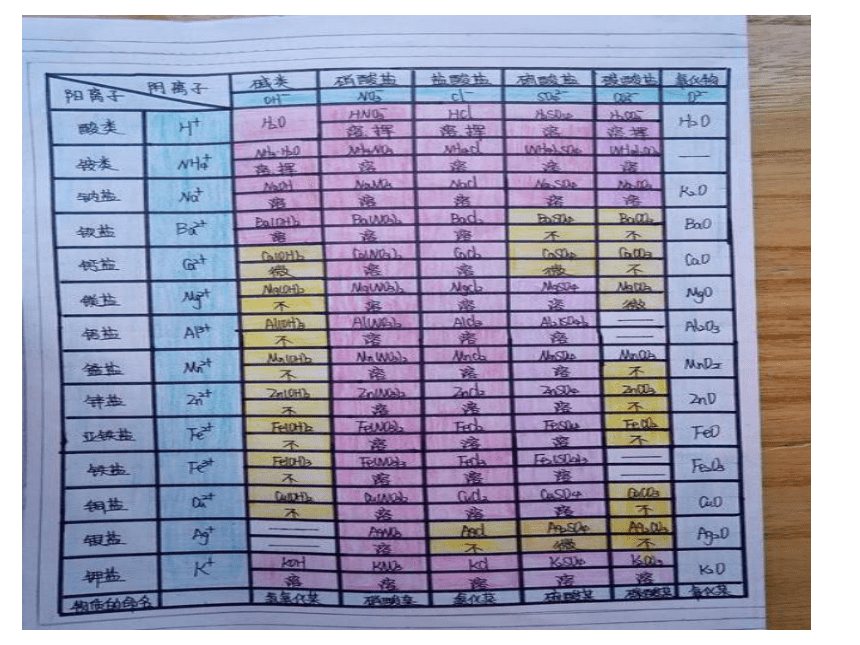
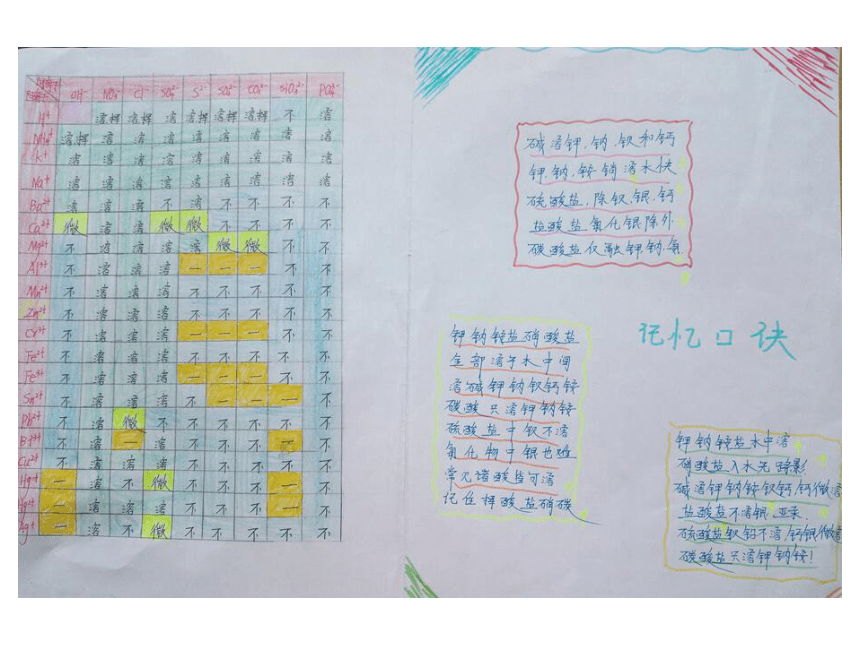
部分酸、碱和盐的溶解性表(室温)情景引入 《三国演义》第八十九回,描述诸葛亮南征到了云南西洱河。并第四次放回孟获孟获逃到秃龙洞,秃龙大王夸口借助四个毒泉就可以消灭蜀汉军队。这四个毒泉是哑泉、灭泉、黑泉和柔泉。
其中哑泉“其水颇甜,人若饮之,则不能言,不过旬日必死”。蜀汉将军王平所率领的几百名先头部队,就因喝了哑泉水,个个成了哑巴,指着嘴巴说不出话来。后来多亏一位老叟的指点,喝了“安乐泉”泉水,吐出恶涎,才得以解救。
【小故事】 思考:喝了哑泉水的人为什么说不出话来?喝了安乐泉水为什么会解救呢? 故事中误喝了泉水的军士们个个说不出话来。原因是因为士兵喝的水中含有CuSO4,造成了重金属中毒。后经一老叟指点,喝了安乐泉水后转危为安。因该泉水中含有较多的碱,碱与CuSO4发生了离子反应Cu2++2OH-=Cu(OH)2↓使原来可溶性的铜盐变成了不溶性的Cu(OH)2沉淀,这样就不会被人体吸收。【故事解读】 Cu(OH)2为难溶性的碱, CuSO4为可溶性的铜盐,它们的溶解性可以根据课本后面的附录Ⅱ部分酸、碱和盐的溶解性表得知,这节课我们学习的主要内容就是酸碱盐的溶解性表及其应用。【新课引入】 必修1附录Ⅱ 部分酸、碱、盐的溶解性表(室温) 【学习目标】
一、掌握酸碱盐的溶解性表。 (重点)
二、学会运用酸碱盐的溶解性表去判断复分解反应能否发生。 (难点)
三、学会运用酸碱盐的溶解性表来正确书写离子方程式(难点)
四、通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存(难点)
1.掌握酸碱盐的溶解性表。
2.学会运用酸碱盐的溶解性表来正确书写离子方程式。(重点)
3.通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存。(重点) 【预习成果及导学案部分展示 】学习成果展示部分酸、碱、盐的溶解性表课前导学案展示 【学习任务一】 【课堂探究一】 酸碱盐溶解性表的识图和记忆技巧
【学与问】
1.酸碱盐的溶解性表如何解读?
2.酸碱盐的溶解性表如何记忆?有什么规律?【学生分组学习成果交流】【课堂导学案】学习成果交流学习成果交流你真棒!优异的成绩属于真正的有心人!
(一)学会运用酸碱盐的溶解性表去判断物质的溶解性
(二)学会运用酸碱盐的溶解性表来判断复分解反应能否发生并能正确书写离子方程式。
(三)通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存 【学习任务二】 【课堂探究二】酸碱盐的溶解性表的应用学以致用
三、酸碱盐的溶解性表的应用
(一)学会运用酸碱盐的溶解性表去判断物质的溶解性。【课堂导学案】 常见酸、碱、盐的溶解性规律
酸:酸中大多都可溶,只有硅酸是不溶;
碱:碱中钾、钠、铵、钡溶,钙微余不溶(除NaOH、KOH、Ba(OH)2、NH3 .H2O溶,Ca(OH)2微溶,其余均不溶)
盐:钾、钠、铵盐、硝酸盐,都能溶于水中间;
盐酸盐不溶氯化银,硫酸盐不溶硫酸钡;
碳酸、磷酸盐,溶者只有钾钠铵;
微溶 MgCO3 、CaSO4、Ag2SO4。 【当堂训练】
判断下列物质的溶解性
H2SiO3
Mg(OH)2
Agcl NH4cl
BaSO4 CuSO4
BaCO3 Na2CO3
NaNO3溶溶不溶不溶不溶不溶不溶溶溶酸中大多都可溶,只有硅酸是不溶碱中钾、钠、铵、钡溶,钙微余不溶盐酸盐不溶氯化银,硫酸盐不溶硫酸钡碳酸、磷酸盐,溶者只有钾钠铵钾、钠、铵盐、硝酸盐,都能溶于水中间(二)运用酸碱盐的溶解性表来判断复分解反应能否发生并能正确书写离子方程式。 【课堂导学案】1.复分解反应指的是两种化合物相互交换成分,生成另外两种化合物的反应。复分解反应发生的条件之一:有难溶物生成。
复分解反应常见的反应类型有:盐与盐;盐与碱;酸与盐;酸与碱
我们要特别注意以下两种反应:
盐与盐、盐与碱
首先要求反应物全溶,然后再考虑生成物中
是否有沉淀;当两种反应物都溶于水,且生成物中有沉淀时,复分解反应才能发生2.离子方程式的书写步骤一写:写出正确的化学方程式(基础)
CuSO4+ BaCl2= BaSO4 ↓+ CuCl2二拆:把易溶于水的物质拆写成离子形式,不溶于水的物质仍然用化学式表示(关键)
Cu2++SO42- + Ba2++2Cl-=BaSO4 ↓+ Cu2++2Cl-
三删:删去方程式两边不参加反应的离子(包括离
子的存在形式和化学计量数都必须相同),最后化学计量数比化为整数比。
Cu2++SO42- + Ba2++2Cl- =BaSO4 ↓+ Cu2++2Cl-四查:查原子个数和电荷是否守恒
Ba2++SO42-=BaSO4↓
【当堂训练】
判断以下反应能否发生,如果能发生,请写出反应的化学方程式及离子方程式。
1.HCl 与 AgNO3
HCl +AgNO3=AgCl↓ +HNO3
Ag++Cl-=AgCl↓
2.NaOH 与 CuSO4
CuSO4+2NaOH =Na2SO4+ Cu(OH)2 ↓
Cu2++2OH- = Cu(OH)2 ↓
两种反应物都溶于水,且生成物中
有沉淀,所以该复分解反应能发生(三)通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断 【课堂导学案】 【当堂训练】
判断下列离子方程式的对错
1.Ba(NO3)2 与H2SO4的反应:Ba2+ + SO42- = BaSO4↓
2.CaCl2与Na2SO4 的反应: Ca2+ + SO42- = CaSO4↓
3.HCl与Na2SiO3的反应:
2H++2Cl-+2Na++SiO32-=H2SiO3↓+2NaCl
4.CaCl2与Na2CO3反应:Ca2++CO32- =CaCO3↓
5.MgSO4与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ √√√2H++SiO32- =H2SiO3↓SO42-+Ba2++ Mg2++2OH- =BaSO4↓+ Mg(OH)2 ↓√√当生成物中有微溶物生成时,仍然用化学式表示。(四)通过酸碱盐溶解性表的应用,初步掌握离子共存。
离子能共存则说明离子之间不能发生化学反应,即能反应者不共存;不反应者能共存。离子不能共存的原因之一就是:在溶液中某此离子间能互相反应生成了不溶性的物质,从而发生了复分解反应。
如:SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+等【课堂导学案】 审题时应注意题中给出的附加条件
1、无色溶液中不存在有色离子:如Cu2+、Fe3+等
2、注意挖掘某些隐含离子:酸性溶液(或pH﹤7)中隐含有H+,碱性溶液(或pH﹥7)中隐含有OH-。【当堂训练】
下列各组离子能大量共存的是( )
A.Fe3+、K+、Cl-、NO3-
B.Ag+、Na+、NO3-、Cl-
C.Ba2+、Al3+、SO42-、Cl-
D.Mg2+、Na+、Cl-、OH-ABa2+ + SO42- = BaSO4↓Ag++Cl- =AgCl↓Mg2+ + 2OH- = Mg (OH)2 ↓【课堂检测】
1.书写下列反应的离子方程式
(1)NaCl溶液和AgNO3溶液
(2)Na2CO3溶液与Ca(OH)2溶液反应
2.写出下列离子方程式表示的化学方程式。
(1)Ag++Cl- =AgCl↓
NaCl+AgNO3 =AgCl↓ +NaNO3
(2)Cu2++2OH- = Cu(OH)2↓
CuCl2+2NaOH = Cu(OH)2↓ +NaCl
3.下列各组离子在给定条件下能大量共存的是( )
A.在强酸性溶液中:SiO32-、K+、Na+、Cl-
B.有SO42-存在的溶液中:Na+、Mg2+、Na+、Ba2+
C.使酚酞试液变红的溶液中:Na+、Cl-、SO42-、Fe3+
D.在强碱性溶液中:SiO32-、K+、Na+、NO 3-DAg++Cl- =AgCl↓Ca2+ +CO32- = CaCO3 ↓盐与盐、盐与碱的反应必须是可溶性的碱和可溶性的盐A、2H++SiO32- =H2SiO3↓Ba2+ + SO42- = BaSO4↓3O H-+ Fe3+ = Fe(OH)3 ↓
1、酸碱盐的溶解性表
2、酸碱盐的溶解性表的应用
(1)学会运用酸碱盐的溶解性表去判断物质的溶解性
(2)学会运用酸碱盐的溶解性表判断复分解反应能否发生及正确书写离子方程式
(3)通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存
1.掌握酸碱盐的溶解性表。
2.学会运用酸碱盐的溶解性表来正确书写离子方程式。(重点)
3.通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存。(重点)作业布置
《名师同步导学》随堂演练广场4、5、6谢谢!
部分酸、碱和盐的溶解性表(室温)情景引入 《三国演义》第八十九回,描述诸葛亮南征到了云南西洱河。并第四次放回孟获孟获逃到秃龙洞,秃龙大王夸口借助四个毒泉就可以消灭蜀汉军队。这四个毒泉是哑泉、灭泉、黑泉和柔泉。
其中哑泉“其水颇甜,人若饮之,则不能言,不过旬日必死”。蜀汉将军王平所率领的几百名先头部队,就因喝了哑泉水,个个成了哑巴,指着嘴巴说不出话来。后来多亏一位老叟的指点,喝了“安乐泉”泉水,吐出恶涎,才得以解救。
【小故事】 思考:喝了哑泉水的人为什么说不出话来?喝了安乐泉水为什么会解救呢? 故事中误喝了泉水的军士们个个说不出话来。原因是因为士兵喝的水中含有CuSO4,造成了重金属中毒。后经一老叟指点,喝了安乐泉水后转危为安。因该泉水中含有较多的碱,碱与CuSO4发生了离子反应Cu2++2OH-=Cu(OH)2↓使原来可溶性的铜盐变成了不溶性的Cu(OH)2沉淀,这样就不会被人体吸收。【故事解读】 Cu(OH)2为难溶性的碱, CuSO4为可溶性的铜盐,它们的溶解性可以根据课本后面的附录Ⅱ部分酸、碱和盐的溶解性表得知,这节课我们学习的主要内容就是酸碱盐的溶解性表及其应用。【新课引入】 必修1附录Ⅱ 部分酸、碱、盐的溶解性表(室温) 【学习目标】
一、掌握酸碱盐的溶解性表。 (重点)
二、学会运用酸碱盐的溶解性表去判断复分解反应能否发生。 (难点)
三、学会运用酸碱盐的溶解性表来正确书写离子方程式(难点)
四、通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存(难点)
1.掌握酸碱盐的溶解性表。
2.学会运用酸碱盐的溶解性表来正确书写离子方程式。(重点)
3.通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存。(重点) 【预习成果及导学案部分展示 】学习成果展示部分酸、碱、盐的溶解性表课前导学案展示 【学习任务一】 【课堂探究一】 酸碱盐溶解性表的识图和记忆技巧
【学与问】
1.酸碱盐的溶解性表如何解读?
2.酸碱盐的溶解性表如何记忆?有什么规律?【学生分组学习成果交流】【课堂导学案】学习成果交流学习成果交流你真棒!优异的成绩属于真正的有心人!
(一)学会运用酸碱盐的溶解性表去判断物质的溶解性
(二)学会运用酸碱盐的溶解性表来判断复分解反应能否发生并能正确书写离子方程式。
(三)通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存 【学习任务二】 【课堂探究二】酸碱盐的溶解性表的应用学以致用
三、酸碱盐的溶解性表的应用
(一)学会运用酸碱盐的溶解性表去判断物质的溶解性。【课堂导学案】 常见酸、碱、盐的溶解性规律
酸:酸中大多都可溶,只有硅酸是不溶;
碱:碱中钾、钠、铵、钡溶,钙微余不溶(除NaOH、KOH、Ba(OH)2、NH3 .H2O溶,Ca(OH)2微溶,其余均不溶)
盐:钾、钠、铵盐、硝酸盐,都能溶于水中间;
盐酸盐不溶氯化银,硫酸盐不溶硫酸钡;
碳酸、磷酸盐,溶者只有钾钠铵;
微溶 MgCO3 、CaSO4、Ag2SO4。 【当堂训练】
判断下列物质的溶解性
H2SiO3
Mg(OH)2
Agcl NH4cl
BaSO4 CuSO4
BaCO3 Na2CO3
NaNO3溶溶不溶不溶不溶不溶不溶溶溶酸中大多都可溶,只有硅酸是不溶碱中钾、钠、铵、钡溶,钙微余不溶盐酸盐不溶氯化银,硫酸盐不溶硫酸钡碳酸、磷酸盐,溶者只有钾钠铵钾、钠、铵盐、硝酸盐,都能溶于水中间(二)运用酸碱盐的溶解性表来判断复分解反应能否发生并能正确书写离子方程式。 【课堂导学案】1.复分解反应指的是两种化合物相互交换成分,生成另外两种化合物的反应。复分解反应发生的条件之一:有难溶物生成。
复分解反应常见的反应类型有:盐与盐;盐与碱;酸与盐;酸与碱
我们要特别注意以下两种反应:
盐与盐、盐与碱
首先要求反应物全溶,然后再考虑生成物中
是否有沉淀;当两种反应物都溶于水,且生成物中有沉淀时,复分解反应才能发生2.离子方程式的书写步骤一写:写出正确的化学方程式(基础)
CuSO4+ BaCl2= BaSO4 ↓+ CuCl2二拆:把易溶于水的物质拆写成离子形式,不溶于水的物质仍然用化学式表示(关键)
Cu2++SO42- + Ba2++2Cl-=BaSO4 ↓+ Cu2++2Cl-
三删:删去方程式两边不参加反应的离子(包括离
子的存在形式和化学计量数都必须相同),最后化学计量数比化为整数比。
Cu2++SO42- + Ba2++2Cl- =BaSO4 ↓+ Cu2++2Cl-四查:查原子个数和电荷是否守恒
Ba2++SO42-=BaSO4↓
【当堂训练】
判断以下反应能否发生,如果能发生,请写出反应的化学方程式及离子方程式。
1.HCl 与 AgNO3
HCl +AgNO3=AgCl↓ +HNO3
Ag++Cl-=AgCl↓
2.NaOH 与 CuSO4
CuSO4+2NaOH =Na2SO4+ Cu(OH)2 ↓
Cu2++2OH- = Cu(OH)2 ↓
两种反应物都溶于水,且生成物中
有沉淀,所以该复分解反应能发生(三)通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断 【课堂导学案】 【当堂训练】
判断下列离子方程式的对错
1.Ba(NO3)2 与H2SO4的反应:Ba2+ + SO42- = BaSO4↓
2.CaCl2与Na2SO4 的反应: Ca2+ + SO42- = CaSO4↓
3.HCl与Na2SiO3的反应:
2H++2Cl-+2Na++SiO32-=H2SiO3↓+2NaCl
4.CaCl2与Na2CO3反应:Ca2++CO32- =CaCO3↓
5.MgSO4与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ √√√2H++SiO32- =H2SiO3↓SO42-+Ba2++ Mg2++2OH- =BaSO4↓+ Mg(OH)2 ↓√√当生成物中有微溶物生成时,仍然用化学式表示。(四)通过酸碱盐溶解性表的应用,初步掌握离子共存。
离子能共存则说明离子之间不能发生化学反应,即能反应者不共存;不反应者能共存。离子不能共存的原因之一就是:在溶液中某此离子间能互相反应生成了不溶性的物质,从而发生了复分解反应。
如:SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+等【课堂导学案】 审题时应注意题中给出的附加条件
1、无色溶液中不存在有色离子:如Cu2+、Fe3+等
2、注意挖掘某些隐含离子:酸性溶液(或pH﹤7)中隐含有H+,碱性溶液(或pH﹥7)中隐含有OH-。【当堂训练】
下列各组离子能大量共存的是( )
A.Fe3+、K+、Cl-、NO3-
B.Ag+、Na+、NO3-、Cl-
C.Ba2+、Al3+、SO42-、Cl-
D.Mg2+、Na+、Cl-、OH-ABa2+ + SO42- = BaSO4↓Ag++Cl- =AgCl↓Mg2+ + 2OH- = Mg (OH)2 ↓【课堂检测】
1.书写下列反应的离子方程式
(1)NaCl溶液和AgNO3溶液
(2)Na2CO3溶液与Ca(OH)2溶液反应
2.写出下列离子方程式表示的化学方程式。
(1)Ag++Cl- =AgCl↓
NaCl+AgNO3 =AgCl↓ +NaNO3
(2)Cu2++2OH- = Cu(OH)2↓
CuCl2+2NaOH = Cu(OH)2↓ +NaCl
3.下列各组离子在给定条件下能大量共存的是( )
A.在强酸性溶液中:SiO32-、K+、Na+、Cl-
B.有SO42-存在的溶液中:Na+、Mg2+、Na+、Ba2+
C.使酚酞试液变红的溶液中:Na+、Cl-、SO42-、Fe3+
D.在强碱性溶液中:SiO32-、K+、Na+、NO 3-DAg++Cl- =AgCl↓Ca2+ +CO32- = CaCO3 ↓盐与盐、盐与碱的反应必须是可溶性的碱和可溶性的盐A、2H++SiO32- =H2SiO3↓Ba2+ + SO42- = BaSO4↓3O H-+ Fe3+ = Fe(OH)3 ↓
1、酸碱盐的溶解性表
2、酸碱盐的溶解性表的应用
(1)学会运用酸碱盐的溶解性表去判断物质的溶解性
(2)学会运用酸碱盐的溶解性表判断复分解反应能否发生及正确书写离子方程式
(3)通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存
1.掌握酸碱盐的溶解性表。
2.学会运用酸碱盐的溶解性表来正确书写离子方程式。(重点)
3.通过酸碱盐溶解性表的应用,初步掌握离子方程式的正误判断及离子共存。(重点)作业布置
《名师同步导学》随堂演练广场4、5、6谢谢!
