高中化学人教版(新课程标准)必修1元素周期表(38张)
文档属性
| 名称 | 高中化学人教版(新课程标准)必修1元素周期表(38张) |  | |
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-19 22:44:59 | ||
图片预览




文档简介
课件38张PPT。
第一章 物质结构 元素周期律第一节 元素周期表 元素周期表的由来:
①1864 年,德国化学家迈尔发表了《六元素表》,他把28 种元素列在一张表上,表中各元素按原子量排列成序,并对元素进行了分族,且给尚未发现的元素留出了空位,比“三元素组”有了很大进步。
②1865 年,英国人纽兰兹又提出一个叫做“八音律”的理论。他把元素按原子量递增的顺序排列,第八种元素的性质几乎和第一种元素的性质相同。这种像音乐中八度音似的“八音律”,进一步揭示了元素的性质和元素原子量之间的密切联系。(一)元素周期表的历史1.第一张元素周期表(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
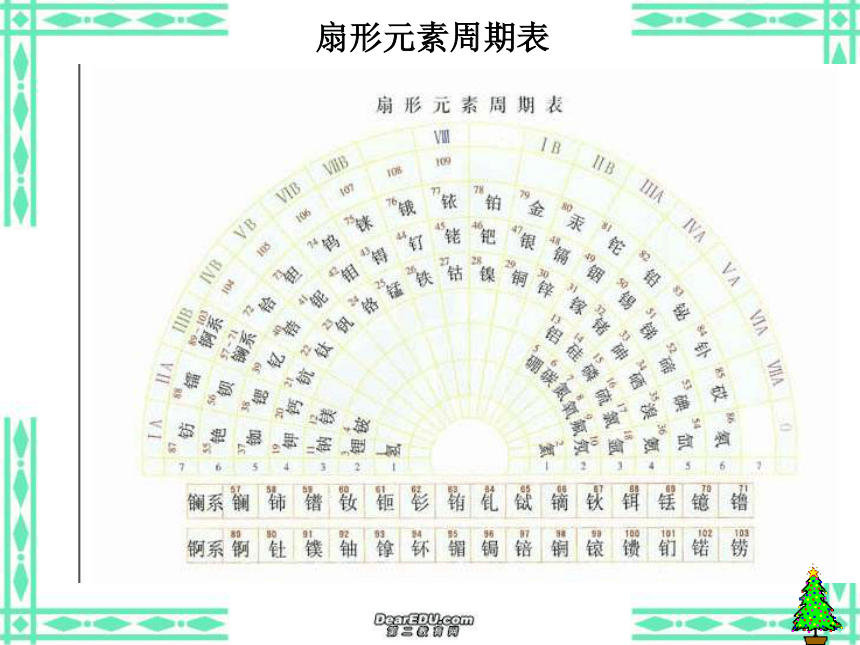
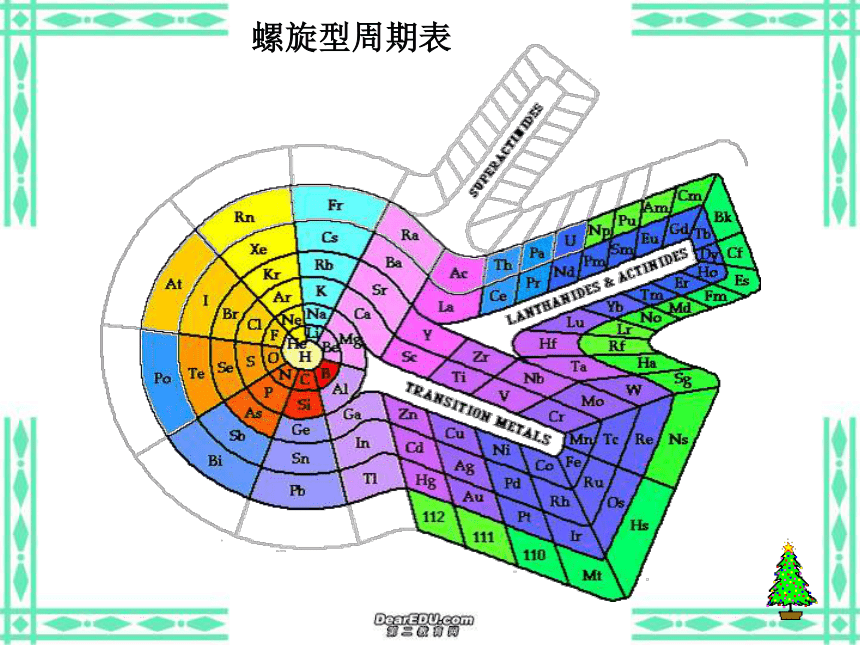
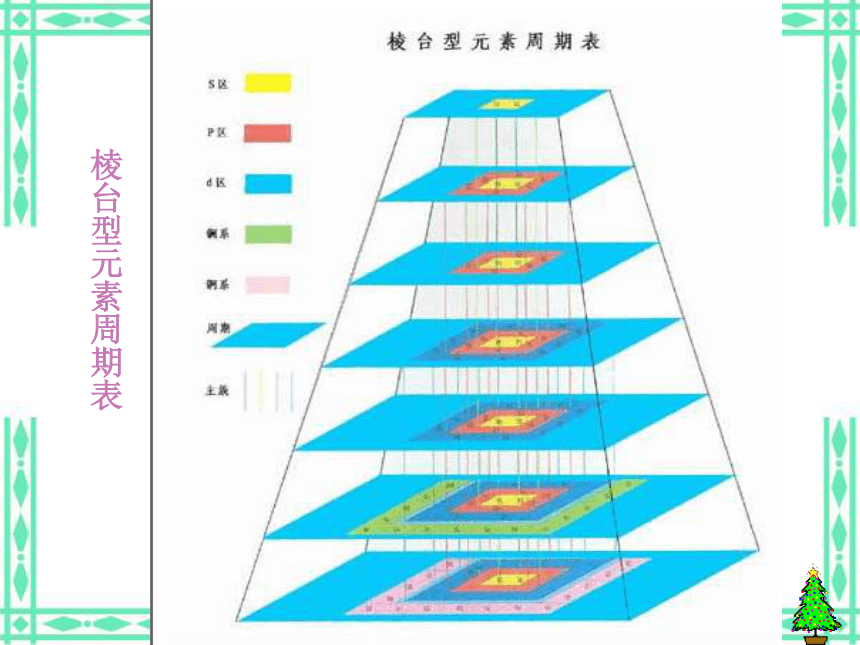
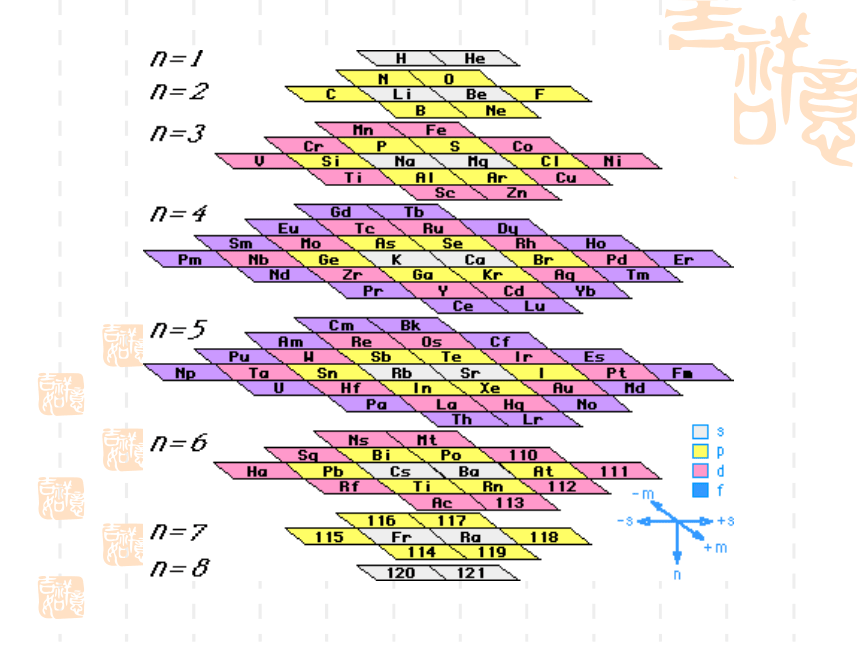
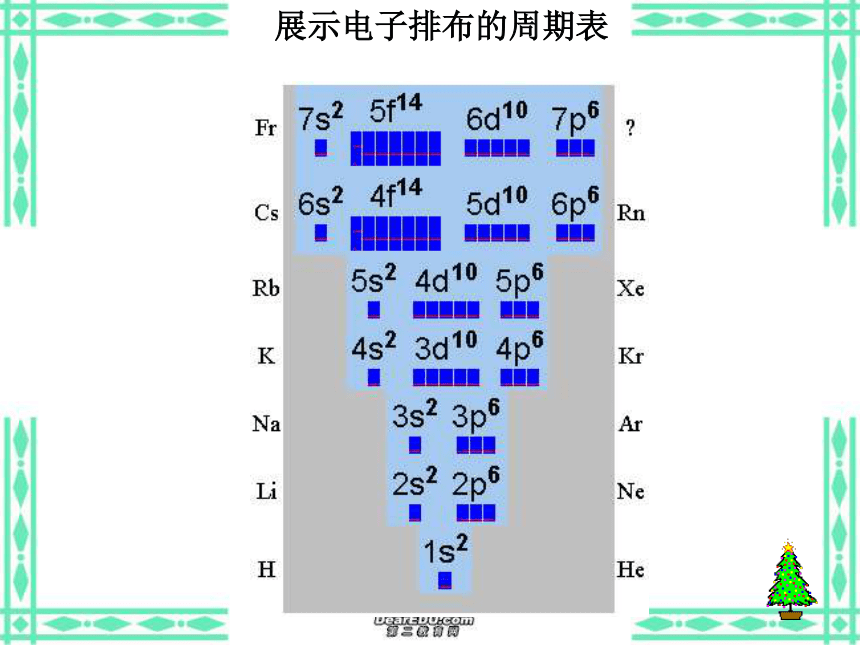
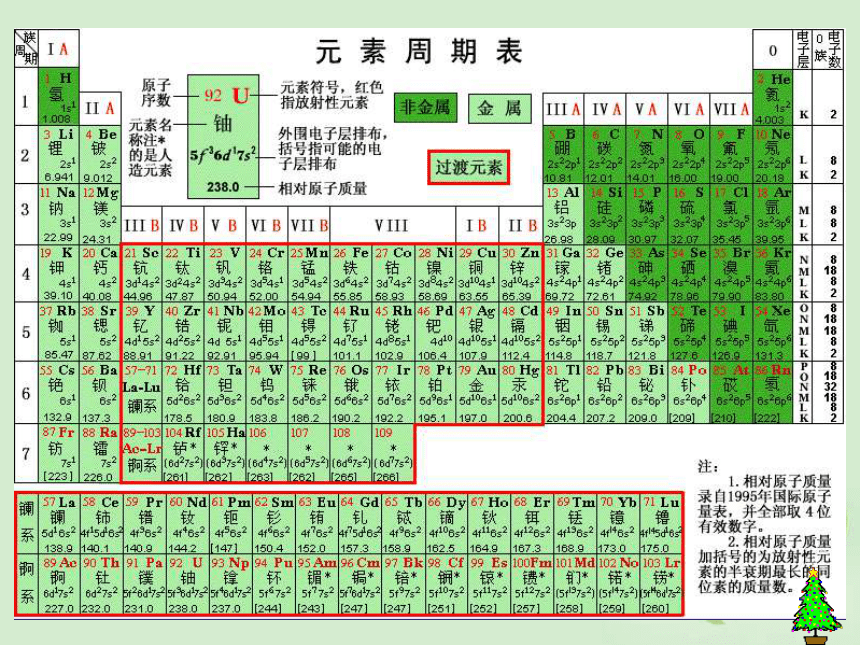
(5)意义:俄国化学家——门捷列夫1869年将元素按照相对原子质量由小到大依次排列揭示了化学元素的内在联系——里程碑将化学性质相似的元素放在一个纵行扇形元素周期表立式周期表螺旋型周期表棱台型元素周期表展示电子排布的周期表一、元素: 二、原子的构成: 具有相同核电荷数(即核内质子数)的一类原子的总称。原子核核外电子{质子中子原子序数=核电荷数=质子数=核外电子数 元素种类原子(核素)种类元素的化学性质质量数(A)=质子数(Z)+中子数(N)a——代表质量数;
b——代表核电荷数(质子数) ;
c——代表离子的电荷数;
d——代表化合价;
e ——代表原子个数a、b、c、d、e各代表什么? _ 元素的性质取决于原子核外电子的排布——用原子结构示意图表示同电子层——同横行同最外层电子——同纵行一、元素周期表的编排原则 根据元素周期律,把已知的一百多种元素中 的各种元素,按原子序数递增的顺序从左到右排成 ,再把不同横行中 的元素按电子层数递增的顺序由上而下排成 ,这样得到的一个表,叫做元素周期表。电子层数目相同横行最外电子层的电子数相同纵行 (1)周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期序数 = 电子层数 周期短周期:第1~3周期长周期:第4~6周期周期表里数周期,1234567.不完全周期:第7周期
二、 元素周期表的结构
(2)族(纵行)
主族:
由短周期元素和长周期元素共同构成的族。
副族:
完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB位于第11、12、3、4、5、6、7纵行
第VⅢ族:
0族:
(“8.9.10” 三个纵行)
稀有气体元素位于第18纵行七主七副八和0表示方法:在罗马数字表示的族序数后面标“A”字。
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA位于第1、2、13、14、15、16、17纵行
主族序数=最外层电子数=主族元素的最高正价
课堂练习1.已知某主族元素的原子结构示意图如 下,判断其位于第几周期?第几族?Y+532818187第三周期第IA族第五周期第VIIA族2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数BX元素周期表IAIIAIIIAIVAV
AVIAVIIA0主族周期副族
过渡元素周
期
表7个周期7个主族:由短周期和长周期
元素共同构成的族(IA~VIIA)7个副族:仅由长周期构成的族
(ⅠB~ⅦB)VIII族(3个纵行):Fe、Co、Ni等9种元素横的方面
(7个横行)纵的方面(18个纵行)零族:稀有气体元素12345672种元素8种元素8种元素18种元素18种元素32种元素26种元素短周期长周期不完全周期元素周期表结构镧系元素共15 种元素
锕系元素共15 种元素
(16个族)练习:1.元素周期表中某ⅠA族元素原子序数为x,那么同一周期的ⅢA族元素原子序数不可能为…………( )
A. x+25 B. x+2 C. x+12 D. x+26
2.现行元素周期表中已经列出了112种元素,其中元素种类最多的周期是?
A.第4周期 B.第5周期
C.第6周期 D.第7周期CA
例:1.写出下列元素在周期表中的位置
Na Cl Fe2.写出原子序数为16、55、88三种 元素在周期表中的位置 Na 第三周期第ⅠA族 Cl 第三周期第ⅦA族
Fe 第四周期第Ⅷ族
16 第三周期第ⅥA族 55 第六周期第ⅠA族
88 第七周期第ⅡA族碱金属元素单质思考:如何通过实验验证碱金属化学性质的相似性和不同点? (1)与H2O 的反应;
(2)与O2的反应2、【科学探究】碱金属元素在化学性质上的异同(1)相似性:均能与氧气、与水反应,表现出金属性; 4Li + O2 ==== 2Li2O
2Na + O2 ==== Na2O2
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑△△(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大.3、思考与交流碱金属元素的化学性质 递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大 相同点:
最外层都有1个电子 相似性:
容易失去1个电子,单质
表现出很强的还原性 递变性:
失电子能力增强
金属性逐渐增强
单质的还原性增强易于得到一个电子(具氧化性),化学性质活泼,体现强非金属性得电子能力递减,
非金属性递减,
氧化性递减。原子的最外层均
为7个电子核电荷数增多;电子层数递增;原子半径递增学与问卤族元素的原子结构,思考:
卤素(ⅦA族)的原子结构有什么相同和不同之处? 卤族元素在化学性质上的规律①相似性:
均能与氢气反应,表现出非金属性(氧化性); ②递变性:反应通式:X2 + H2 === 2HX剧烈程度:
氢化物的稳定性:逐渐减弱逐渐减弱思考:如何通过实验验证卤素化学性质的相似性和不同点? (1)与氢气的反应;现象:溶液由无色变为橙黄色水层:颜色变浅CCl4层:无色变为橙红色现象:溶液由无色变为棕黄色水层:颜色变浅CCl4层:无色变为紫红色(2)卤素单质间的置换反应 溶液由无色变为棕黄色现象:水层:颜色变浅CCl4层:无色变为紫红色Cl2 + 2NaBr = 2NaCl +Br2Cl2 + 2 KI = 2KCl + I2Br2 + 2KI = 2KBr +I2思考:根据上述反应,比较Cl2、Br2、I2的氧化性强弱结论: 氧化性:F2 > Cl2>Br2>I2
总结:
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
得电子的能力逐渐减弱
非金属性逐渐减弱
氧化性逐渐减弱
还原性逐渐增强
金属性逐渐增强
失电子的能力逐渐增强课堂练习
1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA2、下列各组中的元素用原子序数表示,其中都属于同一主族的一组元素是( )
(A)14、24、34 (B)26、31、35
(C)7、15、33 (D)11、17、18C3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D4. A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素? A是氮元素
B是氧元素
C是硫元素
第一章 物质结构 元素周期律第一节 元素周期表 元素周期表的由来:
①1864 年,德国化学家迈尔发表了《六元素表》,他把28 种元素列在一张表上,表中各元素按原子量排列成序,并对元素进行了分族,且给尚未发现的元素留出了空位,比“三元素组”有了很大进步。
②1865 年,英国人纽兰兹又提出一个叫做“八音律”的理论。他把元素按原子量递增的顺序排列,第八种元素的性质几乎和第一种元素的性质相同。这种像音乐中八度音似的“八音律”,进一步揭示了元素的性质和元素原子量之间的密切联系。(一)元素周期表的历史1.第一张元素周期表(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:俄国化学家——门捷列夫1869年将元素按照相对原子质量由小到大依次排列揭示了化学元素的内在联系——里程碑将化学性质相似的元素放在一个纵行扇形元素周期表立式周期表螺旋型周期表棱台型元素周期表展示电子排布的周期表一、元素: 二、原子的构成: 具有相同核电荷数(即核内质子数)的一类原子的总称。原子核核外电子{质子中子原子序数=核电荷数=质子数=核外电子数 元素种类原子(核素)种类元素的化学性质质量数(A)=质子数(Z)+中子数(N)a——代表质量数;
b——代表核电荷数(质子数) ;
c——代表离子的电荷数;
d——代表化合价;
e ——代表原子个数a、b、c、d、e各代表什么? _ 元素的性质取决于原子核外电子的排布——用原子结构示意图表示同电子层——同横行同最外层电子——同纵行一、元素周期表的编排原则 根据元素周期律,把已知的一百多种元素中 的各种元素,按原子序数递增的顺序从左到右排成 ,再把不同横行中 的元素按电子层数递增的顺序由上而下排成 ,这样得到的一个表,叫做元素周期表。电子层数目相同横行最外电子层的电子数相同纵行 (1)周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期序数 = 电子层数 周期短周期:第1~3周期长周期:第4~6周期周期表里数周期,1234567.不完全周期:第7周期
二、 元素周期表的结构
(2)族(纵行)
主族:
由短周期元素和长周期元素共同构成的族。
副族:
完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB位于第11、12、3、4、5、6、7纵行
第VⅢ族:
0族:
(“8.9.10” 三个纵行)
稀有气体元素位于第18纵行七主七副八和0表示方法:在罗马数字表示的族序数后面标“A”字。
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA位于第1、2、13、14、15、16、17纵行
主族序数=最外层电子数=主族元素的最高正价
课堂练习1.已知某主族元素的原子结构示意图如 下,判断其位于第几周期?第几族?Y+532818187第三周期第IA族第五周期第VIIA族2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数BX元素周期表IAIIAIIIAIVAV
AVIAVIIA0主族周期副族
过渡元素周
期
表7个周期7个主族:由短周期和长周期
元素共同构成的族(IA~VIIA)7个副族:仅由长周期构成的族
(ⅠB~ⅦB)VIII族(3个纵行):Fe、Co、Ni等9种元素横的方面
(7个横行)纵的方面(18个纵行)零族:稀有气体元素12345672种元素8种元素8种元素18种元素18种元素32种元素26种元素短周期长周期不完全周期元素周期表结构镧系元素共15 种元素
锕系元素共15 种元素
(16个族)练习:1.元素周期表中某ⅠA族元素原子序数为x,那么同一周期的ⅢA族元素原子序数不可能为…………( )
A. x+25 B. x+2 C. x+12 D. x+26
2.现行元素周期表中已经列出了112种元素,其中元素种类最多的周期是?
A.第4周期 B.第5周期
C.第6周期 D.第7周期CA
例:1.写出下列元素在周期表中的位置
Na Cl Fe2.写出原子序数为16、55、88三种 元素在周期表中的位置 Na 第三周期第ⅠA族 Cl 第三周期第ⅦA族
Fe 第四周期第Ⅷ族
16 第三周期第ⅥA族 55 第六周期第ⅠA族
88 第七周期第ⅡA族碱金属元素单质思考:如何通过实验验证碱金属化学性质的相似性和不同点? (1)与H2O 的反应;
(2)与O2的反应2、【科学探究】碱金属元素在化学性质上的异同(1)相似性:均能与氧气、与水反应,表现出金属性; 4Li + O2 ==== 2Li2O
2Na + O2 ==== Na2O2
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑△△(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大.3、思考与交流碱金属元素的化学性质 递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大 相同点:
最外层都有1个电子 相似性:
容易失去1个电子,单质
表现出很强的还原性 递变性:
失电子能力增强
金属性逐渐增强
单质的还原性增强易于得到一个电子(具氧化性),化学性质活泼,体现强非金属性得电子能力递减,
非金属性递减,
氧化性递减。原子的最外层均
为7个电子核电荷数增多;电子层数递增;原子半径递增学与问卤族元素的原子结构,思考:
卤素(ⅦA族)的原子结构有什么相同和不同之处? 卤族元素在化学性质上的规律①相似性:
均能与氢气反应,表现出非金属性(氧化性); ②递变性:反应通式:X2 + H2 === 2HX剧烈程度:
氢化物的稳定性:逐渐减弱逐渐减弱思考:如何通过实验验证卤素化学性质的相似性和不同点? (1)与氢气的反应;现象:溶液由无色变为橙黄色水层:颜色变浅CCl4层:无色变为橙红色现象:溶液由无色变为棕黄色水层:颜色变浅CCl4层:无色变为紫红色(2)卤素单质间的置换反应 溶液由无色变为棕黄色现象:水层:颜色变浅CCl4层:无色变为紫红色Cl2 + 2NaBr = 2NaCl +Br2Cl2 + 2 KI = 2KCl + I2Br2 + 2KI = 2KBr +I2思考:根据上述反应,比较Cl2、Br2、I2的氧化性强弱结论: 氧化性:F2 > Cl2>Br2>I2
总结:
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
得电子的能力逐渐减弱
非金属性逐渐减弱
氧化性逐渐减弱
还原性逐渐增强
金属性逐渐增强
失电子的能力逐渐增强课堂练习
1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA2、下列各组中的元素用原子序数表示,其中都属于同一主族的一组元素是( )
(A)14、24、34 (B)26、31、35
(C)7、15、33 (D)11、17、18C3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D4. A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素? A是氮元素
B是氧元素
C是硫元素
