高中化学人教版必修一 第一章第一节 化学实验基本方法(23张)
文档属性
| 名称 | 高中化学人教版必修一 第一章第一节 化学实验基本方法(23张) | 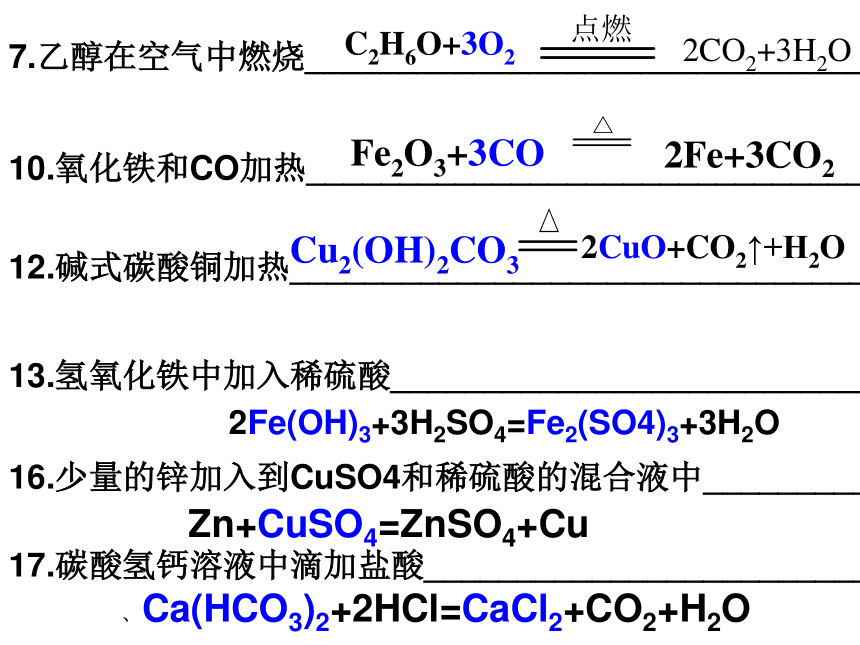 | |
| 格式 | zip | ||
| 文件大小 | 119.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-19 22:49:19 | ||
图片预览







文档简介
课件23张PPT。7.乙醇在空气中燃烧_______________________________10.氧化铁和CO加热_______________________________12.碱式碳酸铜加热_______________________________13.氢氧化铁中加入稀硫酸__________________________16.少量的锌加入到CuSO4和稀硫酸的混合液中____________________________17.碳酸氢钙溶液中滴加盐酸________________________C2H6O+3O22CO2+3H2OFe2O3+3CO2Fe+3CO2 Cu2(OH)2CO32CuO+CO2↑+H2O2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O Zn+CuSO4=ZnSO4+Cu 、Ca(HCO3)2+2HCl=CaCl2+CO2+H2O 过滤和蒸发物质的分离和提纯 1、物质的分离是把混合物的各种成分分开,分别得到纯净的物质;
物质的提纯是把物质中所含的杂质除去,以得到纯净的物质。一、基本原理 2、物质提纯时原则不能引入新杂质,若引入,必须进一步除去
提纯后物质成分不变(该成分的量若能增多则更好)
实验过程和操作方法简单易行 归纳为“不增、不减、易分离、易复原” [除杂原则]不增:不减:易分离:不增加新的物质不减少被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
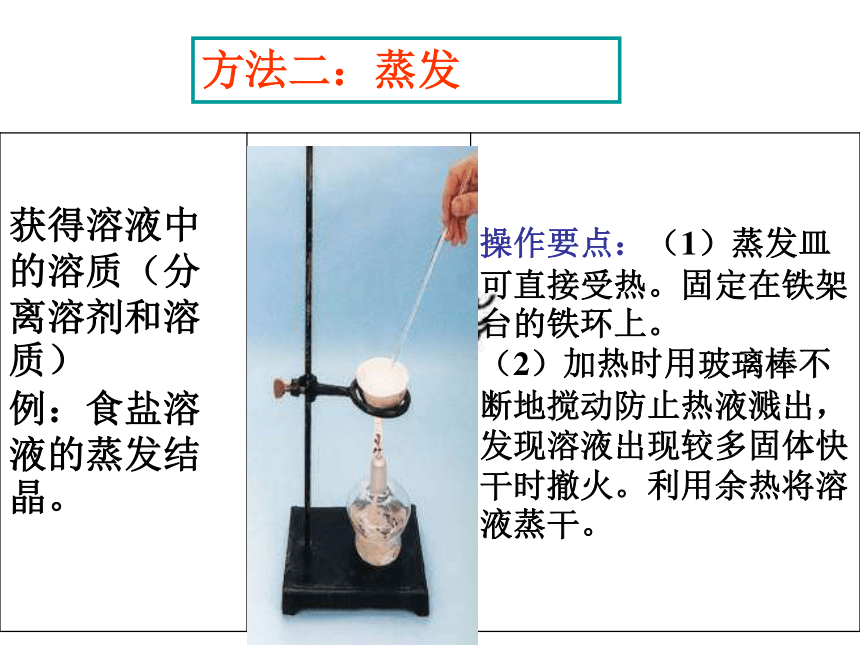
Na2SO4转换为沉淀BaSO4易复原不增、不减、易分离、易复原方法一、过滤(沉淀洗涤)3、混合物的分离和提纯方法方法二:蒸发实验 粗盐的提纯
仪器 : 天平,烧杯,玻璃棒,漏斗,铁架台,铁圈等实例
1、不溶性的泥沙与盐分离是哪一步骤?
2、蒸发过程利用的是物质的什么性质?
3、蒸发后得到的盐的成分可能是什么?过滤沸点不同NaCl、CaCl2、MgCl2、硫酸盐 问题▲Cl-的检验方法 先加入稀硝酸,再加入AgNO3溶液,如果出现白色沉淀,则存在氯离子。表述时应说明:
选用什么试剂+出现什么现象+得出什么结论二、物质的检验▲SO42-的检验方法 先加入稀盐酸,再加入BaCl2溶液,如果出现白色沉淀,则存在硫酸根离子。BaCl2NaOHNa2CO3???不能引入新的杂质!要除去可溶杂质离子是:选择要加入的除杂试剂:引入了新的杂质离子:CO3 2-OH -Ba 2+注意:1.引入试剂只跟杂质反应,且要适量或稍过量;
2.不引入新杂质;
3.后续试剂应除去过量的前一试剂;
4.过程简单、现象明显;
5.尽可能将杂质转化为所需物质除去;
6.多种试剂时应考虑加入试剂顺序。BaCl2过量的处理: 加入Na2CO3
BaCl2+Na2CO3=BaCO3↓+2NaCl
Na2CO3、 NaOH过量的处理: 加入盐酸
NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑加入试剂顺序1.BaCl2→NaOH →Na2CO3 →HCl
2. BaCl2→ Na2CO3 → NaOH →HCl
3. NaOH →BaCl2→ Na2CO3 →HCl
加入除杂试剂的顺序可以是:思考与交流 请大家归纳一下,除去粗盐中可溶性杂质,试剂的加入顺序有哪几种?3、食盐精制的方案:①溶解②过量NaOH 溶液③过量BaCl2溶液
④过量Na2CO3⑤过滤⑥适量稀盐酸⑦蒸发依据:顺序可调换,但Na2CO3必须在BaCl2之后加入, Na2CO3除CaCl2和BaCl2。
稀盐酸最后加入。且须将沉淀过滤后再加稀盐酸,最后要蒸发。小结过滤用于固体不溶于液体的分离。
蒸发可以用于固体溶于液体的分离。
检验SO42-一般用BaCl2和稀盐酸。
实际的除杂中要注意加入试剂的先后顺序和试剂过量的处理方法。练习1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问
如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发练习:
6、为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后先后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
A、K2CO3——Ba(NO3)2——KOH——HNO3
B、Ba(NO3)2——KOH——HNO3——K2CO3
C、KOH——K2CO3——Ba(NO3)2——HNO3
D、Ba(NO3)2——KOH——K2CO3——HNO3D练习:7、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法( )
A、加入过量碳酸钠溶液,过滤,再加适量硝酸
B、加入过量硫酸钾溶液,过滤,再加适量硝酸
C、加入过量硫酸钠溶液,过滤,再加适量硝酸
D、加入过量碳酸钾溶液,过滤,再加适量硝酸
D例:实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①可选择_____或_____仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)进行操作②后,如何判断SO42-已除尽,方法是__________。
(4)操作③的目的是_________,为什么不先过滤后加碳酸钠溶液?理由是________。
(5)操作④的目的是 。____________________________________。
物质的提纯是把物质中所含的杂质除去,以得到纯净的物质。一、基本原理 2、物质提纯时原则不能引入新杂质,若引入,必须进一步除去
提纯后物质成分不变(该成分的量若能增多则更好)
实验过程和操作方法简单易行 归纳为“不增、不减、易分离、易复原” [除杂原则]不增:不减:易分离:不增加新的物质不减少被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO4易复原不增、不减、易分离、易复原方法一、过滤(沉淀洗涤)3、混合物的分离和提纯方法方法二:蒸发实验 粗盐的提纯
仪器 : 天平,烧杯,玻璃棒,漏斗,铁架台,铁圈等实例
1、不溶性的泥沙与盐分离是哪一步骤?
2、蒸发过程利用的是物质的什么性质?
3、蒸发后得到的盐的成分可能是什么?过滤沸点不同NaCl、CaCl2、MgCl2、硫酸盐 问题▲Cl-的检验方法 先加入稀硝酸,再加入AgNO3溶液,如果出现白色沉淀,则存在氯离子。表述时应说明:
选用什么试剂+出现什么现象+得出什么结论二、物质的检验▲SO42-的检验方法 先加入稀盐酸,再加入BaCl2溶液,如果出现白色沉淀,则存在硫酸根离子。BaCl2NaOHNa2CO3???不能引入新的杂质!要除去可溶杂质离子是:选择要加入的除杂试剂:引入了新的杂质离子:CO3 2-OH -Ba 2+注意:1.引入试剂只跟杂质反应,且要适量或稍过量;
2.不引入新杂质;
3.后续试剂应除去过量的前一试剂;
4.过程简单、现象明显;
5.尽可能将杂质转化为所需物质除去;
6.多种试剂时应考虑加入试剂顺序。BaCl2过量的处理: 加入Na2CO3
BaCl2+Na2CO3=BaCO3↓+2NaCl
Na2CO3、 NaOH过量的处理: 加入盐酸
NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑加入试剂顺序1.BaCl2→NaOH →Na2CO3 →HCl
2. BaCl2→ Na2CO3 → NaOH →HCl
3. NaOH →BaCl2→ Na2CO3 →HCl
加入除杂试剂的顺序可以是:思考与交流 请大家归纳一下,除去粗盐中可溶性杂质,试剂的加入顺序有哪几种?3、食盐精制的方案:①溶解②过量NaOH 溶液③过量BaCl2溶液
④过量Na2CO3⑤过滤⑥适量稀盐酸⑦蒸发依据:顺序可调换,但Na2CO3必须在BaCl2之后加入, Na2CO3除CaCl2和BaCl2。
稀盐酸最后加入。且须将沉淀过滤后再加稀盐酸,最后要蒸发。小结过滤用于固体不溶于液体的分离。
蒸发可以用于固体溶于液体的分离。
检验SO42-一般用BaCl2和稀盐酸。
实际的除杂中要注意加入试剂的先后顺序和试剂过量的处理方法。练习1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问
如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发练习:
6、为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后先后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
A、K2CO3——Ba(NO3)2——KOH——HNO3
B、Ba(NO3)2——KOH——HNO3——K2CO3
C、KOH——K2CO3——Ba(NO3)2——HNO3
D、Ba(NO3)2——KOH——K2CO3——HNO3D练习:7、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法( )
A、加入过量碳酸钠溶液,过滤,再加适量硝酸
B、加入过量硫酸钾溶液,过滤,再加适量硝酸
C、加入过量硫酸钠溶液,过滤,再加适量硝酸
D、加入过量碳酸钾溶液,过滤,再加适量硝酸
D例:实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①可选择_____或_____仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)进行操作②后,如何判断SO42-已除尽,方法是__________。
(4)操作③的目的是_________,为什么不先过滤后加碳酸钠溶液?理由是________。
(5)操作④的目的是 。____________________________________。
