高中化学人教版必修一 第一章第二节 化学计量在实验中的应用(20张)
文档属性
| 名称 | 高中化学人教版必修一 第一章第二节 化学计量在实验中的应用(20张) |  | |
| 格式 | zip | ||
| 文件大小 | 465.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-19 22:51:25 | ||
图片预览








文档简介
课件20张PPT。知识回顾÷M×M×NA÷NAV化学计量在实验中的应用第2课时 气体摩尔体积一、教学目标
1、了解影响物质体积的因素
2、理解气体摩尔体积的概念
3、掌握有关气体体积的计算二、教学重、难点
1、教学重点:理解气体摩尔体积的概念
2、教学难点:有关气体体积的计算一、气体摩尔体积定义:单位物质的量的物质所具有的质量摩尔质量单位物质的量的气体所占的体积为什么只研究气体摩尔体积,而不研究固体和液体的摩尔体积呢?(温度0℃,压强101Kpa)计算:1mol气体的体积22.4222.397.18101853.55计算:1mol固体、液体的体积(20℃)规律?计算总结规律结论1mol 不同固体和液体体积不同,
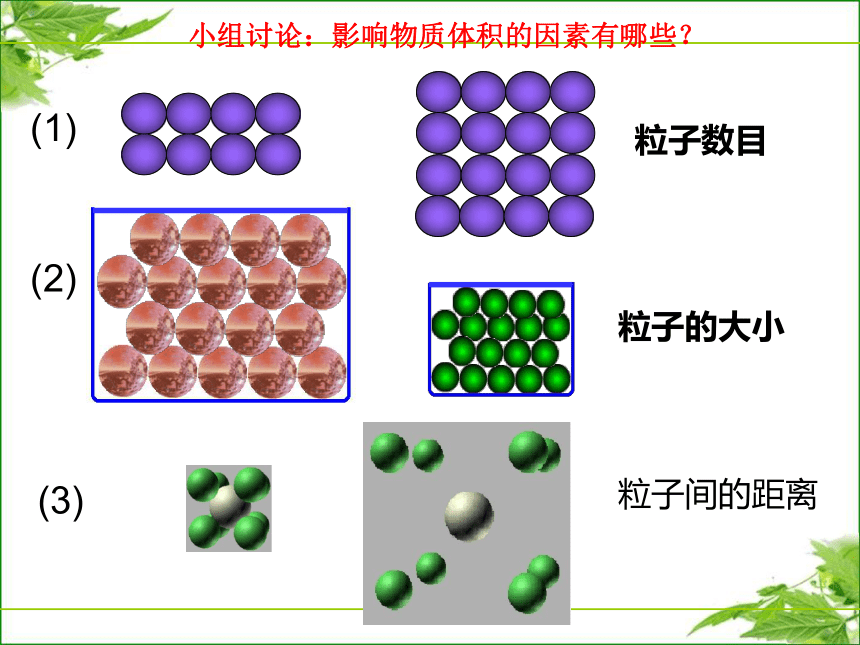
1mol 不同气体体积大致相同影响物质体积的因素有哪些?粒子数目粒子的大小粒子间的距离小组讨论:影响物质体积的因素有哪些?(1)(2)(3)一、影响物质体积的因素1mol不同物质体积的决定因素是什么?NANA物质的微观结构模型一、影响物质体积的因素NANA主要因素为什么不研究固体和液体的摩尔体积? [ 实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。1 mol H2O( 18 mL)资料:气体分子间平均距离约为10-9m,气体分子的直径约为10-10m一、影响物质体积的因素NANA主要因素主要因素影响气体粒子之间距离的因素又是什么呢?影响气体粒子之间距离的因素
影响气体体积大小的因素有:
①物质的粒子数,②____,③____。 温度压强温度升高,气体粒子之间距离_______,压强增大,气体粒子之间的距离______增大减小在一定的温度和一定压强下,任何气体粒子之间的距离都是_________一定的同温同压下,如果 两种气体粒子数相同,那么它们的体积有什么关系呢?相同同温同压下,相同体积的任何气体含有_____
数目的粒子相同在一定的温度和一定压强下,
1 mol气体的体积是多少呢?在0℃和101kPa条件下, 1mol气体的体积
在0℃和101kPa条件下, 1mol任何气体的体积大约都是22.4L
一、气体摩尔体积1、定义:单位物质的量的气体所占的体积2、符号:Vm3、公式:Vm=V/n4、单位:L/mol和m3/mol数值?气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强5、数值:在标准状况下,气体摩尔体积
约为22.4L/mol要点:1、条件:标准状况(0℃和101kPa)
2、对象:任何气体(包括不反应的混合气体)
[当堂检测1]1. 标准状况下,1mol任何物质的体积都约是22.4L。(错,物质应是气体)2. 1mol气体的体积约为22.4L。(错,应标明条件-标准状况)3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。(错,未指明气体体积是否在相同条件下测定)5 .只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。7 .1 摩尔二氧化硫在20 ℃时的体积比 22.4 L 大
8 .1 摩尔氯化氢在303KPa 时的体积比 22.4 L 小
说法错误。 因忽略了压强的影响。 6 .1 摩尔水在标准状况下的体积约为 22.4 L说法错误。 因水在标准状况下不是气体。 说法错误。 因忽略了温度的影响。 (错)Vm=V/n变式?[当堂检测2] 标准状况下:(1)44.8升氢气的物质的量是多少?
(2)0.5摩尔氧气的体积是多少?
(3)14克CO的体积是多少?
(4)3.01×1023个O2所占体积约为 L。 n(H2)=V(H2)/Vm =44.8L÷22.4L/mol
=2molV(O2)=n(O2)×Vm =0.5mol×22.4L/mol =11.2L V(CO)=n(CO)×Vm =m(CO)/M(CO)×Vm =(14g÷28g/mol)×22.4L/mol =11.2L 11.2V
(气体)÷M×M×NA÷NAmnN小 结[作业:] 在标准状况下
(1)16gO2的体积是多少?
(2)44.8LN2中含有的N2分子数是多少?
1、了解影响物质体积的因素
2、理解气体摩尔体积的概念
3、掌握有关气体体积的计算二、教学重、难点
1、教学重点:理解气体摩尔体积的概念
2、教学难点:有关气体体积的计算一、气体摩尔体积定义:单位物质的量的物质所具有的质量摩尔质量单位物质的量的气体所占的体积为什么只研究气体摩尔体积,而不研究固体和液体的摩尔体积呢?(温度0℃,压强101Kpa)计算:1mol气体的体积22.4222.397.18101853.55计算:1mol固体、液体的体积(20℃)规律?计算总结规律结论1mol 不同固体和液体体积不同,
1mol 不同气体体积大致相同影响物质体积的因素有哪些?粒子数目粒子的大小粒子间的距离小组讨论:影响物质体积的因素有哪些?(1)(2)(3)一、影响物质体积的因素1mol不同物质体积的决定因素是什么?NANA物质的微观结构模型一、影响物质体积的因素NANA主要因素为什么不研究固体和液体的摩尔体积? [ 实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。1 mol H2O( 18 mL)资料:气体分子间平均距离约为10-9m,气体分子的直径约为10-10m一、影响物质体积的因素NANA主要因素主要因素影响气体粒子之间距离的因素又是什么呢?影响气体粒子之间距离的因素
影响气体体积大小的因素有:
①物质的粒子数,②____,③____。 温度压强温度升高,气体粒子之间距离_______,压强增大,气体粒子之间的距离______增大减小在一定的温度和一定压强下,任何气体粒子之间的距离都是_________一定的同温同压下,如果 两种气体粒子数相同,那么它们的体积有什么关系呢?相同同温同压下,相同体积的任何气体含有_____
数目的粒子相同在一定的温度和一定压强下,
1 mol气体的体积是多少呢?在0℃和101kPa条件下, 1mol气体的体积
在0℃和101kPa条件下, 1mol任何气体的体积大约都是22.4L
一、气体摩尔体积1、定义:单位物质的量的气体所占的体积2、符号:Vm3、公式:Vm=V/n4、单位:L/mol和m3/mol数值?气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强5、数值:在标准状况下,气体摩尔体积
约为22.4L/mol要点:1、条件:标准状况(0℃和101kPa)
2、对象:任何气体(包括不反应的混合气体)
[当堂检测1]1. 标准状况下,1mol任何物质的体积都约是22.4L。(错,物质应是气体)2. 1mol气体的体积约为22.4L。(错,应标明条件-标准状况)3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。(错,未指明气体体积是否在相同条件下测定)5 .只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。7 .1 摩尔二氧化硫在20 ℃时的体积比 22.4 L 大
8 .1 摩尔氯化氢在303KPa 时的体积比 22.4 L 小
说法错误。 因忽略了压强的影响。 6 .1 摩尔水在标准状况下的体积约为 22.4 L说法错误。 因水在标准状况下不是气体。 说法错误。 因忽略了温度的影响。 (错)Vm=V/n变式?[当堂检测2] 标准状况下:(1)44.8升氢气的物质的量是多少?
(2)0.5摩尔氧气的体积是多少?
(3)14克CO的体积是多少?
(4)3.01×1023个O2所占体积约为 L。 n(H2)=V(H2)/Vm =44.8L÷22.4L/mol
=2molV(O2)=n(O2)×Vm =0.5mol×22.4L/mol =11.2L V(CO)=n(CO)×Vm =m(CO)/M(CO)×Vm =(14g÷28g/mol)×22.4L/mol =11.2L 11.2V
(气体)÷M×M×NA÷NAmnN小 结[作业:] 在标准状况下
(1)16gO2的体积是多少?
(2)44.8LN2中含有的N2分子数是多少?
