高中化学人教版必修一 第一章第一节 化学实验基本方法 课件
文档属性
| 名称 | 高中化学人教版必修一 第一章第一节 化学实验基本方法 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-20 00:00:00 | ||
图片预览











文档简介
课件41张PPT。第一章 从实验学化学第一节 化学实验基本方法回顾:氧气的制备方法①哪些仪器可以用来直接加热?哪些需要
垫石棉网?哪些不能直接加热?②药品的取用原则:不能、不要、不得;
节约药品;剩余药品不能放回原处,也
不能随意丢弃,放入指定容器。③加热操作:容器外壁不能有水(受热不均而破裂)
给固体加热——管口略向下倾斜,以防形
成的水滴倒流至管底引起试管破裂;先均
匀受热,再集中加热。
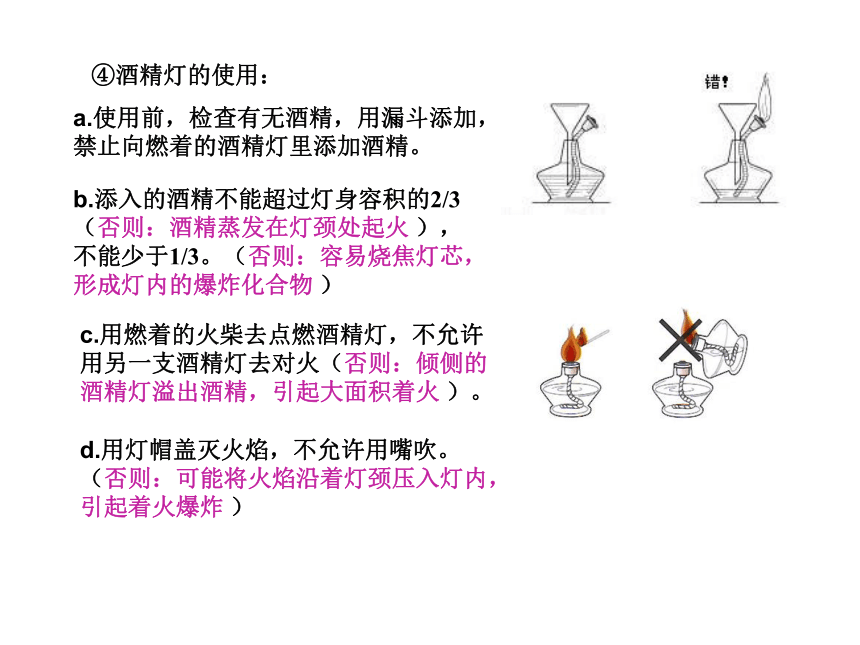
给液体加热——管口向上倾斜约45度角;试管内液体体积不超过试管容积的1/3;加热时,管口不能对着自己或他人。④酒精灯的使用:b.添入的酒精不能超过灯身容积的2/3
(否则:酒精蒸发在灯颈处起火 ),
不能少于1/3。(否则:容易烧焦灯芯,
形成灯内的爆炸化合物 )d.用灯帽盖灭火焰,不允许用嘴吹。
(否则:可能将火焰沿着灯颈压入灯内,
引起着火爆炸 ) ⑤氧气收集完之后,先移出导管,后熄灭
酒精灯(否则:水槽内的水倒流,使试管
炸裂)。 ⑥试管口为什么要放棉花团?(防止产生
的气流将固体物质带入导管)。掌握正确的操作方法!了解安全措施!点燃可燃气体或用可燃气体进行反应之前,要检验
气体的纯度。
实验室中的可燃物质要远离火源,检查灭火设备是否齐全制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通
风橱内进行,并采取相应的措施处理(灼烧、吸收、收集)。加热法制取气体并用排水法收集时,注意熄灯顺序;吸
收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗。2、危险化学品标志的识别H2、CH4、CO有机溶剂(酒精、汽油、乙醚、苯、甲苯)白磷Na、K、电石(CaC2)浓硫酸、浓硝酸、浓盐酸、冰醋酸、NaOH固体氰化物(KCN)、砷的化合物(砒霜As2O3)、钡盐、
汞(Hg)、铅(Pb)KMnO4、 KClO3(强氧化剂亦属爆炸品)、过氧化物(H2O2、Na2O2)TNT(三硝基甲苯)、镁粉、硝酸铵(NH4NO3)、
黑火药,等等。3、意外事故的处理创伤处理:
烫伤、烧伤处理:
酸碱腐蚀处理:
其他化学灼伤处理:先除去伤口的玻璃,用双氧水擦洗消毒或涂碘酒,而后敷药包扎。用75%-95%的酒精轻涂伤处,再涂烫伤药膏;严重
者立即就医。NaHCO3中和,再用水擦洗抹布拭去,用水冲洗,3%-5%的
NaHCO3中和抹布拭去,用水冲洗,涂上硼酸溶液中和用大量水冲洗,边洗边眨眼睛;然
后用硼酸溶液或NaHCO3溶液淋洗汞洒落,立即撒上硫粉,并打开排气扇;磷灼伤,
用CuSO4溶液涂抹伤处;遵守实验室规则!污染物和废弃物的处理!作业:
《评价手册》P1-3 化学实验基本方法(一)
复习总结“过滤”、“蒸发”等基本操作。火灾处理方法:防止火势扩展:移走可燃物,切断电源,停止通风。扑灭火源:酒精等有机溶剂泼洒在桌面上着火燃烧,用湿布、石棉或沙子盖灭,火势大可以用灭火器扑灭。小范围的有机物、钾、钠、白磷等化学物质着火可用沙盖灭。二、混合物的分离和提纯回顾:1、过滤与蒸发操作(一贴、二低、三靠)*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
通过溶解、过滤、蒸发操作之后,得到的固体就是纯净的食盐了吗? 如何检验SO42-?离子的检验:1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)2、步骤:
(1)先对试样的外观进行观察(颜色、状态)
(2)将试样(固体)配成溶液,取出少许进行检验
(3 )选择合理的试剂(反应灵敏、现象明显)
(4)注意排除某些共有现象的干扰。
▲SO42-的检验方法 先加入稀HNO3或稀HCl酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰,酸和钡盐的
选择应该视具体情况而定,不能一成不变硫酸根离子的检验1、检验Na2CO3中是否含有Na2SO4
应排除CO32-干扰——用酸
HCl 和BaCl2 或 HNO3和BaCl2
2、混合物中可能含有CO32-、SO42-、Ag+ , 检验是否含有SO42-
应排除CO32-、Ag+干扰——避免引入Cl-
先加HCl 检验是否有Ag+,且排除CO32-
干扰;再加BaCl2
3、检验Na2SO4中是否含有SO32-
排除SO32-的干扰——用酸,并避免引入HNO3
BaCl2和HCl
4、检验一未知溶液中是否含有SO42-
考虑CO32-、Ag+、SO32-的干扰
最佳方法—— HCl 酸化的BaCl2Cl-的检验方法: 操作:先加入稀HNO3酸化,再加入几滴AgNO3溶液。现象:出现不溶于稀硝酸的白色沉淀
(AgCl)。结论:存在氯离子。 注意排除CO32-离子的干扰!思考与交流化学除杂除杂原则:
*不增(尽量少引入新杂质)
*不减(不损耗样品)
*易分(容易分离——生成完全不溶物)
*复原(除去各种过量杂质,还原到目标产物)注意:除杂试剂要适当过量;设计所加试剂的先后顺序!对于粗盐水(NaCl)要除去可溶杂质离子是:选择要加入的除杂试剂:引入了新的离子:1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸只能适量例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是:A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、AgNO3、K2CO3、HNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3答案:CD2、蒸馏和萃取饮用水处理1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将难挥发或不挥发的杂质除去.蒸馏3.注意事项:4.烧瓶底加垫石棉网1.温度计水银球处于蒸馏烧瓶支管口处2.冷凝水,下口进,上口出3.投放沸石或瓷片防暴沸制取蒸馏水酒精和水的混合物能否用蒸馏法分离?先蒸馏出来的是什么组分?确定是否符合蒸馏条件?液体混合物——酒精与水以任意比互溶各组分沸点不同——酒精78℃,水100℃油和水可以用蒸馏法分离吗?沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!低最高4.蒸馏法的应用海水淡化蒸馏法
除此之外,还有反渗透法、电渗析法、离子交换法、冰冻法。反渗透法电渗析法 西红柿汤讨 论油层更红液体分层且
油层在上方色素在水中的溶解度明显小于在油中的溶解度 若番茄红素在油中的溶解度比在水中大许多,则少量油中溶解的“精华”将比多量水中溶解的还要多。分 析欲获取上层的红油,可如何操作?问 题仪器介绍分液漏斗——用于分离互不相溶的液体。分离“水和柴油”思考1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还有一步什么操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?2.使液体充分混合;打开活塞,放出产生的气体。3.使漏斗内外压强相等,便于液体流出。
下层液体从下端放出,上层液体从上口倒出。实 验1-4:如何从碘水中提取碘?表一:碘溶解于不同溶剂中的颜色表二:碘在不同溶剂中的溶解度(25℃)密度:水1.0g/ml;苯0.88g/m;四氯化碳1.59g/ml I2从原先的水层中转移到了CCl4中。萃取利用某种物质(溶质)在①互不相溶的溶剂里②溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。萃取剂的选择条件:
1.萃取剂与原溶剂互不相溶、不发生化学反应
2.溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大)
3.溶质不与萃取剂发生任何反应2.分液漏斗中盛有已分层的有机溶剂和水的混合液,但不知道哪一层液体是水层。试设计一种简便的判断方法。例题1.碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?
垫石棉网?哪些不能直接加热?②药品的取用原则:不能、不要、不得;
节约药品;剩余药品不能放回原处,也
不能随意丢弃,放入指定容器。③加热操作:容器外壁不能有水(受热不均而破裂)
给固体加热——管口略向下倾斜,以防形
成的水滴倒流至管底引起试管破裂;先均
匀受热,再集中加热。
给液体加热——管口向上倾斜约45度角;试管内液体体积不超过试管容积的1/3;加热时,管口不能对着自己或他人。④酒精灯的使用:b.添入的酒精不能超过灯身容积的2/3
(否则:酒精蒸发在灯颈处起火 ),
不能少于1/3。(否则:容易烧焦灯芯,
形成灯内的爆炸化合物 )d.用灯帽盖灭火焰,不允许用嘴吹。
(否则:可能将火焰沿着灯颈压入灯内,
引起着火爆炸 ) ⑤氧气收集完之后,先移出导管,后熄灭
酒精灯(否则:水槽内的水倒流,使试管
炸裂)。 ⑥试管口为什么要放棉花团?(防止产生
的气流将固体物质带入导管)。掌握正确的操作方法!了解安全措施!点燃可燃气体或用可燃气体进行反应之前,要检验
气体的纯度。
实验室中的可燃物质要远离火源,检查灭火设备是否齐全制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通
风橱内进行,并采取相应的措施处理(灼烧、吸收、收集)。加热法制取气体并用排水法收集时,注意熄灯顺序;吸
收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗。2、危险化学品标志的识别H2、CH4、CO有机溶剂(酒精、汽油、乙醚、苯、甲苯)白磷Na、K、电石(CaC2)浓硫酸、浓硝酸、浓盐酸、冰醋酸、NaOH固体氰化物(KCN)、砷的化合物(砒霜As2O3)、钡盐、
汞(Hg)、铅(Pb)KMnO4、 KClO3(强氧化剂亦属爆炸品)、过氧化物(H2O2、Na2O2)TNT(三硝基甲苯)、镁粉、硝酸铵(NH4NO3)、
黑火药,等等。3、意外事故的处理创伤处理:
烫伤、烧伤处理:
酸碱腐蚀处理:
其他化学灼伤处理:先除去伤口的玻璃,用双氧水擦洗消毒或涂碘酒,而后敷药包扎。用75%-95%的酒精轻涂伤处,再涂烫伤药膏;严重
者立即就医。NaHCO3中和,再用水擦洗抹布拭去,用水冲洗,3%-5%的
NaHCO3中和抹布拭去,用水冲洗,涂上硼酸溶液中和用大量水冲洗,边洗边眨眼睛;然
后用硼酸溶液或NaHCO3溶液淋洗汞洒落,立即撒上硫粉,并打开排气扇;磷灼伤,
用CuSO4溶液涂抹伤处;遵守实验室规则!污染物和废弃物的处理!作业:
《评价手册》P1-3 化学实验基本方法(一)
复习总结“过滤”、“蒸发”等基本操作。火灾处理方法:防止火势扩展:移走可燃物,切断电源,停止通风。扑灭火源:酒精等有机溶剂泼洒在桌面上着火燃烧,用湿布、石棉或沙子盖灭,火势大可以用灭火器扑灭。小范围的有机物、钾、钠、白磷等化学物质着火可用沙盖灭。二、混合物的分离和提纯回顾:1、过滤与蒸发操作(一贴、二低、三靠)*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
通过溶解、过滤、蒸发操作之后,得到的固体就是纯净的食盐了吗? 如何检验SO42-?离子的检验:1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)2、步骤:
(1)先对试样的外观进行观察(颜色、状态)
(2)将试样(固体)配成溶液,取出少许进行检验
(3 )选择合理的试剂(反应灵敏、现象明显)
(4)注意排除某些共有现象的干扰。
▲SO42-的检验方法 先加入稀HNO3或稀HCl酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰,酸和钡盐的
选择应该视具体情况而定,不能一成不变硫酸根离子的检验1、检验Na2CO3中是否含有Na2SO4
应排除CO32-干扰——用酸
HCl 和BaCl2 或 HNO3和BaCl2
2、混合物中可能含有CO32-、SO42-、Ag+ , 检验是否含有SO42-
应排除CO32-、Ag+干扰——避免引入Cl-
先加HCl 检验是否有Ag+,且排除CO32-
干扰;再加BaCl2
3、检验Na2SO4中是否含有SO32-
排除SO32-的干扰——用酸,并避免引入HNO3
BaCl2和HCl
4、检验一未知溶液中是否含有SO42-
考虑CO32-、Ag+、SO32-的干扰
最佳方法—— HCl 酸化的BaCl2Cl-的检验方法: 操作:先加入稀HNO3酸化,再加入几滴AgNO3溶液。现象:出现不溶于稀硝酸的白色沉淀
(AgCl)。结论:存在氯离子。 注意排除CO32-离子的干扰!思考与交流化学除杂除杂原则:
*不增(尽量少引入新杂质)
*不减(不损耗样品)
*易分(容易分离——生成完全不溶物)
*复原(除去各种过量杂质,还原到目标产物)注意:除杂试剂要适当过量;设计所加试剂的先后顺序!对于粗盐水(NaCl)要除去可溶杂质离子是:选择要加入的除杂试剂:引入了新的离子:1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸只能适量例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是:A.Ba(NO3)2、K2CO3、AgNO3、HNO3
B.K2CO3、Ba(NO3)2、AgNO3、HNO3
C.Ba(NO3)2、AgNO3、K2CO3、HNO3
D.AgNO3、Ba(NO3)2、K2CO3、HNO3答案:CD2、蒸馏和萃取饮用水处理1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将难挥发或不挥发的杂质除去.蒸馏3.注意事项:4.烧瓶底加垫石棉网1.温度计水银球处于蒸馏烧瓶支管口处2.冷凝水,下口进,上口出3.投放沸石或瓷片防暴沸制取蒸馏水酒精和水的混合物能否用蒸馏法分离?先蒸馏出来的是什么组分?确定是否符合蒸馏条件?液体混合物——酒精与水以任意比互溶各组分沸点不同——酒精78℃,水100℃油和水可以用蒸馏法分离吗?沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!低最高4.蒸馏法的应用海水淡化蒸馏法
除此之外,还有反渗透法、电渗析法、离子交换法、冰冻法。反渗透法电渗析法 西红柿汤讨 论油层更红液体分层且
油层在上方色素在水中的溶解度明显小于在油中的溶解度 若番茄红素在油中的溶解度比在水中大许多,则少量油中溶解的“精华”将比多量水中溶解的还要多。分 析欲获取上层的红油,可如何操作?问 题仪器介绍分液漏斗——用于分离互不相溶的液体。分离“水和柴油”思考1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还有一步什么操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?2.使液体充分混合;打开活塞,放出产生的气体。3.使漏斗内外压强相等,便于液体流出。
下层液体从下端放出,上层液体从上口倒出。实 验1-4:如何从碘水中提取碘?表一:碘溶解于不同溶剂中的颜色表二:碘在不同溶剂中的溶解度(25℃)密度:水1.0g/ml;苯0.88g/m;四氯化碳1.59g/ml I2从原先的水层中转移到了CCl4中。萃取利用某种物质(溶质)在①互不相溶的溶剂里②溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。萃取剂的选择条件:
1.萃取剂与原溶剂互不相溶、不发生化学反应
2.溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大)
3.溶质不与萃取剂发生任何反应2.分液漏斗中盛有已分层的有机溶剂和水的混合液,但不知道哪一层液体是水层。试设计一种简便的判断方法。例题1.碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?
