第2节 金属矿物 铁的冶炼第一课时课件(35张PPT)
文档属性
| 名称 | 第2节 金属矿物 铁的冶炼第一课时课件(35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-22 00:00:00 | ||
图片预览









文档简介
课件35张PPT。第二节 金属矿物铁的冶炼
第一课时一.常见金属矿物1.分布和存在金属在自然界中主要以单质存在,还是以化合物存在?极少数金属以单质(游离态)存在 自然界中以单质存在的银自然界中以单质存在的金 化合态金属在自然界中以矿物的形式存在。含有矿物的岩石称为矿石。大多数金属以化合物(化合态)存在 为什么金、银等少数金属以单质的形式存在?
而大多数金属以化合物的形式存在呢?思考:地壳中含量在前三位的金属元素分别是什么?2.常见矿石赤铁矿Fe2O3黄铁矿FeS2褐铁矿Fe2O3·XH2O磁铁矿Fe3O4菱铁矿FeCO3铝土矿Al2O3孔雀石Cu2(OH)2CO3赤铜矿Cu2O黄铜矿CuFeS2 铁元素在自然界中分布很广,在地壳中含量位居金 属元素的第二位,仅次于铝,约占地壳总质量的4.75%。
我国大型铁矿有:辽宁鞍山、湖北大冶、四川攀枝花
使金属矿物变成金属的过程,叫做金属的冶炼。褐铁矿(Fe2O3·nH2O)
(含铁量约37-55% )黄铁矿FeS2
(含铁量约45% ) 磁铁矿Fe3O4
(含铁量约72% )选矿需考虑的因素:
通常考虑矿石的价格、金属的含量、安全无污染等
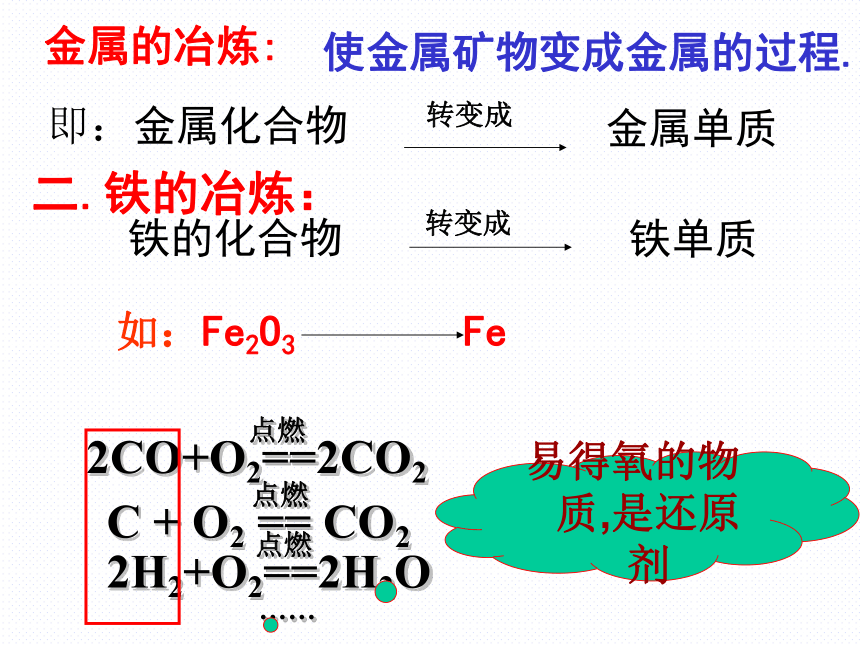
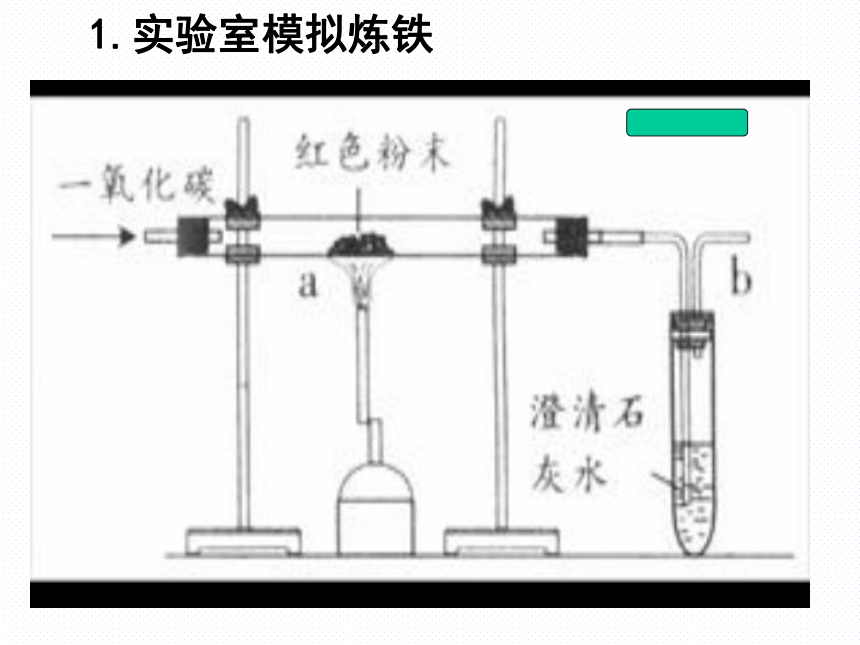
金属的冶炼:即:金属化合物金属单质转变成使金属矿物变成金属的过程.二.铁的冶炼:铁的化合物转变成铁单质如:Fe2O3Fe易得氧的物质,是还原剂1.实验室模拟炼铁(1)检查装置的气密性;
(2)装入药品并固定装置;
(3)向玻璃管内通一氧化碳气体;
(4)点燃酒精喷灯,给氧化铁加热;
(5)熄灭酒精喷灯,停止加热;
(6)待试管冷却后停止通一氧化碳。实验步骤CO:早出晚归
酒精灯:迟到早退实验原理实验现象红色粉末变成黑色,石灰水变浑浊。红棕色Fe2O3 +3CO Fe+3CO2
黑色在高温条件下,用还原剂 从铁的氧化物中将铁还原出来。一氧化碳CO2+Ca(OH)2 = CaCO3 +H2O讨论1.实验中CO所起作用
(1)加热前先通CO作用
(2) 加热时不断通CO作用
(3)停止加热继续通CO作用
排清玻璃管中空气,防止加热不纯CO发生爆炸保持还原性氛围防止热的铁粉被空气氧化,防止石灰水倒吸2.澄清石灰水的作用?
检验是否有CO2生成(1)加入稀硫酸(稀盐酸),观察是否有气泡生成
(2)加入硫酸铜观察是否有
红色固体生成
用磁铁吸引行吗?3.黑色物质可能是什么?如何检验?查阅资料:
铁粉以及铁的氧化物(除了氧化铁外)都是黑色,且都溶于盐酸,只有铁反应时有气泡冒出。产生蓝色火焰4.为什么要进行尾气处理?尾气处理方法?
因为CO有毒会污染环境点燃或收集或再利用CO澄清石灰水气囊Fe2O3排水集气法澄清石灰水主要反应 3CO+Fe2O3 = 2Fe+3CO2高温C+CO2 = 2CO高温C+O2 = CO2点燃高炉2.工业炼铁(1)设备:(2)原料:1.铁矿石:
2.焦 炭:
3.石灰石:
4.空 气:提供铁元素a.提供热量、维持炉温
b.制还原剂CO制造炉渣 提供氧气(3)生铁出口低于炉渣出口原因?熔化的生铁密度大于炉渣的密度写出四氧化三铁分别与焦炭、氢气、
一氧化碳在高温下反应的化学方程式。2C+Fe3O4 = 3Fe+2CO2↑高温4H2+Fe3O4 = 3Fe+4H2O高温4CO+Fe3O4 = 3Fe+4CO2高温解:设可以炼出含杂质4%的生铁的质量为x。500t×70%(1-4%)x1602×56答:可以炼出含杂质4%的生铁255.2t。x=255.2t3.有关含杂物质的计算例: 用500t含氧化铁质量分数为70%的赤铁
矿,可以炼出含杂质4%的生铁多少吨?另解:设可以炼出含杂质4%的生铁的质量为xx=255.2t本题还有另一种解法,根据化学变化前后铁元素的质量不变来求解。答:可以炼出含杂质4%的生铁255.2t。把金属矿物与焦炭或氢气、一氧化碳等物质一起加热反应
冶炼锰、锌、铁、镍、铅等都是这种方法。
举例:第一种方法高炉炼铁还原法拓展视野金属的冶炼方法电解法
冶炼钠、钾、镁、铝等是这种方法
举例:第二种方法2Al2O3 4Al+3O2↑通电湿法冶金(铜)
用活泼金属将一些不太活泼的金属从其金属化合物中置换出来。举例:第三种方法Fe+CuSO4=FeSO4+Cu金属的冶炼方法 右图是用CO还原CuO的
实验装置,
(1)有下列实验步骤:
①加热;②通入一氧化碳。请用上述实验步骤的实验开始时,应先_____,然后______。
(2)一段时间后,A装置中现象为_______ ___,说明有____ _生成,B装置中出现的现象为______________,说明有_________生成。①②粉末由黑变红Cu石灰水变浑浊CO2学以致用(3)装置A中方程式为_________________,
装置B中方程式为_______________________,
装置C的目的是_________________。
(4)反应结束,应先__________,待冷却后__________。 CO2+Ca(OH)2=CaCO3↓+H2O处理尾气,防污染停止加热停止通一氧化碳CuO+CO==Cu+CO2高温 8gCO在高温下跟5.8g某种铁的氧化物完全反应,这种氧化物是( )
A、FeO B、Fe2O3 C、Fe3O4 C
(1)用CO还原CuO的实验步骤:
①加热 ②通CO ③熄灭酒精灯 ④停止通CO
(2)尾气要处理的原因:
(3)尾气还可以怎样处理:
(4)如果将CO改为H2还要进行尾气处理吗?② ① ③ ④CO有剧毒点燃、收集不用,因为H2无毒
1.炼铁的原料是( )
A.铁矿石、一氧化碳、空气
B.铁矿石、烟煤、生石灰
C.铁矿石、焦炭、空气
D.铁矿石、焦炭、石灰石、空气D随堂练习2.现有 ① 磁铁矿(主要成分:Fe3O4 )② 黄铁矿(主要成分FeS2 ) ③ 赤铁矿(主要成分Fe2O3),请你从多角度分析三种矿石中哪种不适合用来炼铁,(填写序号)????? ;
原因:含铁量不高且会产生二氧化硫污染空气②分析:磁铁矿(Fe3O4)Fe%=72.4%
赤铁矿(Fe2O3)Fe%=70%
黄铁矿(FeS2)Fe%=46.7%
3.工业上以赤铁矿(Fe2O3)
为原料冶炼铁。某钢铁厂冶炼
896Kg铁,需要含Fe2O364%
的赤铁矿多少千克?2000千克含杂质物质的化学方程式的计算
例1:2000t含氧化铁75%的赤铁矿石,可炼出含杂质3%的生铁多少吨?
练习:某兴趣小组为测定某生铁样品中铁的质量分数,将5g生铁放入足量的盐酸中浸泡,当无气泡产生时,过滤,将滤渣洗涤、烘干、称量,质量为0.15g。
(1)通过计算说明,该生铁样品中铁的含量。
(2)若过滤后滤渣不经烘干便称量,对结果有何影响?
第一课时一.常见金属矿物1.分布和存在金属在自然界中主要以单质存在,还是以化合物存在?极少数金属以单质(游离态)存在 自然界中以单质存在的银自然界中以单质存在的金 化合态金属在自然界中以矿物的形式存在。含有矿物的岩石称为矿石。大多数金属以化合物(化合态)存在 为什么金、银等少数金属以单质的形式存在?
而大多数金属以化合物的形式存在呢?思考:地壳中含量在前三位的金属元素分别是什么?2.常见矿石赤铁矿Fe2O3黄铁矿FeS2褐铁矿Fe2O3·XH2O磁铁矿Fe3O4菱铁矿FeCO3铝土矿Al2O3孔雀石Cu2(OH)2CO3赤铜矿Cu2O黄铜矿CuFeS2 铁元素在自然界中分布很广,在地壳中含量位居金 属元素的第二位,仅次于铝,约占地壳总质量的4.75%。
我国大型铁矿有:辽宁鞍山、湖北大冶、四川攀枝花
使金属矿物变成金属的过程,叫做金属的冶炼。褐铁矿(Fe2O3·nH2O)
(含铁量约37-55% )黄铁矿FeS2
(含铁量约45% ) 磁铁矿Fe3O4
(含铁量约72% )选矿需考虑的因素:
通常考虑矿石的价格、金属的含量、安全无污染等
金属的冶炼:即:金属化合物金属单质转变成使金属矿物变成金属的过程.二.铁的冶炼:铁的化合物转变成铁单质如:Fe2O3Fe易得氧的物质,是还原剂1.实验室模拟炼铁(1)检查装置的气密性;
(2)装入药品并固定装置;
(3)向玻璃管内通一氧化碳气体;
(4)点燃酒精喷灯,给氧化铁加热;
(5)熄灭酒精喷灯,停止加热;
(6)待试管冷却后停止通一氧化碳。实验步骤CO:早出晚归
酒精灯:迟到早退实验原理实验现象红色粉末变成黑色,石灰水变浑浊。红棕色Fe2O3 +3CO Fe+3CO2
黑色在高温条件下,用还原剂 从铁的氧化物中将铁还原出来。一氧化碳CO2+Ca(OH)2 = CaCO3 +H2O讨论1.实验中CO所起作用
(1)加热前先通CO作用
(2) 加热时不断通CO作用
(3)停止加热继续通CO作用
排清玻璃管中空气,防止加热不纯CO发生爆炸保持还原性氛围防止热的铁粉被空气氧化,防止石灰水倒吸2.澄清石灰水的作用?
检验是否有CO2生成(1)加入稀硫酸(稀盐酸),观察是否有气泡生成
(2)加入硫酸铜观察是否有
红色固体生成
用磁铁吸引行吗?3.黑色物质可能是什么?如何检验?查阅资料:
铁粉以及铁的氧化物(除了氧化铁外)都是黑色,且都溶于盐酸,只有铁反应时有气泡冒出。产生蓝色火焰4.为什么要进行尾气处理?尾气处理方法?
因为CO有毒会污染环境点燃或收集或再利用CO澄清石灰水气囊Fe2O3排水集气法澄清石灰水主要反应 3CO+Fe2O3 = 2Fe+3CO2高温C+CO2 = 2CO高温C+O2 = CO2点燃高炉2.工业炼铁(1)设备:(2)原料:1.铁矿石:
2.焦 炭:
3.石灰石:
4.空 气:提供铁元素a.提供热量、维持炉温
b.制还原剂CO制造炉渣 提供氧气(3)生铁出口低于炉渣出口原因?熔化的生铁密度大于炉渣的密度写出四氧化三铁分别与焦炭、氢气、
一氧化碳在高温下反应的化学方程式。2C+Fe3O4 = 3Fe+2CO2↑高温4H2+Fe3O4 = 3Fe+4H2O高温4CO+Fe3O4 = 3Fe+4CO2高温解:设可以炼出含杂质4%的生铁的质量为x。500t×70%(1-4%)x1602×56答:可以炼出含杂质4%的生铁255.2t。x=255.2t3.有关含杂物质的计算例: 用500t含氧化铁质量分数为70%的赤铁
矿,可以炼出含杂质4%的生铁多少吨?另解:设可以炼出含杂质4%的生铁的质量为xx=255.2t本题还有另一种解法,根据化学变化前后铁元素的质量不变来求解。答:可以炼出含杂质4%的生铁255.2t。把金属矿物与焦炭或氢气、一氧化碳等物质一起加热反应
冶炼锰、锌、铁、镍、铅等都是这种方法。
举例:第一种方法高炉炼铁还原法拓展视野金属的冶炼方法电解法
冶炼钠、钾、镁、铝等是这种方法
举例:第二种方法2Al2O3 4Al+3O2↑通电湿法冶金(铜)
用活泼金属将一些不太活泼的金属从其金属化合物中置换出来。举例:第三种方法Fe+CuSO4=FeSO4+Cu金属的冶炼方法 右图是用CO还原CuO的
实验装置,
(1)有下列实验步骤:
①加热;②通入一氧化碳。请用上述实验步骤的实验开始时,应先_____,然后______。
(2)一段时间后,A装置中现象为_______ ___,说明有____ _生成,B装置中出现的现象为______________,说明有_________生成。①②粉末由黑变红Cu石灰水变浑浊CO2学以致用(3)装置A中方程式为_________________,
装置B中方程式为_______________________,
装置C的目的是_________________。
(4)反应结束,应先__________,待冷却后__________。 CO2+Ca(OH)2=CaCO3↓+H2O处理尾气,防污染停止加热停止通一氧化碳CuO+CO==Cu+CO2高温 8gCO在高温下跟5.8g某种铁的氧化物完全反应,这种氧化物是( )
A、FeO B、Fe2O3 C、Fe3O4 C
(1)用CO还原CuO的实验步骤:
①加热 ②通CO ③熄灭酒精灯 ④停止通CO
(2)尾气要处理的原因:
(3)尾气还可以怎样处理:
(4)如果将CO改为H2还要进行尾气处理吗?② ① ③ ④CO有剧毒点燃、收集不用,因为H2无毒
1.炼铁的原料是( )
A.铁矿石、一氧化碳、空气
B.铁矿石、烟煤、生石灰
C.铁矿石、焦炭、空气
D.铁矿石、焦炭、石灰石、空气D随堂练习2.现有 ① 磁铁矿(主要成分:Fe3O4 )② 黄铁矿(主要成分FeS2 ) ③ 赤铁矿(主要成分Fe2O3),请你从多角度分析三种矿石中哪种不适合用来炼铁,(填写序号)????? ;
原因:含铁量不高且会产生二氧化硫污染空气②分析:磁铁矿(Fe3O4)Fe%=72.4%
赤铁矿(Fe2O3)Fe%=70%
黄铁矿(FeS2)Fe%=46.7%
3.工业上以赤铁矿(Fe2O3)
为原料冶炼铁。某钢铁厂冶炼
896Kg铁,需要含Fe2O364%
的赤铁矿多少千克?2000千克含杂质物质的化学方程式的计算
例1:2000t含氧化铁75%的赤铁矿石,可炼出含杂质3%的生铁多少吨?
练习:某兴趣小组为测定某生铁样品中铁的质量分数,将5g生铁放入足量的盐酸中浸泡,当无气泡产生时,过滤,将滤渣洗涤、烘干、称量,质量为0.15g。
(1)通过计算说明,该生铁样品中铁的含量。
(2)若过滤后滤渣不经烘干便称量,对结果有何影响?
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
