高中化学人教版必修一 第一章第二节 化学计量在实验中的应用 课件
文档属性
| 名称 | 高中化学人教版必修一 第一章第二节 化学计量在实验中的应用 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 503.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-27 19:14:29 | ||
图片预览










文档简介
课件36张PPT。
第一章
从实验学化学
第二节
化学计量在实验中的应用
第二课时
气体摩尔体积复习提问请同学们分别写出:
物质的量(n)与阿伏加德罗常数(NA)及微粒个数(N)之间的关系。
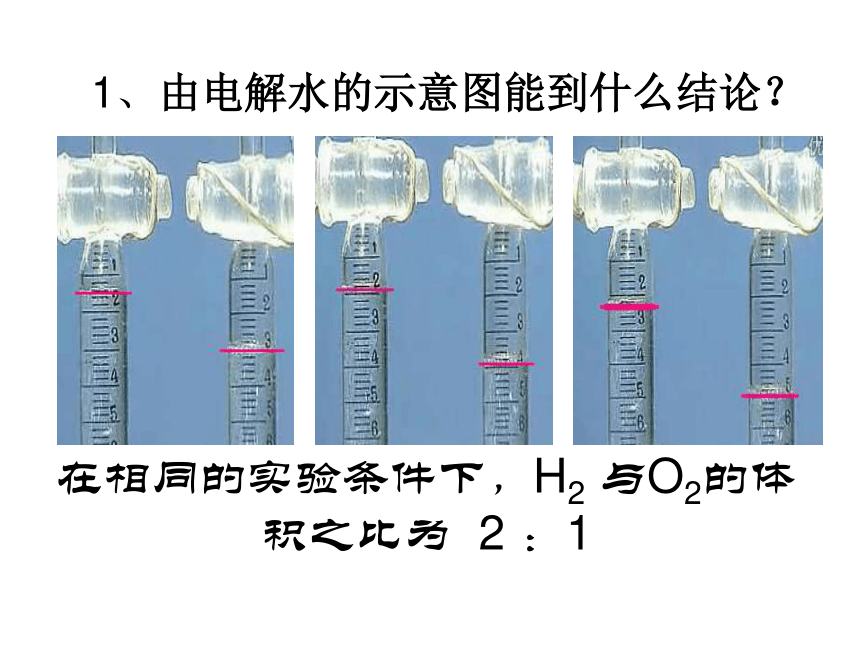
物质的量(n)与摩尔质量(M)及物质的质量(m)之间的关系。 二、气体摩尔体积 【学生活动】请大家观察以下电解水实验截图,完成p13科学探究科学探究 由电解水的示意图能到什么结论?
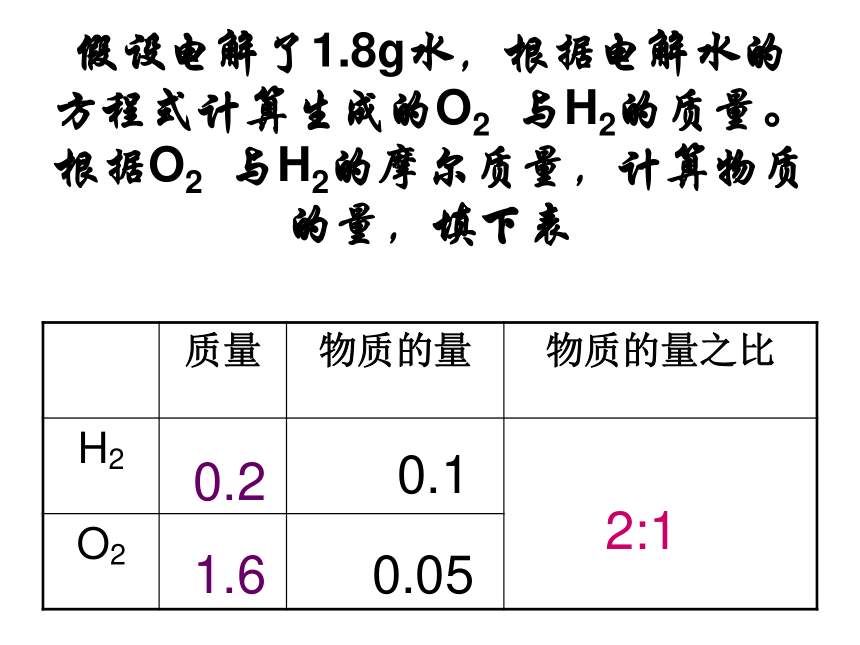
假设电解了1.8g水,根据电解水的方程式计算生成的O2 与H2的质量。根据O2 与H2的摩尔质量,计算物质的量,填下表
通过观察电解水的示意图与相关计算你能得出什么结论?
1、由电解水的示意图能到什么结论? 在相同的实验条件下,H2 与O2的体积之比为 2 :1假设电解了1.8g水,根据电解水的方程式计算生成的O2 与H2的质量。根据O2 与H2的摩尔质量,计算物质的量,填下表0.20.11.60.052:1
3.通过观察电解水的示意图与相关计算你能得出什么结论? 在相同的温度与压强下,H2 与O2的物质的量之比等于 H2与O2的体积之比(同一温度与压强下,1mol H2与1mol O2的体积相同) 下表列出了0℃、101 kPa时H2和O2 及CO2的密度,请计算出1 mol H2 、O2和CO2的体积。从中你又会得出什么结论?结论:在0℃、101 kPa (标准状况) 1mol任何气体的体积都约是22.4L 22.322.422.3下表列出了20℃时几种固体和液体的密度,请计算出1 mol这几种物质的体积,从中你会得到什么结论? 结论:在相同条件下,1mol固体或液体的体积不相同,而且相差很大 7.110.018.053.6【学生活动】 请同学们认真阅读教材P14内容,完成以下几个问题。
1、决定物质体积大小的因素有哪些?
2、决定固态或液态物质体积大小的因素是什么?为什么粒子数目相同时,固态或液态物质的体积相差很大?
3、决定气体物质体积大小的因素是什么?为什么气体分子数目相同时,气体的体积几乎相同呢?
4、为什么讨论气体体积要强调温度和压强?1、决定物质体积大小的因素
(1)、物质所含粒子数目;
(2)、粒子的大小;
(3)、微粒之间的距离2、决定固态或液态物质体积大小的因素是什么?
为什么粒子数目相同时,固态或液态物质的体积相差很大?固体物质液体物质对于固态或液态物质来讲,粒子之间的距离是非常小的,这使的固态或液态物质的粒子本身的“直径”远远大于粒子之间的距离,所以决定固态或液态物质体积大小的主要因素是:粒子数目和粒子的大小。
当粒子数目相同时,粒子的大小就决定固态或液态物质体积大小,但因为不同物质粒子大小是不同的,所以当粒子数目相同时,固态或液态物质的体积相差很大。
3、决定气体物质体积大小的因素是什么?
为什么气体分子数目相同时,气体的体积几乎相同呢?分子直径气体物质分子间的平均距离 对于气体来讲,分子之间的距离很大,远远大于分子本身的“直径”。所以决定气体体积大小的主要因素是:粒子数目和粒子之间的距离。
若气体分子数目相同,则气体体积的大小主要取决于分子之间的距离。而气体分子间的距离的大小主要受温度和压强的影响。在相同的温度和相同的压强下,任何气体分子间的平均距离几乎都是相等的。所以气体分子数目相同时,气体体的体积几乎相同。
4、为什么讨论气体体积要强
调温度和压强?温度固
体气
体压强固
体气
体 对于气体而言,当压强一定时,温度越高,气体分子间的距离越大 ,则气体体积越大;
当温度一定时,压强越大,气体分子间的距离越小 ,则气体体积越小。科学实验表明:在相同的温度和相同的压强下,任何气体分子间的平均距离几乎都是相等的。 气体摩尔体积(1)、概念:单位物质的量的气体所占的体积,称为气体摩尔体积。
(2)、符号:Vm
(3)、定义式: Vm =V(气体)/n(气体)
(4)、单位:升/摩尔(L/mol或L·mol-1)
通常将温度为0℃,压强101 kPa时的
状况称为标准状态 。
(5)、标准状况下气体的摩尔体积约是
22.4L/mol 【自主练习】 1.在标准状况下,1 mol任何物质的体积都约为22.4 L。 ( )
2.1 mol气体的体积约为22.4 L。( )
3.在标准状况下,1 mol O2和N2混合气(任意比)的体积约为22.4 L。( )
××√ 4. 22.4 L气体所含分子数一定大于 11.2 L气体所含的分子数。 ( )
5. 1mol气体的体积是22.4 L,则一定在标准状况下。 ( )
6.只有在标准状况下,气体的摩尔体积才能是22.4 L/mol。 ( )×××理解标准状况下气体摩尔体积时应注意事项(6)注意事项
①、条件:是在标准状况(0℃、101kPa下;
②、研究对象:任何气体,可以是单一气体也可以是混合气体;
③、物质的量:1mol;
④、所占体积:约为22.4L。阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。【特别强调】对这一定律的理解一定要明确适用范围为气体(可以为混合气体)。
“同温”、“同压”、“同体积”、“同分子数目”,三同就可定一同。
如:在同温同压下,A、B两种气体
本节小结1、决定物质体积的因素:
粒子大小、粒子数目、粒子之间的距离
2、气体摩尔体积
(1)概念
(2)符号
(3)单位
(4)表达式
(5)标准状况下气体摩尔体积
(6)标准状况下气体摩尔体积注意事项
3、阿伏加德罗定律当堂检测1.常温常压下,气体体积的大小取决于( )
A.分子半径
B.分子质量
C.分子总数
D.分子间的平均距离C2.下列说法中正确的是 ( )A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中含有N的物质的量约为2 molD3.标准状况下,0.4 mol HCl气体的体积是 ( ) A.22.4 L B.11.2 L
C.4.48 L D.8.96 L
解析:
D4.判断下列说法的正误(1)标准状况下,1 mol任何气体的体积都约是22.4 L( )
(2)同温同压下,1 mol(含有相同的粒子数)任何气体的体积相同( )
(3)同温同压下,相同体积的任何气体含有相同数目的分子数( )
(4)标准状况下,16 g氧气与2 g氢气的体积比是1∶2( )√√√√谢谢大家!
物质的量(n)与阿伏加德罗常数(NA)及微粒个数(N)之间的关系。
物质的量(n)与摩尔质量(M)及物质的质量(m)之间的关系。 二、气体摩尔体积 【学生活动】请大家观察以下电解水实验截图,完成p13科学探究科学探究 由电解水的示意图能到什么结论?
假设电解了1.8g水,根据电解水的方程式计算生成的O2 与H2的质量。根据O2 与H2的摩尔质量,计算物质的量,填下表
通过观察电解水的示意图与相关计算你能得出什么结论?
1、由电解水的示意图能到什么结论? 在相同的实验条件下,H2 与O2的体积之比为 2 :1假设电解了1.8g水,根据电解水的方程式计算生成的O2 与H2的质量。根据O2 与H2的摩尔质量,计算物质的量,填下表0.20.11.60.052:1
3.通过观察电解水的示意图与相关计算你能得出什么结论? 在相同的温度与压强下,H2 与O2的物质的量之比等于 H2与O2的体积之比(同一温度与压强下,1mol H2与1mol O2的体积相同) 下表列出了0℃、101 kPa时H2和O2 及CO2的密度,请计算出1 mol H2 、O2和CO2的体积。从中你又会得出什么结论?结论:在0℃、101 kPa (标准状况) 1mol任何气体的体积都约是22.4L 22.322.422.3下表列出了20℃时几种固体和液体的密度,请计算出1 mol这几种物质的体积,从中你会得到什么结论? 结论:在相同条件下,1mol固体或液体的体积不相同,而且相差很大 7.110.018.053.6【学生活动】 请同学们认真阅读教材P14内容,完成以下几个问题。
1、决定物质体积大小的因素有哪些?
2、决定固态或液态物质体积大小的因素是什么?为什么粒子数目相同时,固态或液态物质的体积相差很大?
3、决定气体物质体积大小的因素是什么?为什么气体分子数目相同时,气体的体积几乎相同呢?
4、为什么讨论气体体积要强调温度和压强?1、决定物质体积大小的因素
(1)、物质所含粒子数目;
(2)、粒子的大小;
(3)、微粒之间的距离2、决定固态或液态物质体积大小的因素是什么?
为什么粒子数目相同时,固态或液态物质的体积相差很大?固体物质液体物质对于固态或液态物质来讲,粒子之间的距离是非常小的,这使的固态或液态物质的粒子本身的“直径”远远大于粒子之间的距离,所以决定固态或液态物质体积大小的主要因素是:粒子数目和粒子的大小。
当粒子数目相同时,粒子的大小就决定固态或液态物质体积大小,但因为不同物质粒子大小是不同的,所以当粒子数目相同时,固态或液态物质的体积相差很大。
3、决定气体物质体积大小的因素是什么?
为什么气体分子数目相同时,气体的体积几乎相同呢?分子直径气体物质分子间的平均距离 对于气体来讲,分子之间的距离很大,远远大于分子本身的“直径”。所以决定气体体积大小的主要因素是:粒子数目和粒子之间的距离。
若气体分子数目相同,则气体体积的大小主要取决于分子之间的距离。而气体分子间的距离的大小主要受温度和压强的影响。在相同的温度和相同的压强下,任何气体分子间的平均距离几乎都是相等的。所以气体分子数目相同时,气体体的体积几乎相同。
4、为什么讨论气体体积要强
调温度和压强?温度固
体气
体压强固
体气
体 对于气体而言,当压强一定时,温度越高,气体分子间的距离越大 ,则气体体积越大;
当温度一定时,压强越大,气体分子间的距离越小 ,则气体体积越小。科学实验表明:在相同的温度和相同的压强下,任何气体分子间的平均距离几乎都是相等的。 气体摩尔体积(1)、概念:单位物质的量的气体所占的体积,称为气体摩尔体积。
(2)、符号:Vm
(3)、定义式: Vm =V(气体)/n(气体)
(4)、单位:升/摩尔(L/mol或L·mol-1)
通常将温度为0℃,压强101 kPa时的
状况称为标准状态 。
(5)、标准状况下气体的摩尔体积约是
22.4L/mol 【自主练习】 1.在标准状况下,1 mol任何物质的体积都约为22.4 L。 ( )
2.1 mol气体的体积约为22.4 L。( )
3.在标准状况下,1 mol O2和N2混合气(任意比)的体积约为22.4 L。( )
××√ 4. 22.4 L气体所含分子数一定大于 11.2 L气体所含的分子数。 ( )
5. 1mol气体的体积是22.4 L,则一定在标准状况下。 ( )
6.只有在标准状况下,气体的摩尔体积才能是22.4 L/mol。 ( )×××理解标准状况下气体摩尔体积时应注意事项(6)注意事项
①、条件:是在标准状况(0℃、101kPa下;
②、研究对象:任何气体,可以是单一气体也可以是混合气体;
③、物质的量:1mol;
④、所占体积:约为22.4L。阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。【特别强调】对这一定律的理解一定要明确适用范围为气体(可以为混合气体)。
“同温”、“同压”、“同体积”、“同分子数目”,三同就可定一同。
如:在同温同压下,A、B两种气体
本节小结1、决定物质体积的因素:
粒子大小、粒子数目、粒子之间的距离
2、气体摩尔体积
(1)概念
(2)符号
(3)单位
(4)表达式
(5)标准状况下气体摩尔体积
(6)标准状况下气体摩尔体积注意事项
3、阿伏加德罗定律当堂检测1.常温常压下,气体体积的大小取决于( )
A.分子半径
B.分子质量
C.分子总数
D.分子间的平均距离C2.下列说法中正确的是 ( )A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中含有N的物质的量约为2 molD3.标准状况下,0.4 mol HCl气体的体积是 ( ) A.22.4 L B.11.2 L
C.4.48 L D.8.96 L
解析:
D4.判断下列说法的正误(1)标准状况下,1 mol任何气体的体积都约是22.4 L( )
(2)同温同压下,1 mol(含有相同的粒子数)任何气体的体积相同( )
(3)同温同压下,相同体积的任何气体含有相同数目的分子数( )
(4)标准状况下,16 g氧气与2 g氢气的体积比是1∶2( )√√√√谢谢大家!
