高中化学人教版必修一 第一章第二节 化学计量在实验中的应用
文档属性
| 名称 | 高中化学人教版必修一 第一章第二节 化学计量在实验中的应用 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-27 00:00:00 | ||
图片预览







文档简介
课件33张PPT。气体摩尔体积〔引入新课〕由上一节的学习,我们已掌握了宏观物质的质量与微观粒子数量之间的关系,那么,物质的宏观体积与微观粒子之间的关系又如何呢?计算下列3题(1)计算在20℃,1标准大气压下,1摩尔铝、铁、铅各占有多大的体积?(已知:铝的密度是2.7g/cm3,铁的密度是7.86g/cm3,铅的密度是11.3g/cm3)
(2)计算15℃,1标准大气压下1摩尔水?硫酸?蔗糖液各占有多大的体积?(水的密度为1.0g/cm3,硫酸的密度为1.811g/cm3,蔗糖液的密度为1.588g/cm3, 蔗糖的摩尔质量为342g/mol)
(3)在标准状况下,1摩尔氢气?氧气?二氧化碳气体的体积各是多少升?(氢气的密度为0.0899g/L,氧气的密度为1.429g/L,二氧化碳气体的密度为1.977g/L。) 小结:由上述计算可知,在相同条件下,1摩尔各种固体的体积是不相同的?小结:由上述计算可见,在相同条件下,各种液体的摩尔体积是不相同的。1 摩尔水 1摩尔硫酸 1摩尔蔗糖18克 98克 342克6.02×1023个硫酸分子6.02×1023个
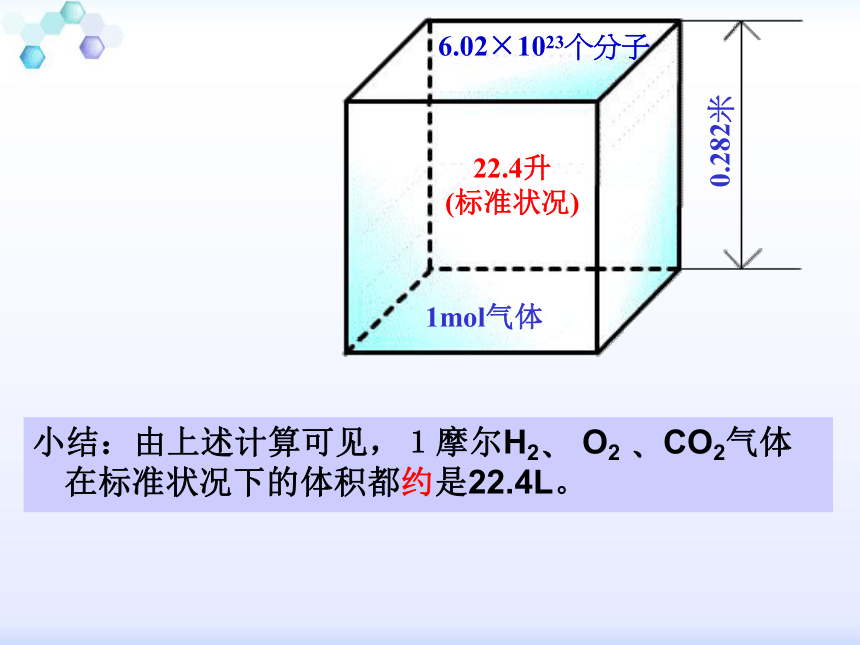
蔗糖分子6.02×1023个水分子小结:由上述计算可见,1摩尔H2? O2 ?CO2气体在标准状况下的体积都约是22.4L。22.4升
(标准状况)6.02×1023个分子0.282米1mol气体为什么在相同条件下,1摩尔固体?液体占有不相同的体积?而1摩尔不同气体所占的体积却大致相同呢?决定物体体积的大小有三个因素:
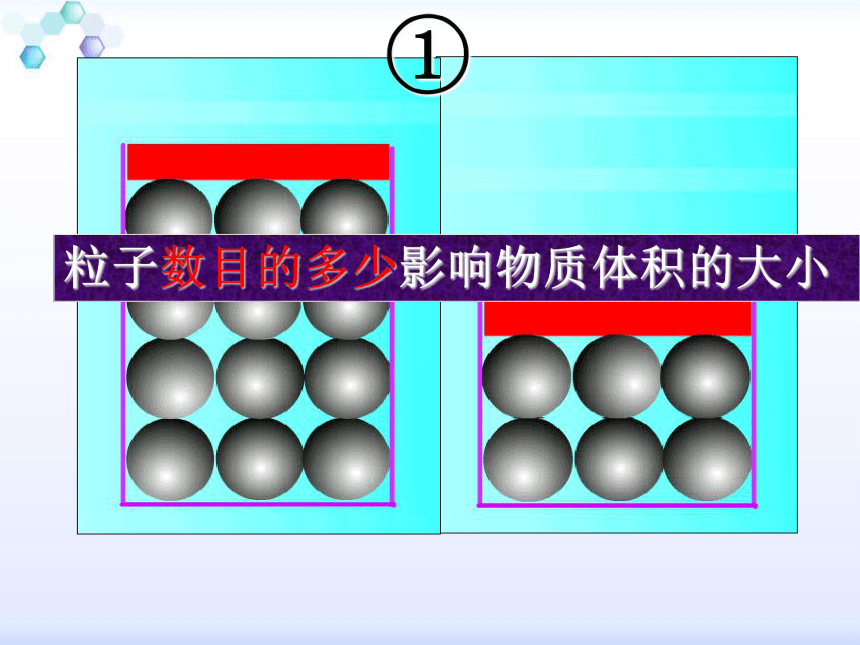
1、物质所含分子数(或原子数)的多少;
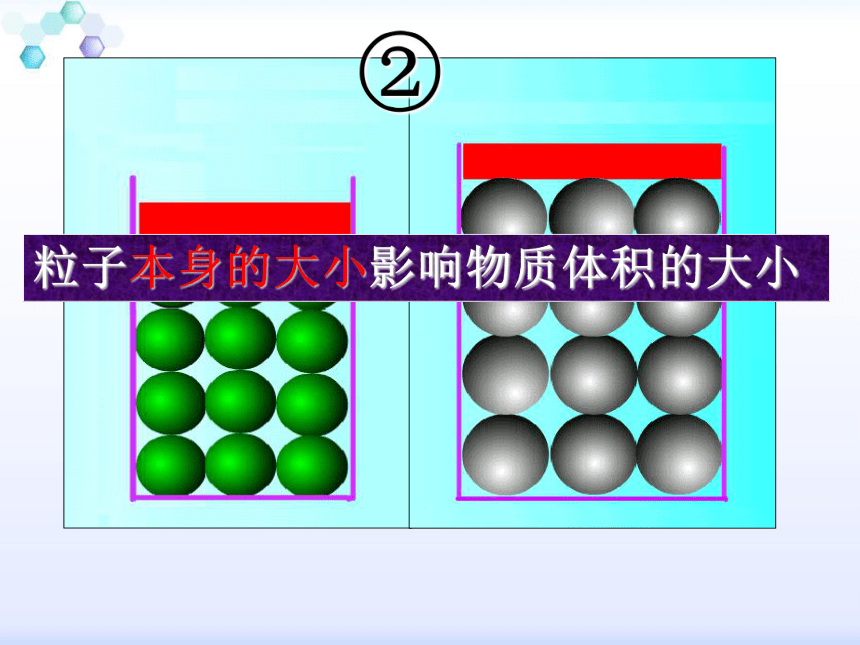
2、物质分子(或原子)本身的大小;
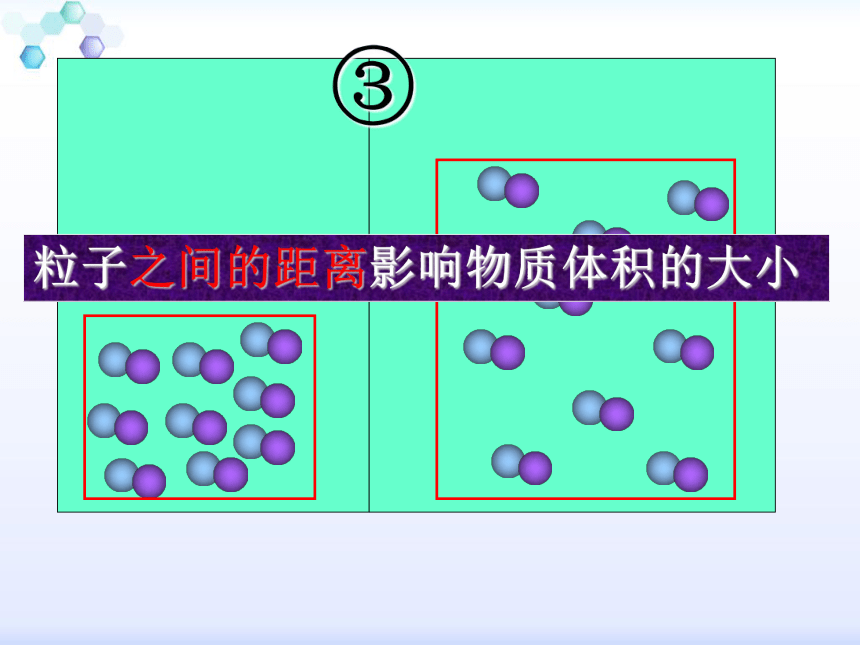
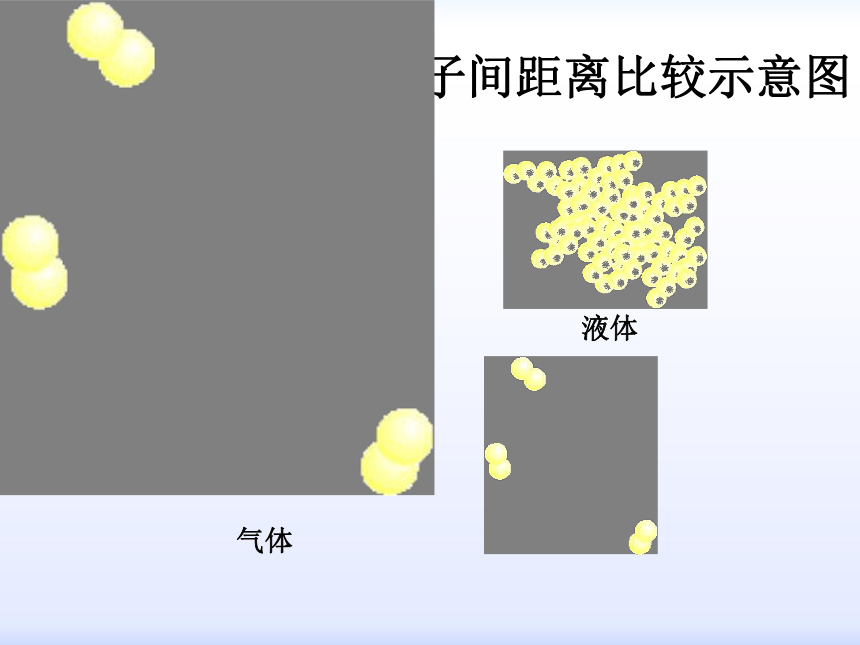
3、分子(或原子)间距离的大小?粒子数目的多少影响物质体积的大小粒子本身的大小影响物质体积的大小粒子之间的距离影响物质体积的大小固、液、气体的分子间距离比较示意图固体液体气体物质都是1mol,即含有相同的微粒数。因此,第1個影响因素不存在。
固体液体物质中,粒子紧密排列,粒子间的距离很小,故又消除了第3个因素的影响。
所以,固、液体的体积主要决定于其分子(或原子)的大小?不同的固、液体其分子(或原子)本身的大小是不相同的?所以,它们的摩尔体积是各不相同的?
相同数目的粒子紧密排列时,粒子本身的大小对物质的体积影响很大(比如固体)。大小
粒子之间距离很大时(比如气体),粒子本身的大小对物质的体积影响很小,几乎可以忽略。16个大粒子
的体积16个小粒子
的体积思考:气体分子间的距离和什么有关?气体体积的决定因素:
1、气体的分子数目
2、气体分子之间的距离往气球内加入二氧化碳气体,
气体分子数增多,体积增大。压强增大,气体分子间的平均距离减小。所以说,气体分子间的距离与温度和压强有关系,而在相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的。
所以,分子数目和分子间的平均距离确定,气体的体积也就确定。
因此,粒子数相同的的任何气体在相同条件下都具有相同的体积,也可以说在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。气体摩尔体积概念:单位物质的量的气体所占有的体积叫做气体摩尔体积。
符号:Vm
常用单位:L/mol和m3/molVm=V/n物质H2 2.016 0.0899
O2 32.00 1.429
CO2 44.01 1.963 摩尔质量(克/摩)密 度(克/升)体 积 (升)22.4
22.4
22.41mol气体物质0℃、一个大气压下不仅仅是这几种气体,大量的科学实验证明,其他气体也是如此,即物质的量为1mol,条件为0℃和101kPa时的体积都约为22.4L,通常我们又把温度0℃和压强101kPa的状况称为标准状况。气体摩尔体积 不是固定不变的,他决定于气体
所处的温度和压强。条件不同,Vm就可能不同。在标准状况下,1mol任何气体所占的体积都约是22.4L。使用气体摩尔体积注意以下四点1、 必须是气体(单一气体或者混合气体都可以)
2、 必须是1mol
3、 气体在不同状况下的摩尔体积是不一样的, 22.4L/mol是其在标准状况下的一个近似值
4、同温同压下,气体的体积只与气体的分子数目有关,而与气体分子的种类无关
液态水变成水蒸气,影响物质体积因素中,哪个变?哪个不变?思 考1、为什么标准状况下1mol任何气体的体积大致相同?
2、同温同压下,体积相同的气体的物质的量是否相同?所含的分子个数是否相同?思 考阿佛加德罗定律 气体的体积主要取决于气体所含的分子个数和分子间的距离,而与气体分子的种类无关,在一定的温度和压强下,分子间的平均距离是相等的,所以,同温同压下相同体积的气体含有相同数目的分子,因此,表示物质集体的物质的量也必然相等。阿伏加德罗定律:在相同的温度和压强下,
相同体积的任何气体都含有相同的分子数阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子?这就是阿伏加德罗定律?
阿伏加德罗定律适用于任何气体?同温、同压、同体积这三个“同”字是条件,分子数相同是结果,即“三同导一同”?“四同”缺一不可?
利用阿伏加德罗定律,我们可以得出下面几个重要的推论:阿伏加德罗定律推论
同温同压下,同体积的任何气体的质量比等于它们相对分子质量之比?
同温同压下,任何气体的体积比等于它们的物质的量之比?
同温同压下,质量相同的任何气体的体积比等于它们相对分子质量的反比?
同温同压下,任何气体的密度比等于它们相对分子质量之比?
同温同体积下,气体的压强比等于它們物质的量之比?
(ρ1: ρ2=M1:M2)(P1:P2=n1:n2)( V1:V2=M2:M1)(V1:V2=n1:n2)(m1:m2=M1:M2)阿伏加德罗定律的应用
阿佛加德罗定律用于化学方程式计算,有如下关系:
同温同压下,2H2O(气) ==2H2(气)+O2(气)
分子数之比: 2 : 2 : 1
摩尔数之比: 2 : 2 : 1
体积之比: 2 : 2 : 1电解关于气体摩尔体积的计算
例题1.在标准状况下,2.2克CO2体积是多少升?
〔分析〕在标准状况下,1摩尔任何奇迹的体积都约是22.4升?因此,我们需计算出2.2克CO2物质的量是多少摩尔便可?关于气体摩尔体积的计算
例题2.在标准状况下,测得0.25克一氧化碳的体积为200亳升,计算一氧化碳的相对分子质量 解:在标准状况下,一氧化碳的密度为:
ρ=
一氧化碳的摩尔质量为:
M=1.25g/L X 22.4L/mol=28g/mol
即一氧化碳的相对分子质量为28
答:一氧化碳的相对分子质量为28THE END.
(2)计算15℃,1标准大气压下1摩尔水?硫酸?蔗糖液各占有多大的体积?(水的密度为1.0g/cm3,硫酸的密度为1.811g/cm3,蔗糖液的密度为1.588g/cm3, 蔗糖的摩尔质量为342g/mol)
(3)在标准状况下,1摩尔氢气?氧气?二氧化碳气体的体积各是多少升?(氢气的密度为0.0899g/L,氧气的密度为1.429g/L,二氧化碳气体的密度为1.977g/L。) 小结:由上述计算可知,在相同条件下,1摩尔各种固体的体积是不相同的?小结:由上述计算可见,在相同条件下,各种液体的摩尔体积是不相同的。1 摩尔水 1摩尔硫酸 1摩尔蔗糖18克 98克 342克6.02×1023个硫酸分子6.02×1023个
蔗糖分子6.02×1023个水分子小结:由上述计算可见,1摩尔H2? O2 ?CO2气体在标准状况下的体积都约是22.4L。22.4升
(标准状况)6.02×1023个分子0.282米1mol气体为什么在相同条件下,1摩尔固体?液体占有不相同的体积?而1摩尔不同气体所占的体积却大致相同呢?决定物体体积的大小有三个因素:
1、物质所含分子数(或原子数)的多少;
2、物质分子(或原子)本身的大小;
3、分子(或原子)间距离的大小?粒子数目的多少影响物质体积的大小粒子本身的大小影响物质体积的大小粒子之间的距离影响物质体积的大小固、液、气体的分子间距离比较示意图固体液体气体物质都是1mol,即含有相同的微粒数。因此,第1個影响因素不存在。
固体液体物质中,粒子紧密排列,粒子间的距离很小,故又消除了第3个因素的影响。
所以,固、液体的体积主要决定于其分子(或原子)的大小?不同的固、液体其分子(或原子)本身的大小是不相同的?所以,它们的摩尔体积是各不相同的?
相同数目的粒子紧密排列时,粒子本身的大小对物质的体积影响很大(比如固体)。大小
粒子之间距离很大时(比如气体),粒子本身的大小对物质的体积影响很小,几乎可以忽略。16个大粒子
的体积16个小粒子
的体积思考:气体分子间的距离和什么有关?气体体积的决定因素:
1、气体的分子数目
2、气体分子之间的距离往气球内加入二氧化碳气体,
气体分子数增多,体积增大。压强增大,气体分子间的平均距离减小。所以说,气体分子间的距离与温度和压强有关系,而在相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的。
所以,分子数目和分子间的平均距离确定,气体的体积也就确定。
因此,粒子数相同的的任何气体在相同条件下都具有相同的体积,也可以说在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。气体摩尔体积概念:单位物质的量的气体所占有的体积叫做气体摩尔体积。
符号:Vm
常用单位:L/mol和m3/molVm=V/n物质H2 2.016 0.0899
O2 32.00 1.429
CO2 44.01 1.963 摩尔质量(克/摩)密 度(克/升)体 积 (升)22.4
22.4
22.41mol气体物质0℃、一个大气压下不仅仅是这几种气体,大量的科学实验证明,其他气体也是如此,即物质的量为1mol,条件为0℃和101kPa时的体积都约为22.4L,通常我们又把温度0℃和压强101kPa的状况称为标准状况。气体摩尔体积 不是固定不变的,他决定于气体
所处的温度和压强。条件不同,Vm就可能不同。在标准状况下,1mol任何气体所占的体积都约是22.4L。使用气体摩尔体积注意以下四点1、 必须是气体(单一气体或者混合气体都可以)
2、 必须是1mol
3、 气体在不同状况下的摩尔体积是不一样的, 22.4L/mol是其在标准状况下的一个近似值
4、同温同压下,气体的体积只与气体的分子数目有关,而与气体分子的种类无关
液态水变成水蒸气,影响物质体积因素中,哪个变?哪个不变?思 考1、为什么标准状况下1mol任何气体的体积大致相同?
2、同温同压下,体积相同的气体的物质的量是否相同?所含的分子个数是否相同?思 考阿佛加德罗定律 气体的体积主要取决于气体所含的分子个数和分子间的距离,而与气体分子的种类无关,在一定的温度和压强下,分子间的平均距离是相等的,所以,同温同压下相同体积的气体含有相同数目的分子,因此,表示物质集体的物质的量也必然相等。阿伏加德罗定律:在相同的温度和压强下,
相同体积的任何气体都含有相同的分子数阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子?这就是阿伏加德罗定律?
阿伏加德罗定律适用于任何气体?同温、同压、同体积这三个“同”字是条件,分子数相同是结果,即“三同导一同”?“四同”缺一不可?
利用阿伏加德罗定律,我们可以得出下面几个重要的推论:阿伏加德罗定律推论
同温同压下,同体积的任何气体的质量比等于它们相对分子质量之比?
同温同压下,任何气体的体积比等于它们的物质的量之比?
同温同压下,质量相同的任何气体的体积比等于它们相对分子质量的反比?
同温同压下,任何气体的密度比等于它们相对分子质量之比?
同温同体积下,气体的压强比等于它們物质的量之比?
(ρ1: ρ2=M1:M2)(P1:P2=n1:n2)( V1:V2=M2:M1)(V1:V2=n1:n2)(m1:m2=M1:M2)阿伏加德罗定律的应用
阿佛加德罗定律用于化学方程式计算,有如下关系:
同温同压下,2H2O(气) ==2H2(气)+O2(气)
分子数之比: 2 : 2 : 1
摩尔数之比: 2 : 2 : 1
体积之比: 2 : 2 : 1电解关于气体摩尔体积的计算
例题1.在标准状况下,2.2克CO2体积是多少升?
〔分析〕在标准状况下,1摩尔任何奇迹的体积都约是22.4升?因此,我们需计算出2.2克CO2物质的量是多少摩尔便可?关于气体摩尔体积的计算
例题2.在标准状况下,测得0.25克一氧化碳的体积为200亳升,计算一氧化碳的相对分子质量 解:在标准状况下,一氧化碳的密度为:
ρ=
一氧化碳的摩尔质量为:
M=1.25g/L X 22.4L/mol=28g/mol
即一氧化碳的相对分子质量为28
答:一氧化碳的相对分子质量为28THE END.
