苏教版 高中化学必修1 专题2第一单元 氯、溴、碘及其化合物——离 子 反 应(共29张PPT)
文档属性
| 名称 | 苏教版 高中化学必修1 专题2第一单元 氯、溴、碘及其化合物——离 子 反 应(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 218.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-30 21:34:59 | ||
图片预览






文档简介
课件29张PPT。离 子 反 应什么是电解质?什么是非电解质?电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物化合物电解质(NaCl 、H2SO4、 NaOH、Na2O )非电解质(酒精、蔗糖)酸、碱、盐及金属氧化物本质:在一定条件下自身是否能电离
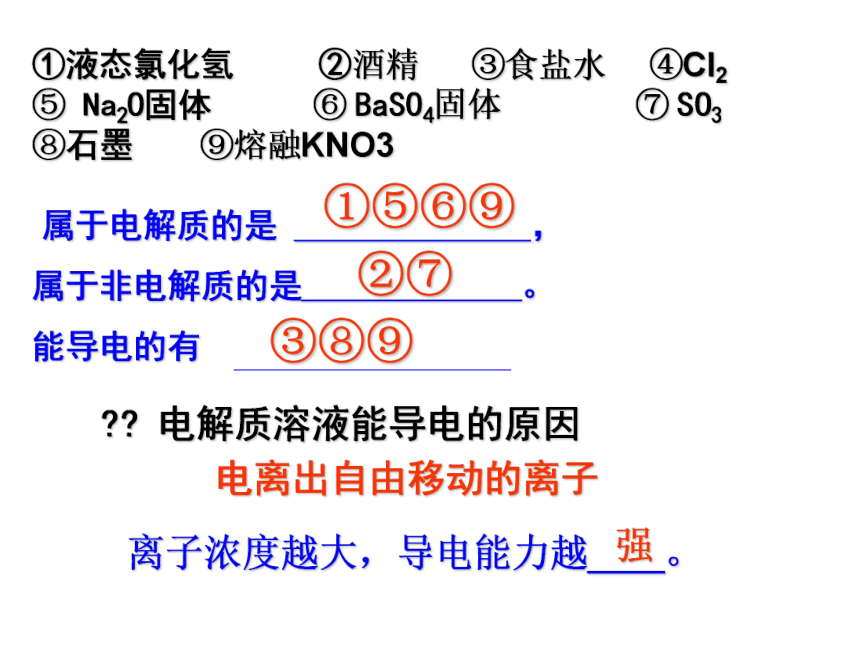
①液态氯化氢 ②酒精 ③食盐水 ④Cl2 ⑤ Na2O固体 ⑥ BaSO4固体 ⑦ SO3 ⑧石墨 ⑨熔融KNO3
属于电解质的是 ,
属于非电解质的是 。能导电的有
③⑧⑨
②⑦
①⑤⑥⑨
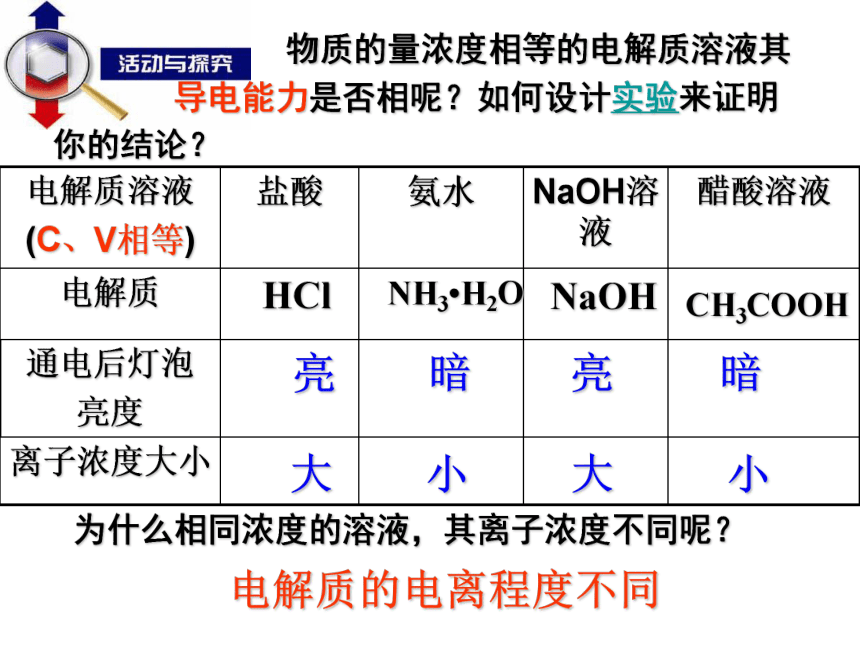
?? 电解质溶液能导电的原因 电离出自由移动的离子离子浓度越大,导电能力越____。强HClNH3?H2ONaOHCH3COOH亮亮暗暗大大小小 物质的量浓度相等的电解质溶液其
导电能力是否相呢?如何设计实验来证明
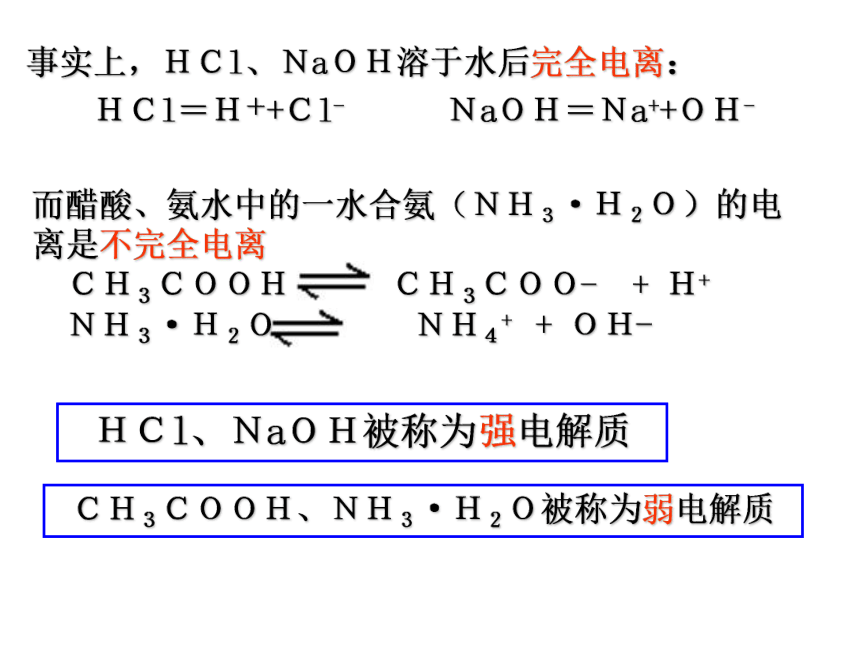
你的结论?为什么相同浓度的溶液,其离子浓度不同呢?电解质的电离程度不同事实上,HCl、NaOH溶于水后完全电离:
HCl=H++Cl- NaOH=Na++OH-HCl、NaOH被称为强电解质CH3COOH、NH3·H2O被称为弱电解质1、强电解质:在水溶液里完全电离成离子的
电解质。比如:强酸、强碱、
大多数盐。一、强电解质和弱电解质2、弱电解质:在水溶液里部分电离成离子的
电解质。比如:弱酸、弱碱、
水。与溶解度无关常见的强电解质(1)强酸:(2)强碱:(3)大部分盐: 如NaCl等,包括部分难溶性的盐
CaCO3、BaSO4、AgCl等 如HCl、H2SO4、HNO3、HClO4、 HBr、HI等如NaOH、KOH、Ba(OH)2等(4)活泼金属氧化物: Na2O
(1)弱酸:如 CH3COOH、H2CO3、H2SiO3、 H3PO4、HNO2、H2S、H2SO3、HF、HClO等(2)弱碱:
(3)两性氢氧化物:Al(OH)3
(4)水、极少数盐(醋酸铅)等常见的弱电解质如NH3.H2O、Cu(OH)2、Fe(OH)3等3、电离方程式:D书写下列物质的电离方程式
HClO,Cu(OH)2、NaHSO4 、NaHCO3“=”在Na2CO3的性质实验中,我们观察了Na2CO3溶液分别与澄清石灰水和CaCl2溶液反应的现象,上述的实质是否相同?本质:都是CO32-和Ca2+之间的反应这两个反应的实质我们都可以用
Ca2+ + CO32- = CaCO3↓表示,像这种式子称为离子方程式.
二、离子反应:
把有离子参加或离子生成的化学反应称为离子反应。
1、离子方程式
用实际参加反应的离子符号来表示离子
反应的式子叫离子方程式。②离子方程式的书写步骤:(以碳酸钠与盐酸反应为例)①可溶性的强电解质(强酸、强碱、可溶盐)写成离子形式
②沉淀、气体、难电离的物质、单质、氧化物写成化学式
(不拆)
③Ca(OH)2, 石灰水:拆;
石灰乳:不拆
注意点:拆A.难溶物质:BaSO4、Cu(OH)2等
B.难电离物质:弱酸、弱碱、水等
C.气体:CO2、H2S、SO2等 D.单质:H2、Na、I2等
E.氧化物:Na2O、 Na2O2 、 Fe2O3等小结:“写、拆、删、查”如:Fe2++Cl2=Fe3++2Cl-应当改为:2Fe2++Cl2=2Fe3++2Cl-2.固体与浓硫酸反应,无离子方程式注意事项:1.固体间的反应一般不写离子反应方程式;3反应中的微溶物:反应物处于溶液中时写成离子形式,处于浊液或者固体时写成化学式。生成物中的微溶物一律写化学式。某些酸式盐的酸根:
在这些酸根中只有 可以写成 和 ,其它多元弱酸(或中强酸)的酸根一律不能拆。5.有酸式盐参加的某些反应。4.反应物的量不同,离子方程式也会不同离子方程式的书写:⑴ Cl2+ NaOH ⑵ Fe+H2SO4
⑶ Na+H2O ⑷ Fe3O2+H2SO4
⑸ H2SO4+Ba(OH)2 ⑹ CaCO3+HCl
⑺ NaHCO3+NaOH ⑻ 电解食盐水例题:下列离子方程式书写正确的是( )
A.碳酸钡与稀硫酸反应
CO32-+2H+=CO2↑+H2O
B.硫酸和氢氧化钡溶液反应
Ba2+ + SO42- = BaSO4↓
C.澄清石灰水和少量二氧化碳反应
Ca2+ + 2OH- + CO2 = CaCO3↓+ H2O
D.铁钉放入硫酸铜溶液中
Fe + 3Cu2+ =Fe3+ + 3Cu判断依据:(1)是否符合客观事实(2)改写是否正确(3)方程式是否配平了(原子守恒、电荷守恒)(4)是否漏写条件C下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2: B.醋酸和氢氧化钠溶液反应: C.铜和氯化铁溶液反应:D.氢氧化铁和盐酸反应:B1.盐酸与氢氧化钠溶液反应H++OH-=H2O2.硫酸与氢氧化钠溶液反应H++OH-=H2O化学方程式表示的是某一个特定的化学反应,而离子方程式表示同一类化学反应.P55问题解决3. HNO3+Ba(OH)2H++OH-=H2O三、离子方程式的意义化学方程式表示的是某一特定的化学反应。而离子方
程式不仅表示一定物质间的某一个反应,而且表示所
有同一类的反应,揭示了反应的实质。例如: 这一离子方程式只能表示强酸和强碱生成可溶性盐和水的这一类中和反应。下列反应中,其离子方程式可以用表示的是( )
A.氢氧化钡溶液与硫酸反应
B.氢氧化铜与稀硝酸反应
C.氢氧化钙溶液与盐酸反应
D.二氧化碳通入澄清石灰水中C 离子在溶液中能否大量共存的关键就是看离子间是否符合离反应发生的条件,若反应则不能大量共存。
1.看离子间能否发生复分解反应
(1)离子间能否生成难溶物。需熟练记住常见物质的溶解性表。
(2)离子间能否反应生成挥发性的物质(气体)。四、离子共存问题3)离子间能否反应生成难电离的物质(弱酸、弱碱或水等)。
2.看离子间能否发生氧化还原反应而大量共存 。
1.下列各组中的离子,能够大量共存于同一溶液中的是( )2.下列各组离子,在强碱性溶液中可以大量共存的是( )DB3、某无色溶液在滴加石蕊试液时呈红色,在此溶液中能大量共存的离子组是 ( )D
4、在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 ( )C5.某无色透明的溶液中可能含有 3 附加隐含条件的应用规律:⑴溶液无色透明时,则溶液中一定没有有色离子。常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等⑵强碱性溶液中肯定不存在与OH-反应的离子。⑶强酸性溶液中肯定不存在与H+反应的离子。
①液态氯化氢 ②酒精 ③食盐水 ④Cl2 ⑤ Na2O固体 ⑥ BaSO4固体 ⑦ SO3 ⑧石墨 ⑨熔融KNO3
属于电解质的是 ,
属于非电解质的是 。能导电的有
③⑧⑨
②⑦
①⑤⑥⑨
?? 电解质溶液能导电的原因 电离出自由移动的离子离子浓度越大,导电能力越____。强HClNH3?H2ONaOHCH3COOH亮亮暗暗大大小小 物质的量浓度相等的电解质溶液其
导电能力是否相呢?如何设计实验来证明
你的结论?为什么相同浓度的溶液,其离子浓度不同呢?电解质的电离程度不同事实上,HCl、NaOH溶于水后完全电离:
HCl=H++Cl- NaOH=Na++OH-HCl、NaOH被称为强电解质CH3COOH、NH3·H2O被称为弱电解质1、强电解质:在水溶液里完全电离成离子的
电解质。比如:强酸、强碱、
大多数盐。一、强电解质和弱电解质2、弱电解质:在水溶液里部分电离成离子的
电解质。比如:弱酸、弱碱、
水。与溶解度无关常见的强电解质(1)强酸:(2)强碱:(3)大部分盐: 如NaCl等,包括部分难溶性的盐
CaCO3、BaSO4、AgCl等 如HCl、H2SO4、HNO3、HClO4、 HBr、HI等如NaOH、KOH、Ba(OH)2等(4)活泼金属氧化物: Na2O
(1)弱酸:如 CH3COOH、H2CO3、H2SiO3、 H3PO4、HNO2、H2S、H2SO3、HF、HClO等(2)弱碱:
(3)两性氢氧化物:Al(OH)3
(4)水、极少数盐(醋酸铅)等常见的弱电解质如NH3.H2O、Cu(OH)2、Fe(OH)3等3、电离方程式:D书写下列物质的电离方程式
HClO,Cu(OH)2、NaHSO4 、NaHCO3“=”在Na2CO3的性质实验中,我们观察了Na2CO3溶液分别与澄清石灰水和CaCl2溶液反应的现象,上述的实质是否相同?本质:都是CO32-和Ca2+之间的反应这两个反应的实质我们都可以用
Ca2+ + CO32- = CaCO3↓表示,像这种式子称为离子方程式.
二、离子反应:
把有离子参加或离子生成的化学反应称为离子反应。
1、离子方程式
用实际参加反应的离子符号来表示离子
反应的式子叫离子方程式。②离子方程式的书写步骤:(以碳酸钠与盐酸反应为例)①可溶性的强电解质(强酸、强碱、可溶盐)写成离子形式
②沉淀、气体、难电离的物质、单质、氧化物写成化学式
(不拆)
③Ca(OH)2, 石灰水:拆;
石灰乳:不拆
注意点:拆A.难溶物质:BaSO4、Cu(OH)2等
B.难电离物质:弱酸、弱碱、水等
C.气体:CO2、H2S、SO2等 D.单质:H2、Na、I2等
E.氧化物:Na2O、 Na2O2 、 Fe2O3等小结:“写、拆、删、查”如:Fe2++Cl2=Fe3++2Cl-应当改为:2Fe2++Cl2=2Fe3++2Cl-2.固体与浓硫酸反应,无离子方程式注意事项:1.固体间的反应一般不写离子反应方程式;3反应中的微溶物:反应物处于溶液中时写成离子形式,处于浊液或者固体时写成化学式。生成物中的微溶物一律写化学式。某些酸式盐的酸根:
在这些酸根中只有 可以写成 和 ,其它多元弱酸(或中强酸)的酸根一律不能拆。5.有酸式盐参加的某些反应。4.反应物的量不同,离子方程式也会不同离子方程式的书写:⑴ Cl2+ NaOH ⑵ Fe+H2SO4
⑶ Na+H2O ⑷ Fe3O2+H2SO4
⑸ H2SO4+Ba(OH)2 ⑹ CaCO3+HCl
⑺ NaHCO3+NaOH ⑻ 电解食盐水例题:下列离子方程式书写正确的是( )
A.碳酸钡与稀硫酸反应
CO32-+2H+=CO2↑+H2O
B.硫酸和氢氧化钡溶液反应
Ba2+ + SO42- = BaSO4↓
C.澄清石灰水和少量二氧化碳反应
Ca2+ + 2OH- + CO2 = CaCO3↓+ H2O
D.铁钉放入硫酸铜溶液中
Fe + 3Cu2+ =Fe3+ + 3Cu判断依据:(1)是否符合客观事实(2)改写是否正确(3)方程式是否配平了(原子守恒、电荷守恒)(4)是否漏写条件C下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2: B.醋酸和氢氧化钠溶液反应: C.铜和氯化铁溶液反应:D.氢氧化铁和盐酸反应:B1.盐酸与氢氧化钠溶液反应H++OH-=H2O2.硫酸与氢氧化钠溶液反应H++OH-=H2O化学方程式表示的是某一个特定的化学反应,而离子方程式表示同一类化学反应.P55问题解决3. HNO3+Ba(OH)2H++OH-=H2O三、离子方程式的意义化学方程式表示的是某一特定的化学反应。而离子方
程式不仅表示一定物质间的某一个反应,而且表示所
有同一类的反应,揭示了反应的实质。例如: 这一离子方程式只能表示强酸和强碱生成可溶性盐和水的这一类中和反应。下列反应中,其离子方程式可以用表示的是( )
A.氢氧化钡溶液与硫酸反应
B.氢氧化铜与稀硝酸反应
C.氢氧化钙溶液与盐酸反应
D.二氧化碳通入澄清石灰水中C 离子在溶液中能否大量共存的关键就是看离子间是否符合离反应发生的条件,若反应则不能大量共存。
1.看离子间能否发生复分解反应
(1)离子间能否生成难溶物。需熟练记住常见物质的溶解性表。
(2)离子间能否反应生成挥发性的物质(气体)。四、离子共存问题3)离子间能否反应生成难电离的物质(弱酸、弱碱或水等)。
2.看离子间能否发生氧化还原反应而大量共存 。
1.下列各组中的离子,能够大量共存于同一溶液中的是( )2.下列各组离子,在强碱性溶液中可以大量共存的是( )DB3、某无色溶液在滴加石蕊试液时呈红色,在此溶液中能大量共存的离子组是 ( )D
4、在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 ( )C5.某无色透明的溶液中可能含有 3 附加隐含条件的应用规律:⑴溶液无色透明时,则溶液中一定没有有色离子。常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等⑵强碱性溶液中肯定不存在与OH-反应的离子。⑶强酸性溶液中肯定不存在与H+反应的离子。
