2018-2019学年人教版必修1 第1章第1节 化学实验基本方法 课件(40张)
文档属性
| 名称 | 2018-2019学年人教版必修1 第1章第1节 化学实验基本方法 课件(40张) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-09-03 00:00:00 | ||
图片预览









文档简介
课件39张PPT。第一章 从实验学化学第一节
化学实验基本方法生活的必需品----食盐,在实验室中是如何提纯的呢?粗盐提纯粗盐提纯实验中应用到哪些仪器_________________,
(1)称量
仪器:镊子,托盘天平(左物右码)
量筒,移液管 1.下列实验目的能够实现的()
A 用托盘天平称取5.23gNaCl固体
B 用50ml的量筒量取30.12ml的水
C 向小试管中加入100ml的稀盐酸
D 用滴管取约1ml的溶液
2.某学生欲称取5.5g的食盐晶体,但在实验时将食盐晶体和砝码放反了,则该同学实际称的食盐晶体有()(1g以下用砝码)
A 6.5g B 6g C 4.5g D 5.5gDc粗盐提纯2.溶解
仪器:烧杯,玻璃棒
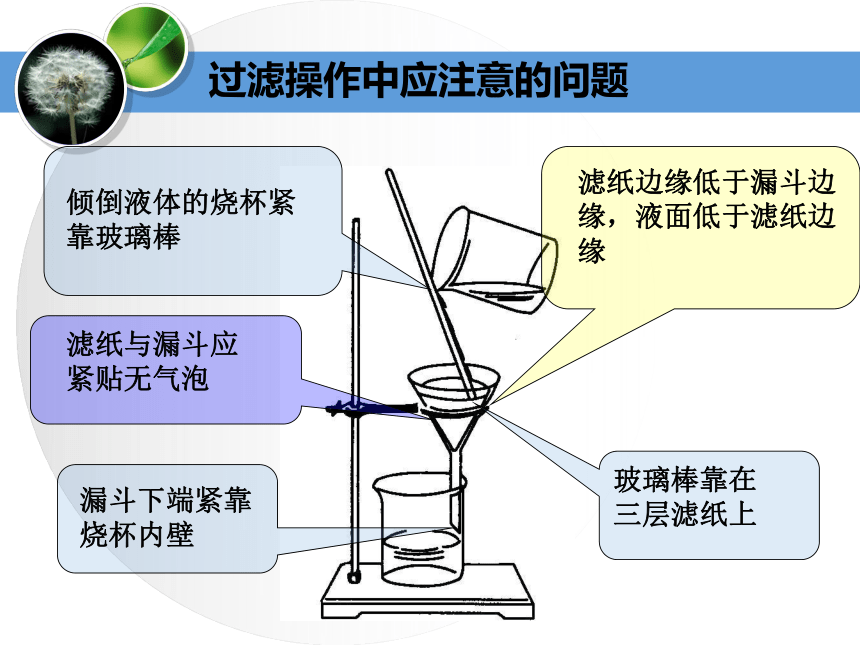
3.过滤①过滤的目的(适用范围)是什么?
②过滤的原理是什么?
③过滤操作需要哪些仪器?
④进行过滤操作时要注意哪些问题?(一贴、二低、三靠)滤纸与漏斗应
紧贴无气泡 滤纸边缘低于漏斗边缘,液面低于滤纸边缘 玻璃棒靠在
三层滤纸上 漏斗下端紧靠
烧杯内壁 倾倒液体的烧杯紧靠玻璃棒过滤操作中应注意的问题*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液 因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,应停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
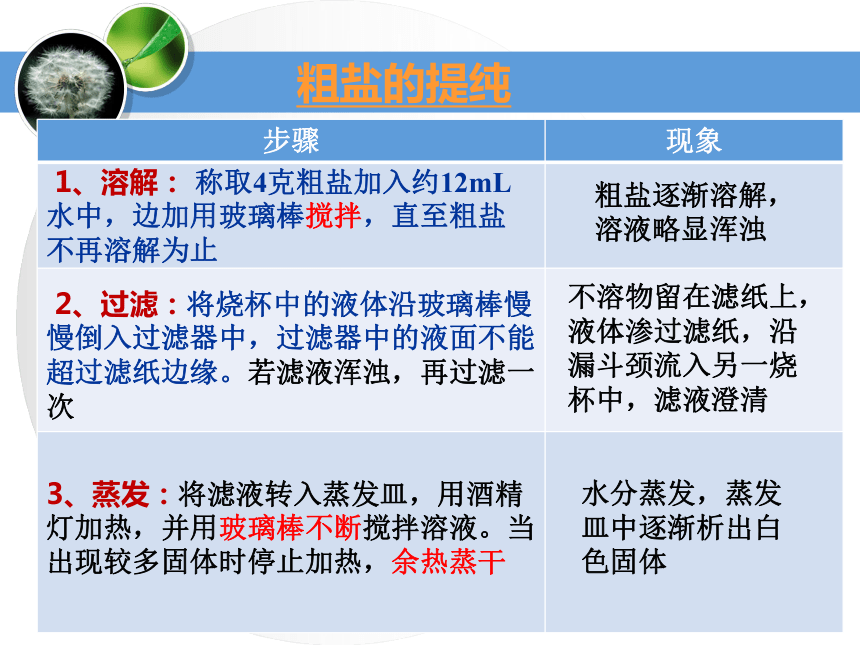
粗盐提纯分离溶于溶剂中的固体溶质4.蒸发
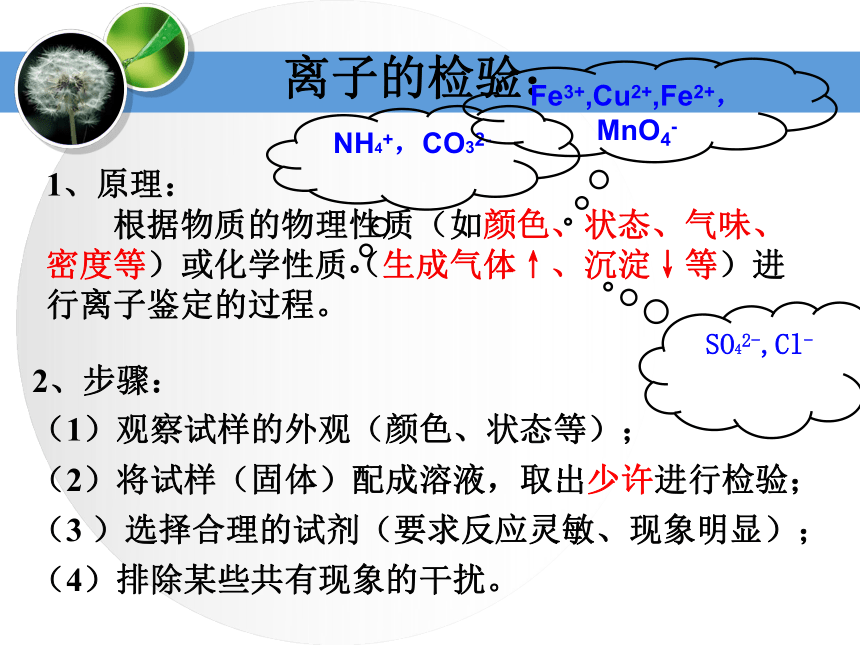
仪器:粗盐的提纯粗盐逐渐溶解,溶液略显浑浊 2、过滤:将烧杯中的液体沿玻璃棒慢慢倒入过滤器中,过滤器中的液面不能超过滤纸边缘。若滤液浑浊,再过滤一次不溶物留在滤纸上,液体渗过滤纸,沿漏斗颈流入另一烧杯中,滤液澄清3、蒸发:将滤液转入蒸发皿,用酒精灯加热,并用玻璃棒不断搅拌溶液。当出现较多固体时停止加热,余热蒸干 1、溶解: 称取4克粗盐加入约12mL水中,边加用玻璃棒搅拌,直至粗盐不再溶解为止 水分蒸发,蒸发皿中逐渐析出白色固体粗盐的提纯粗盐溶解悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)过滤不溶性杂质NaCl、MgCl2、CaCl2、硫酸盐的溶液蒸发NaCl、MgCl2、CaCl2、硫酸盐的晶体离子的检验:1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等)进行离子鉴定的过程。2、步骤:
(1)观察试样的外观(颜色、状态等);
(2)将试样(固体)配成溶液,取出少许进行检验;
(3 )选择合理的试剂(要求反应灵敏、现象明显);
(4)排除某些共有现象的干扰。NH4+,CO32-Fe3+,Cu2+,Fe2+,
MnO4-SO42-,Cl-SO42-的检验方法: 操作:先加入稀盐酸酸化,再加入可溶性
钡盐(BaCl2)溶液。现象:出现不溶于稀酸的白色沉淀
(BaSO4)。结论:存在SO42- 。 注意排除CO32-等离子的干扰!CO32-的检验方法: 操作:加入稀HCl,将产生的无色无味的气体通入澄清石灰水现象:澄清石灰水变浑浊结论:存在CO32 -(?)牛刀小试C如何除去NaCl的杂质对于NaCl要除去可溶杂质离子是:选择要加入的除杂试剂:引入了新的离子:CO3 2-OH -Ba 2+1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸必须适量,加盐酸前必须过滤过滤过滤过滤化学除杂除杂原则:
*不增(尽量不引入新杂质)
*不减(尽量不损耗被提纯的物质)
*易分离(生成完全不溶物或气体)
*易复原(除去各种杂质,还原到目标产物)注意:除杂试剂要适当过量;过量试剂必须除去,除杂途径要最佳(试剂的先后顺序)!牛刀小试提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为()A 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B 加入过量硫酸钾溶液,过滤,除去沉淀,溶液补加适量硝酸
C 加入过量硫酸钾溶液,过滤,除去沉淀,溶液补加适量硝酸
D 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸2、蒸馏和萃取制取蒸馏水蒸馏1、原理:利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再冷凝成液体,从而达到分离提纯的目的混合物A沸点A>BB先被蒸出来蒸馏进水口出水口注意事项4.烧瓶底加垫石棉网1.温度计水银球处于蒸馏烧瓶支管口处2.冷凝水,下口进,上口出3.投放沸石或瓷片防暴沸加入硝酸银后,有不溶
于稀硝酸的沉淀生成烧瓶中水温升高至
100℃后沸腾,锥形
瓶中收集到蒸馏水加稀硝酸和硝酸银溶液后,蒸馏水中无沉淀自来水中有Cl-,蒸馏水中无Cl-,
通过蒸馏可以除去水中的Cl-实验1-3 制取蒸馏水海水淡化蒸馏法酒精和水的混合物能否用蒸馏法分离?符合蒸馏的条件:液体混合物——酒精与水以任意比互溶各组分沸点不同——酒精78 ℃,水100 ℃油和水可以用蒸馏法分离吗?沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!低高分液萃取萃取萃取利用混合物中一种溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它于另一溶剂组成的溶液中提取出来,这种方法叫萃取溶剂A溶剂B溶解度B>A 量取10mL碘的饱和水溶液,倒入分液漏斗, 注入4mL CCl4, 盖好玻璃塞。CCl4不溶于水,在下层 用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡。用力振荡的目的是
使水与CCl4充分混合将分液漏斗放在铁架台上,
静置。静置后,CCl4层变紫色,
水层黄色变浅(4)液体分层后, 将分液漏斗上的玻璃塞打开, 分液漏斗下面活塞拧开,从下端口放出下层溶液,从上端口倒出上层溶液。实验1-4 用CCl4萃取碘水的碘实验结论:CCl4比水重,不溶于水,碘在CCl4中溶解度比水大振荡萃取静止分层分液注意:
1、分液漏斗使用前必须检查上口玻璃塞和活塞是否漏水
2、右手掌顶住玻璃塞,左手握住活塞,倒置上下振荡
3、分液时打开活塞,下层下口放出,上层上口倒出
4、为了萃取充分,可多次萃取实验1—4思考以下问题观察实验,实验现象说明CCl4的密度比水大还是小分液结束后,分液漏斗的上层液体应如何取出分液时,为什么要打开上口塞子,或者是使塞子上的凹槽对准瓶口的小孔呢?将CCl4换成酒精可以吗?苯、汽油呢? 萃取之后用何方法将有机溶剂与溶质进一步分离开来?观察实验,实验现象说明CCl4的密度比水大还是小一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水将CCl4换成酒精可以吗?苯、汽油呢? 萃取剂的选择条件:
1、萃取剂与原溶剂不混溶、不反应
如CCl4(比水重)、苯(比水轻)、汽 油(比水轻)。
2、溶质在萃取剂中有较大的溶解度
如碘易溶于有机溶剂而不易溶于水。
3、溶质不与萃取剂发生任何反应小结:物质分离和提纯的方法(物理方法)从液体中分离出不溶的固体物质从溶液中分离出可溶固体溶质从互溶的液态混合物中分离出沸点较低的物质用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来漏斗 烧杯 玻璃棒 铁架台(铁圈)蒸发皿 玻璃棒 酒精灯 铁架台(铁圈)分液漏斗 烧杯铁架台(铁圈)蒸馏烧瓶 温度计冷凝管 尾接管锥形瓶 铁架台 酒精灯石棉网一贴 二低 三靠边加热边搅拌用余热蒸干少量溶液温度计水银球位置;冷凝水从下往上流与蒸气成逆流检查分液漏斗是否漏液;分别从分液漏斗上、下口分离两层液体化学实验基本方法2实验安全及事故处理 进行化学实验必须注意安全,下列说法不正确的是()A 不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B 不慎将浓碱沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C 熄灭酒精灯时,不要用嘴吹,必须用灯帽盖灭
D 电器着火,可以用泡沫灭火器灭火D酸(碱)流桌,中和抹
酸(碱)滴桌,抹布抹
酸(碱)沾肤,冲后涂
酸入眼,洗眨眼,不可揉,送医院
(碳酸氢钠,稀醋酸,硼酸)
化学实验安全操作DA物质的保存DABD固体置于广口瓶,液体置于细口瓶,酸用玻璃塞,碱用橡皮塞,棕色瓶中见光易分解(硝酸,固碘,氯水溴水,硝酸银)标志的认识D
化学实验基本方法生活的必需品----食盐,在实验室中是如何提纯的呢?粗盐提纯粗盐提纯实验中应用到哪些仪器_________________,
(1)称量
仪器:镊子,托盘天平(左物右码)
量筒,移液管 1.下列实验目的能够实现的()
A 用托盘天平称取5.23gNaCl固体
B 用50ml的量筒量取30.12ml的水
C 向小试管中加入100ml的稀盐酸
D 用滴管取约1ml的溶液
2.某学生欲称取5.5g的食盐晶体,但在实验时将食盐晶体和砝码放反了,则该同学实际称的食盐晶体有()(1g以下用砝码)
A 6.5g B 6g C 4.5g D 5.5gDc粗盐提纯2.溶解
仪器:烧杯,玻璃棒
3.过滤①过滤的目的(适用范围)是什么?
②过滤的原理是什么?
③过滤操作需要哪些仪器?
④进行过滤操作时要注意哪些问题?(一贴、二低、三靠)滤纸与漏斗应
紧贴无气泡 滤纸边缘低于漏斗边缘,液面低于滤纸边缘 玻璃棒靠在
三层滤纸上 漏斗下端紧靠
烧杯内壁 倾倒液体的烧杯紧靠玻璃棒过滤操作中应注意的问题*加入的液体不超过蒸发皿容积的2/3。
*蒸发过程中要用玻棒不断搅拌(以防溶液 因局部过热而造成液滴飞溅)。
*加热至剩余少量液体时,应停止加热,利用余温使滤液蒸干。
*热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
粗盐提纯分离溶于溶剂中的固体溶质4.蒸发
仪器:粗盐的提纯粗盐逐渐溶解,溶液略显浑浊 2、过滤:将烧杯中的液体沿玻璃棒慢慢倒入过滤器中,过滤器中的液面不能超过滤纸边缘。若滤液浑浊,再过滤一次不溶物留在滤纸上,液体渗过滤纸,沿漏斗颈流入另一烧杯中,滤液澄清3、蒸发:将滤液转入蒸发皿,用酒精灯加热,并用玻璃棒不断搅拌溶液。当出现较多固体时停止加热,余热蒸干 1、溶解: 称取4克粗盐加入约12mL水中,边加用玻璃棒搅拌,直至粗盐不再溶解为止 水分蒸发,蒸发皿中逐渐析出白色固体粗盐的提纯粗盐溶解悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)过滤不溶性杂质NaCl、MgCl2、CaCl2、硫酸盐的溶液蒸发NaCl、MgCl2、CaCl2、硫酸盐的晶体离子的检验:1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等)进行离子鉴定的过程。2、步骤:
(1)观察试样的外观(颜色、状态等);
(2)将试样(固体)配成溶液,取出少许进行检验;
(3 )选择合理的试剂(要求反应灵敏、现象明显);
(4)排除某些共有现象的干扰。NH4+,CO32-Fe3+,Cu2+,Fe2+,
MnO4-SO42-,Cl-SO42-的检验方法: 操作:先加入稀盐酸酸化,再加入可溶性
钡盐(BaCl2)溶液。现象:出现不溶于稀酸的白色沉淀
(BaSO4)。结论:存在SO42- 。 注意排除CO32-等离子的干扰!CO32-的检验方法: 操作:加入稀HCl,将产生的无色无味的气体通入澄清石灰水现象:澄清石灰水变浑浊结论:存在CO32 -(?)牛刀小试C如何除去NaCl的杂质对于NaCl要除去可溶杂质离子是:选择要加入的除杂试剂:引入了新的离子:CO3 2-OH -Ba 2+1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸必须适量,加盐酸前必须过滤过滤过滤过滤化学除杂除杂原则:
*不增(尽量不引入新杂质)
*不减(尽量不损耗被提纯的物质)
*易分离(生成完全不溶物或气体)
*易复原(除去各种杂质,还原到目标产物)注意:除杂试剂要适当过量;过量试剂必须除去,除杂途径要最佳(试剂的先后顺序)!牛刀小试提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为()A 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B 加入过量硫酸钾溶液,过滤,除去沉淀,溶液补加适量硝酸
C 加入过量硫酸钾溶液,过滤,除去沉淀,溶液补加适量硝酸
D 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸2、蒸馏和萃取制取蒸馏水蒸馏1、原理:利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再冷凝成液体,从而达到分离提纯的目的混合物A沸点A>BB先被蒸出来蒸馏进水口出水口注意事项4.烧瓶底加垫石棉网1.温度计水银球处于蒸馏烧瓶支管口处2.冷凝水,下口进,上口出3.投放沸石或瓷片防暴沸加入硝酸银后,有不溶
于稀硝酸的沉淀生成烧瓶中水温升高至
100℃后沸腾,锥形
瓶中收集到蒸馏水加稀硝酸和硝酸银溶液后,蒸馏水中无沉淀自来水中有Cl-,蒸馏水中无Cl-,
通过蒸馏可以除去水中的Cl-实验1-3 制取蒸馏水海水淡化蒸馏法酒精和水的混合物能否用蒸馏法分离?符合蒸馏的条件:液体混合物——酒精与水以任意比互溶各组分沸点不同——酒精78 ℃,水100 ℃油和水可以用蒸馏法分离吗?沸点( )的组分先蒸出,加热温度不能
超过混合物中沸点( )的物质的沸点!低高分液萃取萃取萃取利用混合物中一种溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它于另一溶剂组成的溶液中提取出来,这种方法叫萃取溶剂A溶剂B溶解度B>A 量取10mL碘的饱和水溶液,倒入分液漏斗, 注入4mL CCl4, 盖好玻璃塞。CCl4不溶于水,在下层 用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡。用力振荡的目的是
使水与CCl4充分混合将分液漏斗放在铁架台上,
静置。静置后,CCl4层变紫色,
水层黄色变浅(4)液体分层后, 将分液漏斗上的玻璃塞打开, 分液漏斗下面活塞拧开,从下端口放出下层溶液,从上端口倒出上层溶液。实验1-4 用CCl4萃取碘水的碘实验结论:CCl4比水重,不溶于水,碘在CCl4中溶解度比水大振荡萃取静止分层分液注意:
1、分液漏斗使用前必须检查上口玻璃塞和活塞是否漏水
2、右手掌顶住玻璃塞,左手握住活塞,倒置上下振荡
3、分液时打开活塞,下层下口放出,上层上口倒出
4、为了萃取充分,可多次萃取实验1—4思考以下问题观察实验,实验现象说明CCl4的密度比水大还是小分液结束后,分液漏斗的上层液体应如何取出分液时,为什么要打开上口塞子,或者是使塞子上的凹槽对准瓶口的小孔呢?将CCl4换成酒精可以吗?苯、汽油呢? 萃取之后用何方法将有机溶剂与溶质进一步分离开来?观察实验,实验现象说明CCl4的密度比水大还是小一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水将CCl4换成酒精可以吗?苯、汽油呢? 萃取剂的选择条件:
1、萃取剂与原溶剂不混溶、不反应
如CCl4(比水重)、苯(比水轻)、汽 油(比水轻)。
2、溶质在萃取剂中有较大的溶解度
如碘易溶于有机溶剂而不易溶于水。
3、溶质不与萃取剂发生任何反应小结:物质分离和提纯的方法(物理方法)从液体中分离出不溶的固体物质从溶液中分离出可溶固体溶质从互溶的液态混合物中分离出沸点较低的物质用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来漏斗 烧杯 玻璃棒 铁架台(铁圈)蒸发皿 玻璃棒 酒精灯 铁架台(铁圈)分液漏斗 烧杯铁架台(铁圈)蒸馏烧瓶 温度计冷凝管 尾接管锥形瓶 铁架台 酒精灯石棉网一贴 二低 三靠边加热边搅拌用余热蒸干少量溶液温度计水银球位置;冷凝水从下往上流与蒸气成逆流检查分液漏斗是否漏液;分别从分液漏斗上、下口分离两层液体化学实验基本方法2实验安全及事故处理 进行化学实验必须注意安全,下列说法不正确的是()A 不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B 不慎将浓碱沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C 熄灭酒精灯时,不要用嘴吹,必须用灯帽盖灭
D 电器着火,可以用泡沫灭火器灭火D酸(碱)流桌,中和抹
酸(碱)滴桌,抹布抹
酸(碱)沾肤,冲后涂
酸入眼,洗眨眼,不可揉,送医院
(碳酸氢钠,稀醋酸,硼酸)
化学实验安全操作DA物质的保存DABD固体置于广口瓶,液体置于细口瓶,酸用玻璃塞,碱用橡皮塞,棕色瓶中见光易分解(硝酸,固碘,氯水溴水,硝酸银)标志的认识D
