2018学年高中物理第2章气体理想气体的状态方程学案教科版选修3_3
文档属性
| 名称 | 2018学年高中物理第2章气体理想气体的状态方程学案教科版选修3_3 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 教科版 | ||
| 科目 | 物理 | ||
| 更新时间 | 2018-09-05 00:00:00 | ||
图片预览




文档简介
理想气体的状态方程
【学习目标】
1.知道什么是理想气体,理想气体分子的运动特点,气体压强产生的原因;
2.掌握理想气体的状态方程,知道理想气体状态方程的推出过程;
3.学会建立物理模型的研究方法;
4.利用理想气体的状态方程分析解决实际问题。
5.利用图象形象直观地表示气体状态及状态的变化.
6.学会利用图象和气体实验定律分析气体的状态变化。
7.在掌握图象的特点的基础上利用图象解决实际问题.
8.进一步明确图象上的一个点表示一定质量的气体的一个平衡状态对应着三个状态参量,图象上的某一条直线或曲线表示一定质量气体状态变化的一个过程.
【要点梳理】
要点一、理想气体
1.理想气体
严格遵从3个实验定律的气体称为理想气体.
在任何温度、任何压强下都严格遵从气体实验定律的气体叫做理想气体.
要点诠释:
对理想气体应从以下几个方面理解:
(1)理想气体是一种理想化模型,是对实际气体的科学抽象.
(2)实际气体,特别是那些不容易液化的气体,如氢气、氧气、氮气、氦气等,在压强不太大(不超过大气压的几倍),温度不太低(不低于负几十摄氏度)时,可以近似地视为理想气体.
(3)在微观意义上,理想气体分子本身大小与分子间的距离相比可以忽略不计,分子间不存在相互作用的引力和斥力,所以理想气体的分子势能为零,理想气体的内能等于分子的总动能.
2.理想气体的状态方程
一定质量的理想气体,由初状态()变化到末状态()时,各量满足:
或(为恒量).
上面两式都叫做一定质量的理想气体的状态方程.
要点诠释:
(1)气体的三个实验定律是理想气体状态方程的特例:
当时,(玻意耳定律).
当时,(查理定律).
当时,(盖—吕萨克定律).
(2)适用条件:
该方程是在理想气体质量不变的条件下才适用.是一定量理想气体两个状态参量的关系,与变化过程无关.
(3)中的恒量仅由气体的种类和质量决定,与其他参量无关.
要点二、应用理想气体状态方程解题的一般思路
1.应用理想气体状态方程解题的一般思路
(1)确定研究对象(某一部分气体),明确气体所处系统的力学状态(是否具有加速度).
(2)弄清气体状态的变化过程(是单调变化还是非单调变化,是否会出现临界状态或极值点).
(3)确定气体的初、末状态及其状态参量,并注意单位的统一.
(4)根据题意,选用适当的气体状态方程求解.若非纯气体热学问题,还要综合应用力学等有关知识列辅助方程.
(5)分析讨论所得结果的合理性及其物理意义.
2.“两团气”问题的一般解法
“两团气”问题涉及两部分(或两部分以上)的气体,它们之间虽没有气体交换,但在压强或体积这些量之间有一定的关系.分析清楚这些关系往往是解决问题的关键.解决此类问题的一般方法是:
(1)分别选取每团气体为研究对象,确定初、末状态及其状态参量,根据气体状态方程写出状态参量间的关系式.
(2)认真分析两团气体的压强或体积之间的关系,并写出关系式.
(3)多个方程联立求解.
3.解决汽缸类问题的一般思路
(1)弄清题意,确定研究对象.一般来说,研究对象分两类,一类是热学研究对象(一定质量的理想气体),另一类是力学研究对象(汽缸、活塞或某系统).
(2)分析清楚题目所求的物理过程,热学研究对象的初、末状态及状态变化过程,依气体定律列出方程;对力学研究对象要正确地进行受力分析,依据力学规律列出方程.
(3)注意挖掘题目中的隐含条件,如几何关系等,列出辅助方程.
(4)多个方程联立求解.对求解的结果,注意检验它们的合理性.
4.汽缸类问题的几种常见类型
(1)气体系统处于平衡状态,需综合应用气体定律和物体的平衡条件解题.
(2)气体系统处于力学非平衡状态,需要综合应用气体定律和牛顿运动定律解题.
(3)封闭气体的容器(如汽缸、活塞、玻璃管等)与气体发生相互作用的过程中,如果满足守恒定律的适用条件,可根据相应的守恒定律解题.
(4)两个或多个汽缸封闭着几部分气体,并且汽缸之间相互关联的问题,解答时应分别研究各部分气体,找出它们各自遵循的规律,并写出相应的方程:还要写出各部分气体之间压强或体积的关系式,最后联立求解.
要点诠释:
当选取力学研究对象进行分析时,研究对象的选取并不唯一,同学们可以灵活地选整体或部分为研究对象进行受力分析,列出平衡方程或动力学方程.
要点三、理想气体状态方程的推导
1.理想气体状态方程的推导
一定质量理想气体初态()变化到末态(),因气体遵从三个实验定律,我们可以从三个定律中任意选取其中两个,通过一个中间状态,建立两个方程,解方程消去中间状态参量便可得到气态方程.组成方式有种,如图所示。
我们选(1)先等温、后等压来证明.
从初态→中间态,由玻意耳定律得
①
从中间态→末态,由盖一吕萨克定律得
②
由①②式得
。
其余5组大家可试证明一下.
2.克拉珀龙方程
某种理想气体,设质量为,摩尔质量为,则该理想气体状态方程为。
式中为摩尔气体常量,在国际单位制中.
这就是任意质量的理想气体的状态方程,也叫做克拉珀龙方程.
从上式可以看出在中的恒量由理想气体的质量、摩尔质量和摩尔气体常量决定.
3.气体密度方程
对于一定质量的气体,在状态
时密度为,则
,
在状态
时密度为,则
,
将
、
代入状态方程
.
得
.
此方程与质量无关.可解决高质量问题.
4.理想气体状态方程的分态式
,
式中
是气体终态的个部分的状态参量.该方程根据质量守恒和克拉珀龙方程可导出,当理想气体发生状态变化时,如伴随着有气体的迁移、分装、混合等各种情况,使用分态式会显得特别方便.
要点三、气体状态变化的图象
用图象表示气体状态变化的过程及变化规律具有形象、直观、物理意义明朗等优点,另外,利用图象对气体状态、状态变化及规律进行分析,将给解答带来很大的方便.
图象上的一个点表示定质量气体的一个平衡状态,它对应着三个状态参量;图象上的某一条直线或曲线表示定质量气体状态变化的一个过程.
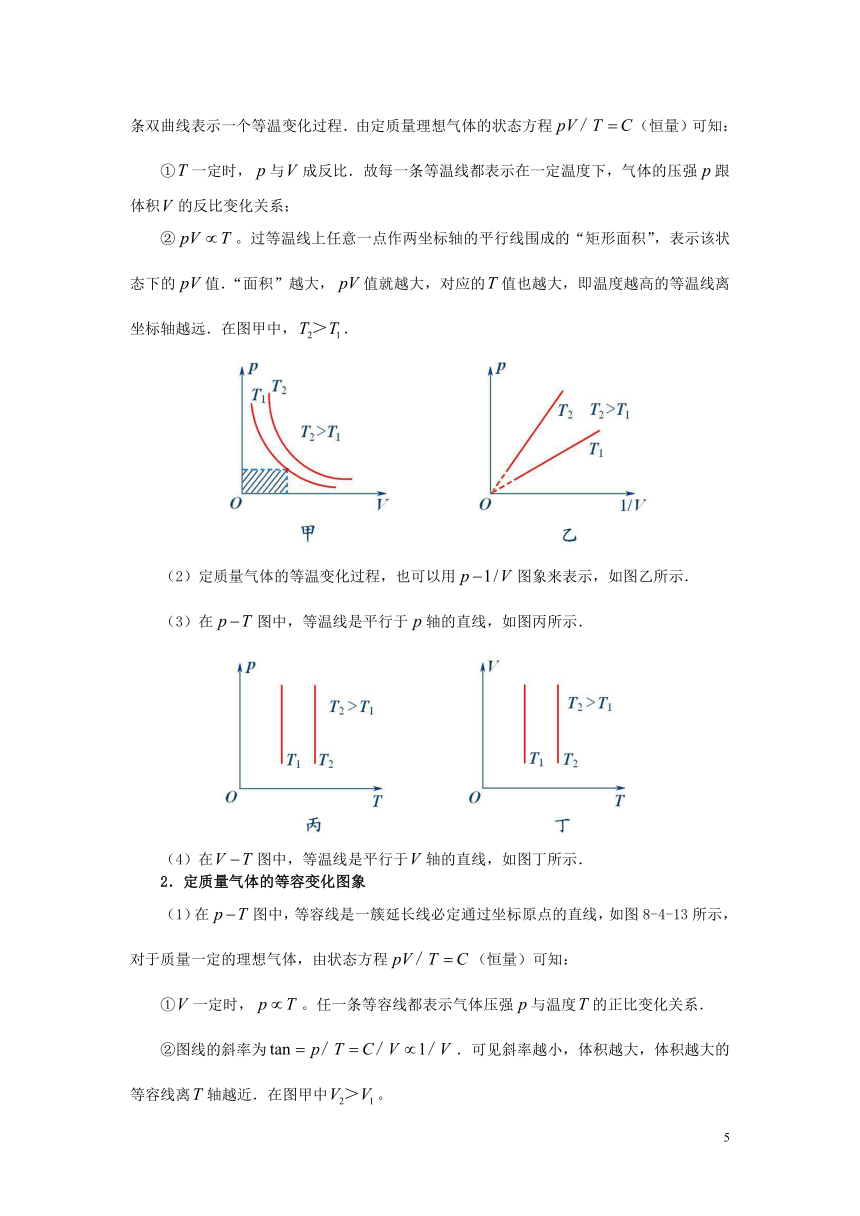
1.定质量气体的等温变化图象
(1)在图中,等温线是以两坐标轴为渐近线的一簇双曲线(反比例函数),每一条双曲线表示一个等温变化过程.由定质量理想气体的状态方程(恒量)可知:
①一定时,与成反比.故每一条等温线都表示在一定温度下,气体的压强跟体积的反比变化关系;
②。过等温线上任意一点作两坐标轴的平行线围成的“矩形面积”,表示该状态下的值.“面积”越大,值就越大,对应的值也越大,即温度越高的等温线离坐标轴越远.在图甲中,.
(2)定质量气体的等温变化过程,也可以用图象来表示,如图乙所示.
(3)在图中,等温线是平行于轴的直线,如图丙所示.
(4)在图中,等温线是平行于轴的直线,如图丁所示.
2.定质量气体的等容变化图象
(1)在图中,等容线是一簇延长线必定通过坐标原点的直线,如图8-4-13所示,对于质量一定的理想气体,由状态方程(恒量)可知:
①一定时,。任一条等容线都表示气体压强与温度的正比变化关系.
②图线的斜率为.可见斜率越小,体积越大,体积越大的等容线离轴越近.在图甲中。
(2)若横坐标用摄氏温度表示,则定质量气体的等容变化图象如图乙所示.
(3)在图中,等容线是平行于轴的直线,如图丙所示。
(4)在图中,等容线是平行于轴的直线,如图丁所示。
3.定质量气体的等压变化图象
(1)在图中,等压线是一簇延长线必定通过坐标原点的直线,如图8-4-17所示,对于质量一定的理想气体,由状态方程(恒量)可知:
①一定时,。任一条等压线都表示气体体积与温度的正比变化关系.
②图线的斜率为可见斜率越小,压强越大,压强越大的等压线离轴越近.在图甲中,。
(2)若横坐标用摄氏温度表示,则定质量气体的等压变化图象如图乙所示.
(3)在图中,等压线是平行于轴的直线,如图丙所示。
(4)在图中,等压线是平行于轴的直线,如图丁所示。
掌握以上气体状态变化图象的特点,可以简捷地判定气体状态变化是否为等值变化,还可以比较非等值变化过程中,不同状态的温度的高低.压强和体积的大小.其方法一般是通过所比较的点,定性作出相应的等温、等压或等容图象,比较其值、斜率tan的大小,就可以得出结论.
要点四、知识归纳总结
1.知识归纳
(1)理想气体的定义及气体实验定律的适用范围.
(2)理想气体的状态方程
或(为恒量).
2.方法归纳
(1)理想气体状态方程实质上是三个实验定律的推广与拓展,它可以由三个实验定律中的任意两个而得到.
(2)应用状态方程解决气体问题时,往往比单纯使用实验定律要简单.使用时首先确定好研究对象的始、末两个状态,然后确定好这两个状态对应的状态参量,最后应用状态方程的表达式列方程.列方程时注意,公式两边的单位分别一致,不一定采用国际单位.
(3)很多变质量问题可以通过灵活选取研究对象转化为定质量问题,从而能够使用气体实验定律或理想气体的状态方程.研究力热综合问题时,要灵活地变换研究对象,以封闭气体的液柱、活塞为研究对象,以压强为媒介,列出平衡方程或应用牛顿第二定律求解.
【典型例题】
类型一、理想气体
例1.下列对理想气体的理解,正确的有(
).
A.理想气体实际上并不存在,只是一种理想模型
B.实只要气体压强不是很高就可视为理想气体
C.一定质量的某种理想气体的内能与温度、体积都有关
D.在任何温度、任何压强下,理想气体都遵循气体实验定律
【思路点拨】根据理想气体的特点。
【答案】A、D
【解析】理想气体是在忽略了实际气体分子间相互作用力的情况下而抽象出的一种理想化模型,A正确;实际气体能视为理想气体的条件是温度不太低、压强不太大,B错误;理想气体分子间无分子力作用,也就无分子势能,故一定质量的理想气体,其内能与体积无关,只取决于温度,C错误;由理想气体模型的定义可知D正确。
【总结升华】记住理想气体的特点是解此类试题的关键。
举一反三:
【变式】下列说法中正确的是(
).
A.一定质量的气体被压缩时,气体压强不一定增大
B.一定质量的气体温度不变压强增大时,其体积也增大
C.气体压强是由气体分子间的斥力产生的
D.在失重情况下,密闭容器内的气体对器壁没有压强
【答案】A
【解析】气体质量一定时,恒量,显然,A对,B错;由气体压强产生的原因知C错;D中因为容器密闭,气体对器壁有压强,故D错.
类型二、理想气体状态方程的应用
例2.一活塞将一定质量的理想气体封闭在汽缸内,初始时气体体积为.用实验系统测得此时气体的温度和压强分别为和.推动活塞压缩气体,测得气体的温度和压强分别为和.
(1)求此时气体的体积;
(2)保持温度不变,缓慢改变作用在活塞上的力,使气体压强变为,求此时气体的体积.
【答案】见解析
【解析】(1)由理想气体状态方程得
,
所以此时气体的体积为
.
(2)由玻意耳定律得
,
所以
.
举一反三:
【变式】分别以表示气体的压强、体积、温度.一定质量的理想气体,其初始状态表示为().若分别经历如下两种变化过程:
从()变为()的过程中,温度保持不变();
从()变为()的过程中,既不吸热,也不放热,在上述两种变化过程中,如果,则(
).
A.
B.
C.
D.
【答案】A
【解析】解法一:依据理想气体状态方程.由已知条件,,则,又且为绝热过程,则.综上所述,故选项A正确.
解法二:由条件知,两种过程的体积都是变大的,即单位体积内分子个数减少,造成.对于等温过程,则是气体分子碰撞器壁时产生的“碰撞力”不变,而绝热过程,温度降低,可以认为单个气体分子碰撞器壁的力减小,故可知,故选项A是正确的.
类型三、“两团气”问题
例3.光滑绝热的活塞把密封的圆筒容器分成两部分,这两部分充有温度相同的气体,平衡时,现将中气体加热到,中气体降低到,待重新平衡后,这两部分气体体积的比为(
).
A.
B.
C.
D.
【思路点拨】明确其压强和体积这些参量间的关系,结合理想气体的状态方程列方程求解。
【答案】B
【解析】对部分气体有
.
①
对部分气体有
.
②
因为
所以将①式÷②式得
.
所以
.
【总结升华】涉及两团气的问题出现时,明确其压强和体积这些参量间的关系,结合理想气体的状态方程列方程求解是关键。
举一反三:
【变式】用销钉固定的活塞把容器分成两部分,其容积之比,如图所示,起初中有温度为、压强为的空气,中有温度为,压强为的空气,拔去销钉,使活塞可以无摩擦地移动但不漏气,由于容器壁缓慢导热,最后都变成室温活塞也停住,求最后中气体的压强.
【答案】
【僻析】对气体,初态:
,,
.
末态:
,,.
由气态方程
得:
.
①
对气体,初态:
,,.
末态:
,,.
由气态方程
得:
.
②
又
.
③
.
④
.
⑤
由①②③④⑤得
.
【总结升华】本题涉及两部分气体的状态变化,解题时应分别对两部分气体进行研究,挖掘出它们之间的相关条件——体积关系、压强关系。
类型四、汽缸类问题
例4.如图所示,有一圆柱形汽缸,上部有一固定开口挡板,汽缸内壁的高度是2L,一个很薄质量为m
=
0.4kg的活塞封闭一定质量的理想气体,活塞的面积为2cm2,开始时活塞处在离底部L高处,外界大气压为1.0
×
105Pa,温度为27℃,现对气体加热,求:
(1)活塞恰上升到气缸上部挡板处时气体的温度是多少℃;
(2)当加热到427℃时,气体的压强(结果保留三位有效数字)。
【答案】(1)327℃;(2)1.40×105Pa
【解析】(1)开始加热活塞上升的过程封闭气体做等压变化。
设气缸横截面积为S,活塞恰上升到气缸上部挡板处时气体温度为t℃,则对于封闭气体
状态一:T1=27+273=300K,V1=LS;
状态二:T2=(t+273)K,V2=2LS
由即
解得t=327℃
(2)设当加热到4270C时气体的压强变为p3,在此之前活塞已上升到气缸上部挡板处。
对于封闭气体,初状态:T1=300K,V1=LS,
末状态:T3=700K,V3=2LS,
由 ,可得
代入数据得p3=1.40×105Pa
类型五、气体状态变化的图象问题
例5.一定质量的理想气体,封闭在带活塞的汽缸中,气体从状态出发,经历四个过程回到状态,各过程的压强与温度的关系如图所示,其中气体不对外界做功,外界也不对气体做功的过程是(
).
A.过程
B.过程
C.过程
D.过程
【思路点拨】明确图象的物理意义和特点,区分清楚各个不同的物理过程。
【答案】A、C
【解析】气体既不对外做功,外界也不对气体做功的过程,就是等容过程.从图象中看,一定质量的气体,在由状态到状态的过程满足关系式,所以过程是等容过程.对于的过程,从图可见,有等,所以过程也是等容过程.选项A、C正确.
【总结升华】明确图象的物理意义和特点,区分清楚各个不同的物理过程是解题的关键。
举一反三:
【变式】使一定质量的理想气体按图甲中箭头所示的顺序变化,图中段是以纵轴和横轴为渐近线的双曲线.
(1)已知气体在状态的温度,求气体在状态和的温度各是多少?
(2)将上述状态变化过程在图乙中画成用体积和温度表示的图线(图中要标明四点,并且要画箭头表示变化的方向).说明每段图线各表示什么过程.
【答案】见解析
【解析】
由图中直观地看出,气体在各状态下压强和体积为.
(1)根据气体状态方程,有
,
可得
,
,
.
(2)由状态到状态为等温变化,由玻意耳定律有,得
。
在图上状态变化过程的图线由各状态点依次连接(如图),是等压膨胀过程,是等温膨胀过程,是等压压缩过程.
例6.如图所示为摩尔的某种气体的压强和温度关系的图线,表示个标准大气压,则在状态时气体的体积为(
).
A.
B.
C.
D.
【答案】D
【解析】
此气体在时,压强为标准大气压。所以它的体积应为
,
根据图线所示,从到状态,气体是等容变化,状态的体积为,温度为
,
从状态到状态为等压变化,状态的温度为
,
根据盖一吕萨克定律
,
.
类型六、综合计算
例7.如图所示,两点代表一定质量理想气体的两个不同的状态,状态的温度为,状态的温度为.由图可知(
).
A.
B.
C.
D.
【思路点拨】明确初末状态的参考量,,再列方程求解。
【答案】C
【解析】
从已知图上可知.为确定它们之间的定量关系,可以从图上的标度值代替压强和体积的大小,代入理想气体状态方程
,,.
【总结升华】理解理想气体的状态方程的实质即一定质量的理想气体在状态参量变化时的为常量。解题时应明确初末状态的参考量,而后再列方程求解。
举一反三:
【变式1】房间的容积为,在温度为、大气压强为时,室内空气质量是.当温度升高到,大气压强变为时,室内空气的质量是多少?
【答案】
【解析】
室内气体的温度、压强均发生了变化,原气体的体积不一定再是,可能增大有气体流出,可能减小有气体流入。因此仍以原气体为研究对象,通过计算才能确定.
气体初态:
末态:
由状态方程:
,
∴.
因,故有气体从房间内流出.
房间内气体质量
.
本题还可用密度公式来解决.
,
又
,
∴。
【变式2】钢筒内装有气体,当温度为时,压强为,如果用掉气体后温度升高到,求筒内气体压强.
【答案】
【解析】
以钢筒内剩下的气体为研究对象.设钢管容积为,则该部分气体在初状态占有的体积为,末状态时恰好充满整个钢筒.
由一定质量理想气体的状态方程
得
。
【总结升华】
通过恰当地选取研究对象,使变质量问题转化成定质量问题,这是求解本题的关键。
PAGE
1
【学习目标】
1.知道什么是理想气体,理想气体分子的运动特点,气体压强产生的原因;
2.掌握理想气体的状态方程,知道理想气体状态方程的推出过程;
3.学会建立物理模型的研究方法;
4.利用理想气体的状态方程分析解决实际问题。
5.利用图象形象直观地表示气体状态及状态的变化.
6.学会利用图象和气体实验定律分析气体的状态变化。
7.在掌握图象的特点的基础上利用图象解决实际问题.
8.进一步明确图象上的一个点表示一定质量的气体的一个平衡状态对应着三个状态参量,图象上的某一条直线或曲线表示一定质量气体状态变化的一个过程.
【要点梳理】
要点一、理想气体
1.理想气体
严格遵从3个实验定律的气体称为理想气体.
在任何温度、任何压强下都严格遵从气体实验定律的气体叫做理想气体.
要点诠释:
对理想气体应从以下几个方面理解:
(1)理想气体是一种理想化模型,是对实际气体的科学抽象.
(2)实际气体,特别是那些不容易液化的气体,如氢气、氧气、氮气、氦气等,在压强不太大(不超过大气压的几倍),温度不太低(不低于负几十摄氏度)时,可以近似地视为理想气体.
(3)在微观意义上,理想气体分子本身大小与分子间的距离相比可以忽略不计,分子间不存在相互作用的引力和斥力,所以理想气体的分子势能为零,理想气体的内能等于分子的总动能.
2.理想气体的状态方程
一定质量的理想气体,由初状态()变化到末状态()时,各量满足:
或(为恒量).
上面两式都叫做一定质量的理想气体的状态方程.
要点诠释:
(1)气体的三个实验定律是理想气体状态方程的特例:
当时,(玻意耳定律).
当时,(查理定律).
当时,(盖—吕萨克定律).
(2)适用条件:
该方程是在理想气体质量不变的条件下才适用.是一定量理想气体两个状态参量的关系,与变化过程无关.
(3)中的恒量仅由气体的种类和质量决定,与其他参量无关.
要点二、应用理想气体状态方程解题的一般思路
1.应用理想气体状态方程解题的一般思路
(1)确定研究对象(某一部分气体),明确气体所处系统的力学状态(是否具有加速度).
(2)弄清气体状态的变化过程(是单调变化还是非单调变化,是否会出现临界状态或极值点).
(3)确定气体的初、末状态及其状态参量,并注意单位的统一.
(4)根据题意,选用适当的气体状态方程求解.若非纯气体热学问题,还要综合应用力学等有关知识列辅助方程.
(5)分析讨论所得结果的合理性及其物理意义.
2.“两团气”问题的一般解法
“两团气”问题涉及两部分(或两部分以上)的气体,它们之间虽没有气体交换,但在压强或体积这些量之间有一定的关系.分析清楚这些关系往往是解决问题的关键.解决此类问题的一般方法是:
(1)分别选取每团气体为研究对象,确定初、末状态及其状态参量,根据气体状态方程写出状态参量间的关系式.
(2)认真分析两团气体的压强或体积之间的关系,并写出关系式.
(3)多个方程联立求解.
3.解决汽缸类问题的一般思路
(1)弄清题意,确定研究对象.一般来说,研究对象分两类,一类是热学研究对象(一定质量的理想气体),另一类是力学研究对象(汽缸、活塞或某系统).
(2)分析清楚题目所求的物理过程,热学研究对象的初、末状态及状态变化过程,依气体定律列出方程;对力学研究对象要正确地进行受力分析,依据力学规律列出方程.
(3)注意挖掘题目中的隐含条件,如几何关系等,列出辅助方程.
(4)多个方程联立求解.对求解的结果,注意检验它们的合理性.
4.汽缸类问题的几种常见类型
(1)气体系统处于平衡状态,需综合应用气体定律和物体的平衡条件解题.
(2)气体系统处于力学非平衡状态,需要综合应用气体定律和牛顿运动定律解题.
(3)封闭气体的容器(如汽缸、活塞、玻璃管等)与气体发生相互作用的过程中,如果满足守恒定律的适用条件,可根据相应的守恒定律解题.
(4)两个或多个汽缸封闭着几部分气体,并且汽缸之间相互关联的问题,解答时应分别研究各部分气体,找出它们各自遵循的规律,并写出相应的方程:还要写出各部分气体之间压强或体积的关系式,最后联立求解.
要点诠释:
当选取力学研究对象进行分析时,研究对象的选取并不唯一,同学们可以灵活地选整体或部分为研究对象进行受力分析,列出平衡方程或动力学方程.
要点三、理想气体状态方程的推导
1.理想气体状态方程的推导
一定质量理想气体初态()变化到末态(),因气体遵从三个实验定律,我们可以从三个定律中任意选取其中两个,通过一个中间状态,建立两个方程,解方程消去中间状态参量便可得到气态方程.组成方式有种,如图所示。
我们选(1)先等温、后等压来证明.
从初态→中间态,由玻意耳定律得
①
从中间态→末态,由盖一吕萨克定律得
②
由①②式得
。
其余5组大家可试证明一下.
2.克拉珀龙方程
某种理想气体,设质量为,摩尔质量为,则该理想气体状态方程为。
式中为摩尔气体常量,在国际单位制中.
这就是任意质量的理想气体的状态方程,也叫做克拉珀龙方程.
从上式可以看出在中的恒量由理想气体的质量、摩尔质量和摩尔气体常量决定.
3.气体密度方程
对于一定质量的气体,在状态
时密度为,则
,
在状态
时密度为,则
,
将
、
代入状态方程
.
得
.
此方程与质量无关.可解决高质量问题.
4.理想气体状态方程的分态式
,
式中
是气体终态的个部分的状态参量.该方程根据质量守恒和克拉珀龙方程可导出,当理想气体发生状态变化时,如伴随着有气体的迁移、分装、混合等各种情况,使用分态式会显得特别方便.
要点三、气体状态变化的图象
用图象表示气体状态变化的过程及变化规律具有形象、直观、物理意义明朗等优点,另外,利用图象对气体状态、状态变化及规律进行分析,将给解答带来很大的方便.
图象上的一个点表示定质量气体的一个平衡状态,它对应着三个状态参量;图象上的某一条直线或曲线表示定质量气体状态变化的一个过程.
1.定质量气体的等温变化图象
(1)在图中,等温线是以两坐标轴为渐近线的一簇双曲线(反比例函数),每一条双曲线表示一个等温变化过程.由定质量理想气体的状态方程(恒量)可知:
①一定时,与成反比.故每一条等温线都表示在一定温度下,气体的压强跟体积的反比变化关系;
②。过等温线上任意一点作两坐标轴的平行线围成的“矩形面积”,表示该状态下的值.“面积”越大,值就越大,对应的值也越大,即温度越高的等温线离坐标轴越远.在图甲中,.
(2)定质量气体的等温变化过程,也可以用图象来表示,如图乙所示.
(3)在图中,等温线是平行于轴的直线,如图丙所示.
(4)在图中,等温线是平行于轴的直线,如图丁所示.
2.定质量气体的等容变化图象
(1)在图中,等容线是一簇延长线必定通过坐标原点的直线,如图8-4-13所示,对于质量一定的理想气体,由状态方程(恒量)可知:
①一定时,。任一条等容线都表示气体压强与温度的正比变化关系.
②图线的斜率为.可见斜率越小,体积越大,体积越大的等容线离轴越近.在图甲中。
(2)若横坐标用摄氏温度表示,则定质量气体的等容变化图象如图乙所示.
(3)在图中,等容线是平行于轴的直线,如图丙所示。
(4)在图中,等容线是平行于轴的直线,如图丁所示。
3.定质量气体的等压变化图象
(1)在图中,等压线是一簇延长线必定通过坐标原点的直线,如图8-4-17所示,对于质量一定的理想气体,由状态方程(恒量)可知:
①一定时,。任一条等压线都表示气体体积与温度的正比变化关系.
②图线的斜率为可见斜率越小,压强越大,压强越大的等压线离轴越近.在图甲中,。
(2)若横坐标用摄氏温度表示,则定质量气体的等压变化图象如图乙所示.
(3)在图中,等压线是平行于轴的直线,如图丙所示。
(4)在图中,等压线是平行于轴的直线,如图丁所示。
掌握以上气体状态变化图象的特点,可以简捷地判定气体状态变化是否为等值变化,还可以比较非等值变化过程中,不同状态的温度的高低.压强和体积的大小.其方法一般是通过所比较的点,定性作出相应的等温、等压或等容图象,比较其值、斜率tan的大小,就可以得出结论.
要点四、知识归纳总结
1.知识归纳
(1)理想气体的定义及气体实验定律的适用范围.
(2)理想气体的状态方程
或(为恒量).
2.方法归纳
(1)理想气体状态方程实质上是三个实验定律的推广与拓展,它可以由三个实验定律中的任意两个而得到.
(2)应用状态方程解决气体问题时,往往比单纯使用实验定律要简单.使用时首先确定好研究对象的始、末两个状态,然后确定好这两个状态对应的状态参量,最后应用状态方程的表达式列方程.列方程时注意,公式两边的单位分别一致,不一定采用国际单位.
(3)很多变质量问题可以通过灵活选取研究对象转化为定质量问题,从而能够使用气体实验定律或理想气体的状态方程.研究力热综合问题时,要灵活地变换研究对象,以封闭气体的液柱、活塞为研究对象,以压强为媒介,列出平衡方程或应用牛顿第二定律求解.
【典型例题】
类型一、理想气体
例1.下列对理想气体的理解,正确的有(
).
A.理想气体实际上并不存在,只是一种理想模型
B.实只要气体压强不是很高就可视为理想气体
C.一定质量的某种理想气体的内能与温度、体积都有关
D.在任何温度、任何压强下,理想气体都遵循气体实验定律
【思路点拨】根据理想气体的特点。
【答案】A、D
【解析】理想气体是在忽略了实际气体分子间相互作用力的情况下而抽象出的一种理想化模型,A正确;实际气体能视为理想气体的条件是温度不太低、压强不太大,B错误;理想气体分子间无分子力作用,也就无分子势能,故一定质量的理想气体,其内能与体积无关,只取决于温度,C错误;由理想气体模型的定义可知D正确。
【总结升华】记住理想气体的特点是解此类试题的关键。
举一反三:
【变式】下列说法中正确的是(
).
A.一定质量的气体被压缩时,气体压强不一定增大
B.一定质量的气体温度不变压强增大时,其体积也增大
C.气体压强是由气体分子间的斥力产生的
D.在失重情况下,密闭容器内的气体对器壁没有压强
【答案】A
【解析】气体质量一定时,恒量,显然,A对,B错;由气体压强产生的原因知C错;D中因为容器密闭,气体对器壁有压强,故D错.
类型二、理想气体状态方程的应用
例2.一活塞将一定质量的理想气体封闭在汽缸内,初始时气体体积为.用实验系统测得此时气体的温度和压强分别为和.推动活塞压缩气体,测得气体的温度和压强分别为和.
(1)求此时气体的体积;
(2)保持温度不变,缓慢改变作用在活塞上的力,使气体压强变为,求此时气体的体积.
【答案】见解析
【解析】(1)由理想气体状态方程得
,
所以此时气体的体积为
.
(2)由玻意耳定律得
,
所以
.
举一反三:
【变式】分别以表示气体的压强、体积、温度.一定质量的理想气体,其初始状态表示为().若分别经历如下两种变化过程:
从()变为()的过程中,温度保持不变();
从()变为()的过程中,既不吸热,也不放热,在上述两种变化过程中,如果,则(
).
A.
B.
C.
D.
【答案】A
【解析】解法一:依据理想气体状态方程.由已知条件,,则,又且为绝热过程,则.综上所述,故选项A正确.
解法二:由条件知,两种过程的体积都是变大的,即单位体积内分子个数减少,造成.对于等温过程,则是气体分子碰撞器壁时产生的“碰撞力”不变,而绝热过程,温度降低,可以认为单个气体分子碰撞器壁的力减小,故可知,故选项A是正确的.
类型三、“两团气”问题
例3.光滑绝热的活塞把密封的圆筒容器分成两部分,这两部分充有温度相同的气体,平衡时,现将中气体加热到,中气体降低到,待重新平衡后,这两部分气体体积的比为(
).
A.
B.
C.
D.
【思路点拨】明确其压强和体积这些参量间的关系,结合理想气体的状态方程列方程求解。
【答案】B
【解析】对部分气体有
.
①
对部分气体有
.
②
因为
所以将①式÷②式得
.
所以
.
【总结升华】涉及两团气的问题出现时,明确其压强和体积这些参量间的关系,结合理想气体的状态方程列方程求解是关键。
举一反三:
【变式】用销钉固定的活塞把容器分成两部分,其容积之比,如图所示,起初中有温度为、压强为的空气,中有温度为,压强为的空气,拔去销钉,使活塞可以无摩擦地移动但不漏气,由于容器壁缓慢导热,最后都变成室温活塞也停住,求最后中气体的压强.
【答案】
【僻析】对气体,初态:
,,
.
末态:
,,.
由气态方程
得:
.
①
对气体,初态:
,,.
末态:
,,.
由气态方程
得:
.
②
又
.
③
.
④
.
⑤
由①②③④⑤得
.
【总结升华】本题涉及两部分气体的状态变化,解题时应分别对两部分气体进行研究,挖掘出它们之间的相关条件——体积关系、压强关系。
类型四、汽缸类问题
例4.如图所示,有一圆柱形汽缸,上部有一固定开口挡板,汽缸内壁的高度是2L,一个很薄质量为m
=
0.4kg的活塞封闭一定质量的理想气体,活塞的面积为2cm2,开始时活塞处在离底部L高处,外界大气压为1.0
×
105Pa,温度为27℃,现对气体加热,求:
(1)活塞恰上升到气缸上部挡板处时气体的温度是多少℃;
(2)当加热到427℃时,气体的压强(结果保留三位有效数字)。
【答案】(1)327℃;(2)1.40×105Pa
【解析】(1)开始加热活塞上升的过程封闭气体做等压变化。
设气缸横截面积为S,活塞恰上升到气缸上部挡板处时气体温度为t℃,则对于封闭气体
状态一:T1=27+273=300K,V1=LS;
状态二:T2=(t+273)K,V2=2LS
由即
解得t=327℃
(2)设当加热到4270C时气体的压强变为p3,在此之前活塞已上升到气缸上部挡板处。
对于封闭气体,初状态:T1=300K,V1=LS,
末状态:T3=700K,V3=2LS,
由 ,可得
代入数据得p3=1.40×105Pa
类型五、气体状态变化的图象问题
例5.一定质量的理想气体,封闭在带活塞的汽缸中,气体从状态出发,经历四个过程回到状态,各过程的压强与温度的关系如图所示,其中气体不对外界做功,外界也不对气体做功的过程是(
).
A.过程
B.过程
C.过程
D.过程
【思路点拨】明确图象的物理意义和特点,区分清楚各个不同的物理过程。
【答案】A、C
【解析】气体既不对外做功,外界也不对气体做功的过程,就是等容过程.从图象中看,一定质量的气体,在由状态到状态的过程满足关系式,所以过程是等容过程.对于的过程,从图可见,有等,所以过程也是等容过程.选项A、C正确.
【总结升华】明确图象的物理意义和特点,区分清楚各个不同的物理过程是解题的关键。
举一反三:
【变式】使一定质量的理想气体按图甲中箭头所示的顺序变化,图中段是以纵轴和横轴为渐近线的双曲线.
(1)已知气体在状态的温度,求气体在状态和的温度各是多少?
(2)将上述状态变化过程在图乙中画成用体积和温度表示的图线(图中要标明四点,并且要画箭头表示变化的方向).说明每段图线各表示什么过程.
【答案】见解析
【解析】
由图中直观地看出,气体在各状态下压强和体积为.
(1)根据气体状态方程,有
,
可得
,
,
.
(2)由状态到状态为等温变化,由玻意耳定律有,得
。
在图上状态变化过程的图线由各状态点依次连接(如图),是等压膨胀过程,是等温膨胀过程,是等压压缩过程.
例6.如图所示为摩尔的某种气体的压强和温度关系的图线,表示个标准大气压,则在状态时气体的体积为(
).
A.
B.
C.
D.
【答案】D
【解析】
此气体在时,压强为标准大气压。所以它的体积应为
,
根据图线所示,从到状态,气体是等容变化,状态的体积为,温度为
,
从状态到状态为等压变化,状态的温度为
,
根据盖一吕萨克定律
,
.
类型六、综合计算
例7.如图所示,两点代表一定质量理想气体的两个不同的状态,状态的温度为,状态的温度为.由图可知(
).
A.
B.
C.
D.
【思路点拨】明确初末状态的参考量,,再列方程求解。
【答案】C
【解析】
从已知图上可知.为确定它们之间的定量关系,可以从图上的标度值代替压强和体积的大小,代入理想气体状态方程
,,.
【总结升华】理解理想气体的状态方程的实质即一定质量的理想气体在状态参量变化时的为常量。解题时应明确初末状态的参考量,而后再列方程求解。
举一反三:
【变式1】房间的容积为,在温度为、大气压强为时,室内空气质量是.当温度升高到,大气压强变为时,室内空气的质量是多少?
【答案】
【解析】
室内气体的温度、压强均发生了变化,原气体的体积不一定再是,可能增大有气体流出,可能减小有气体流入。因此仍以原气体为研究对象,通过计算才能确定.
气体初态:
末态:
由状态方程:
,
∴.
因,故有气体从房间内流出.
房间内气体质量
.
本题还可用密度公式来解决.
,
又
,
∴。
【变式2】钢筒内装有气体,当温度为时,压强为,如果用掉气体后温度升高到,求筒内气体压强.
【答案】
【解析】
以钢筒内剩下的气体为研究对象.设钢管容积为,则该部分气体在初状态占有的体积为,末状态时恰好充满整个钢筒.
由一定质量理想气体的状态方程
得
。
【总结升华】
通过恰当地选取研究对象,使变质量问题转化成定质量问题,这是求解本题的关键。
PAGE
1
同课章节目录
- 第一章 分子动理论与统计思想
- 1 物体是由大量分子组成的
- 2 分子的热运动
- 3 分子间的相互作用力
- 4 统计规律 分子运动速率分布
- 5 温度 内能 气体的压强
- 6 实验探究:用油膜法估测油酸分子的大小
- 第二章 固体和液体
- 1 晶体和非晶体
- 2 半导体
- 3 液体的表面张力
- 4 液晶
- 第三章 气体
- 1 气体实验定律
- 2 气体实验定律的微观解释及图像表示
- 3 理想气体
- 4 饱各汽与未饱和汽
- 5 空气的温度
- 第四章 能量守恒与热力学定律
- 1 能量守恒定律的发现
- 2 热力学第一定律
- 3 宏观热过程的方向性
- 4 热力学第二定律
- 5 熵概念初步
- 第五章 能源与可持续发展
- 1 能源与人类生存的关系
- 2 能源利用与环境问题
- 3 可持续发展战略
