第三单元《物质构成的奥秘》复习课件
图片预览











文档简介
课件60张PPT。第三单元 物质构成的奥秘
复 习 课人教版 九年级上这是《初中化学课堂教学优化设计的实践探索》(人教版“初中化学教案” )一书的配套课件,这本书的形成历时十余年,是作者多年教学实践的积累,以“把每一节课当作礼物送给学生”作为设计追求!
购书可与作者联系,QQ:871003695;手机/微信:13990810599。
书到付款。
由分子构成的物质,分子是保持物质化学性质的最小粒子。一、分子分子的基本性质1.分子质量和体积都很小。2.分子在不断运动。
(温度升高,运动加快。)3.分子之间有间隔。4.同种分子,化学性质相同;
不同种分子,化学性质不同。由分子构成的物质,如果只含一种分子,就是纯净物。
由分子构成的物质,如果含有多种分子,就是混合物。由分子构成的物质在发生物理变化时,分子本身没有发生变化。
由分子构成的物质在发生化学变化时,分子发生了变化。下列物质由分子构成氧气(O2)氢气(H2)氮气(N2)水(H2O)过氧化氢(H2O2)二氧化碳(CO2)氨气(NH3) 臭氧(O3)【例1】下列关于分子的说法正确的是( )
A.一切物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不能再分的粒子
D.由分子构成的物质,分子是保持其物质化学性质的最小粒子【练习1】生活中的下列现象, 可用分子知识加以解释, 其中正确的是( )
A.热胀冷缩是因为分子大小随温度而改变
B.蔗糖溶解是因为分子很小
C.气体易被压缩是因为气体分子间隔很小
D.墙内开花墙外香是因为分子在不断运动DD【例2】下列粒子能保持二氧化碳化学性质的是( )
A.二氧化碳分子 B.碳原子
C.氧原子 D.碳原子和氧原子【练习2】下列物质中含有氧分子的是( )
A.双氧水(H2O2) B.二氧化硫(SO2)
C.二氧化碳(CO2) D.液态空气DA原子是化学变化中的最小粒子。分子和原子最本质的区别:
在化学反应中分子可以再分,而原子不能再分。二、原子原子的基本性质(1)原子的质量和体积都很小。
(2)原子是不断运动的。
(3)原子间有间隔。
(4)同种原子化学性质相同,不同的原子化学性质不同。
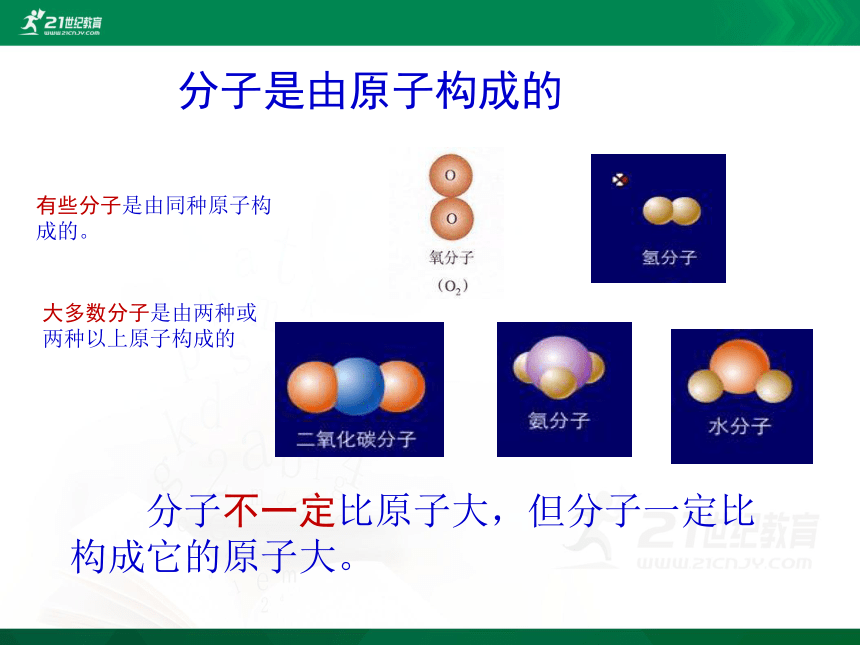
分子是由原子构成的有些分子是由同种原子构成的。大多数分子是由两种或两种以上原子构成的分子不一定比原子大,但分子一定比构成它的原子大。化学反应的微观实质:
在化学变化中,分子可以分成原子,原子又结合成新的分子。由原子直接构成的物质碳(C)硅(Si)金属稀有气体某些固态非金属镁(Mg)铜(Cu)铁(Fe)汞(Hg)氦气(He)氖气(Ne)金刚石(C)铝(Al)氩气(Ar)分子、原子的区别和联系由分子构成的物质,分子是保持物质化学性质的最小粒子。化学变化中的最小粒子。(1)分子的质量和体积都很小(2)分子是不断运动的,温度升高,分子运动加快(3)分子间有间隔(4)同种分子化学性质相同,不同的分子化学性质不同(2)原子是不断运动的,温度升高,原子运动加快(1)原子的质量和体积都很小。(4)同种原子化学性质相同,不同的原子化学性质不同(3)原子间有间隔分子、原子的区别和联系化学反应中可以再分(在化学反应中,分子分裂成原子,由原子重新组合成新的分子)化学反应中不能再分。在化学变化前后,原子的种类、性质都不变。
分子是由原子构成的。分子可以构成物质,原子也可以直接构成物质;分子不一定比原子大,但分子一定比构成它的原子大。有的物质由分子构成,如:氧气(O2)、臭氧(O3)、氢气(H2)、氮气(N2)、水(H2O)、过氧化氢(H2O2)、二氧化碳(CO2)、氨气(NH3)。有的物质由原子构成,如金属:镁(Mg)、铝(Al) 、铁(Fe)、铜(Cu)、汞(Hg);稀有气体:氦气( He)、氖气(Ne) 、氩气(Ar);某些固态非金属:碳(C)、硅(Si)等。【例3】判断:分子间有间隔,例如,水银温度计受热,水银柱会上升。( )
点拨:水银是金属,由原子构成,因此水银柱的上升是原子间间隔变大的结果。
×【例4】下列关于原子的说法正确的是( )
A.化学变化中的最小粒子 B.比分子小的粒子
C.不能再分的最小粒子 D.比分子轻的粒子【练习3】1993年8月, 我国科学家利用超高真空扫描隧道显微镜,在一块晶体硅的表面通过探针的作用搬走了原子,写下了 “中国”两字(如右图).下列说法不正确的是
( )
A.上述操作中发生了化学变化
B.上述操作中只发生了物理变化
C.这两个汉字是目前世界上最小的汉字
D.这标志着我国科学已进入操纵原子的阶段
AA原 子(带正电)(不带电) ( 1个电子带一个单位负电荷) (1个质子带一个单位正电荷)(不带电) 原子的结构原子核所带正电荷数简称核电荷数=核外电子数核电荷数=质子数不是所有的原子都有中子,氢原子中没有中子 在原子中,质子数不一定等于中子数不同种类的原子内质子数不同原子中质子数等于核外电子数,原子核内质子所带电荷与核外电子的电荷数量相等,电性相反,所以原子不显电性。为什么原子不显电性?(1) 能直接构成纯净物的是
(2) 能保持物质化学性质的是
(3)质量与氢原子质量近似相等的是
(4)在同种原子中数目相等的是
(5)化学反应中的最小粒子是
(6)带正电荷的是
(7)不显电性的是
(8)质量最小的是 【练习4】在①分子 ②原子 ③原子核 ④质子 ⑤中子 ⑥电子 等粒子中,找出符合下列条件的粒子的序号,填在相应的横线上。⑥① ② ⑤ ② ③ ④④ ⑥④ ⑤① ②① ②【练习5】据英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光格钟”,成了世界上最精确的钟。已知一种锶原子的相对原子质量为88,其质子数是38,则这种锶原子的核外电子数为( )
A.38 B.50 C.88 D.126
A原子结构示意图一般少于4易失去电子一般多于4易得到电子易发生化学反应等于8(氦等于2)不易得失电子很难发生化学反应,化学性质很不活泼未达到未达到达到原子最外层电子数规律元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关。一般地说,在单核粒子中,如果最外层电子数目相同,则化学性质相似。【例5】根据下列原子结构示意图判断,化学性质最相似的两种元素是( )
A.①和② B.①和④
C.②和③ D.③和④
B以一种碳原子质量的1/12(1.66×10-27 kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar )。碳12原子的质量×1/12Ar=相对原子质量相对原子质量≈质子数+中子数
相对原子质量只是一个比,不是原子的实际质量。它的单位是1,省略不写 。【练习6】判断:原子虽然很小,但也有质量,其实际质量用相对原子质量表示,单位是克。( )
×【例6】某原子的质量是碳12原子质量的2倍,求这种原子的相对原子质量。【解】设碳12原子的质量为aKg,则这种原子的质量为2aKg,其相对原子质量为答:这种原子的相对原子质量为24。离子是由原子得到或失去电子后形成的。
原子得电子——带负电——形成阴离子
原子失电子——带正电——形成阳离子在原子中:核电荷数=质子数=核外电子数。
在离子中:核电荷数=质子数≠核外电子数。三、离子离子的表示方法——离子符号。离子符号表示式Xn+或Xn-,X表示元素符号,X右上角的“+”或“-”表示离子带的是正电荷还是负电荷,“n”表示带n个单位的电荷,如果n 为1就省略不写。例如,Al3+表示1个铝离子带3个单位正电荷。部分原子的结构示意图记住并能正确书写下列常见的离子:
氢离子(H+)、钠离子(Na+)、钾离子( K+ )、镁离子( Mg2+ ) 、钙离子( Ca2+ )、钡离子( Ba2+ ) 、锌离子( Zn2+ ) 、铜离子( Cu2+ ) 、铝离子( Al3+ ) 、铁离子( Fe3+ ) 、亚铁离子( Fe2+ ) 、氯离子( Cl- ) 、硫离子( S2- ) 、氧离子( O2- )
氢氧根离子( OH- ) 、硝酸根离子( NO3- )
硫酸根离子( SO42- )、碳酸根离子( CO32- )
磷酸根离子( PO43- )、铵根离子( NH4+ )
?离子也是构成物质的粒子。如氯化钠、硫酸铜由离子构成。【练习7】某原子的结构示意图为
它的最外层电子数n=______,核外共有______个电子。
【例7】近年用红外激光技术研究液氢,发现液氢中含有H3+。则H3+属于( )
A.分子 B.原子 C.离子
C133【例8】对于Fe、Fe2+、Fe3+三种粒子的判断,正确的是( )
①核电荷数相同 ; ②核外电子数相等 ;③电子层结构完全相同 ;④质量几乎相等 ;⑤所含的质子数相等。
A.①③④⑤ B.②③④
C.①④⑤ D.③④⑤
C元素是质子数(即核电荷数) 相同的一类原子的总称。不同元素的根本区别是质子数(即核电荷数)不同。元素的种类由质子数决定。四、元素元素符号的意义表示一种元素表示该元素的一个原子H表示氢元素表示一个氢原子部分元素符号有三种意义:②一个铁原子①铁元素FeC③铁这种物质①碳元素②一个碳原子③碳这种物质Ne①表示氖元素②表示一个氖原子③表示氖气具有三种意义的元素符号有:
Cu、Fe、Hg等金属元素、稀有气体元素以及C、P、S、Si等固态非金属元素。元素符号前的数字:表示原子个数 ,如2N
离子符号前面的数字:表示离子个数 ,如2Mg2+
元素符号右上角的数字:表示该离子所带的电荷数 ,如Mg2+
物质发生化学变化时,分子一定发生变化,原子不发生变化,元素也不发生变化。氩元素水分子氨分子氧元素在单核粒子中,如果质子数相同,属于同种元素。元素和原子的区别和联系质子数(即核电荷数) 相同的一类原子的总称。化学变化中的最小粒子。宏观概念,只讲种类,不讲个数。描述物质的宏观组成。水是由氢元素和氧元素组成的。微观概念,既讲种类,又讲个数。描述微观构成。水分子是由氢原子和氧原子构成的。
碳是由碳原子构成的。【例9】科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。据此推断,当一种元素的原子经过放射变化后,结果变成了另一种元素的原子。它一定是放射了( )
A.电子 B.中子
C.质子 D.该原子的原子核【练习8】下列符号中,既能表示一种元素,又能表示一种元素的一个原子,还能代表一种物质的是( )
A.N2 B. O
C. P D. Fe
CCD【练习 9】若用“ ”表示氢原子,下列方框中,符合2H意义的示意图是( )
A【例10】今有四种粒子的结构示意图,下列说法正确的是( )
① ② ③ ④
A.它们表示四种元素
B.④表示的元素是非金属元素
C.①④表示的是阳离子
D.①③④的电子层排布相同
D(2)钠、镁、铝均属于 元素(选填“金属”或“非金属”),它们的原子在化学反应中易 (选填“得到”或“失去”)电子而形成 (选填“阳”或“阴”)离子,其中地壳中含量最多的金属元素形成的离子其符号是 。
?
(3)钙元素的原子结构示意图为 ,据此推测,
钙元素在元素周期表中的位置应该是 (选填“A”“B”或“C”)。【例11】根据下表提供的信息,回答下列问题。
(1)氢元素的元素符号为 ,钠元素的原子序数是 ,镁原子最外层有 个电子。H112金属失去阳Al3+B元素周期表1.元素周期表上分两大区域2.横行——周期3.纵行——族7个横行就是7个周期18个纵行16个族(8、9、10三个纵行共同组成一个族)金属和非金属五、物质的分类、组成、构成6 C碳12.01原子序数核电荷数质子数元素符号元素名称相对原子质量原子序数=核电荷数=质子数由元素周期表能获得元素的如下信息:纯净物
混合物物质物质的初步分类宏观:由一种物质组成。宏观:由两种或两种以上的物质混合而成。微观:只含一种分子(由分子构成的物质)微观:含有多种分子。(由分子构成的物质)根据下列的图形给物质分类(混合物、纯净物)纯净物纯净物混合物纯净物【练习10】在横线上填上相应物质的序号:①盐水 ②液氧 ③洁净空气 ④硫磺 ⑤铝 ⑥冰水混合物 ⑦氯酸钾 ⑧氯化钾
(1)属于混合物的是 。
(2)属于纯净物的是 。注意:若名称是“某酸某”或“某化某”一定是纯净物。②④⑤⑥⑦⑧①③物质构成分子构成原子构成元素同类原子
总称离子组成构成分解1.二氧化碳由 组成;
二氧化碳由 构成。
2.汞由 组成;
汞由 构成。
3.硫酸铜(CuSO4)由 组成;
硫酸铜(CuSO4)由 构成。
4.二氧化碳分子由 构成。
练习铜元素、硫元素、氧元素汞元素碳元素和氧元素汞原子碳原子和氧原子铜离子和硫酸根离子二氧化碳 分子【例12】关于分子、原子、离子的说法中,正确的是( )
A.分子、原子、离子都是构成物质的粒子
B.只有带电的原子才叫离子
C.原子是构成物质的最小粒子
D.分子是化学变化中的最小粒子
A谢谢21世纪教育网(www.21cnjy.com) 中小学教育资源网站 有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
复 习 课人教版 九年级上这是《初中化学课堂教学优化设计的实践探索》(人教版“初中化学教案” )一书的配套课件,这本书的形成历时十余年,是作者多年教学实践的积累,以“把每一节课当作礼物送给学生”作为设计追求!
购书可与作者联系,QQ:871003695;手机/微信:13990810599。
书到付款。
由分子构成的物质,分子是保持物质化学性质的最小粒子。一、分子分子的基本性质1.分子质量和体积都很小。2.分子在不断运动。
(温度升高,运动加快。)3.分子之间有间隔。4.同种分子,化学性质相同;
不同种分子,化学性质不同。由分子构成的物质,如果只含一种分子,就是纯净物。
由分子构成的物质,如果含有多种分子,就是混合物。由分子构成的物质在发生物理变化时,分子本身没有发生变化。
由分子构成的物质在发生化学变化时,分子发生了变化。下列物质由分子构成氧气(O2)氢气(H2)氮气(N2)水(H2O)过氧化氢(H2O2)二氧化碳(CO2)氨气(NH3) 臭氧(O3)【例1】下列关于分子的说法正确的是( )
A.一切物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不能再分的粒子
D.由分子构成的物质,分子是保持其物质化学性质的最小粒子【练习1】生活中的下列现象, 可用分子知识加以解释, 其中正确的是( )
A.热胀冷缩是因为分子大小随温度而改变
B.蔗糖溶解是因为分子很小
C.气体易被压缩是因为气体分子间隔很小
D.墙内开花墙外香是因为分子在不断运动DD【例2】下列粒子能保持二氧化碳化学性质的是( )
A.二氧化碳分子 B.碳原子
C.氧原子 D.碳原子和氧原子【练习2】下列物质中含有氧分子的是( )
A.双氧水(H2O2) B.二氧化硫(SO2)
C.二氧化碳(CO2) D.液态空气DA原子是化学变化中的最小粒子。分子和原子最本质的区别:
在化学反应中分子可以再分,而原子不能再分。二、原子原子的基本性质(1)原子的质量和体积都很小。
(2)原子是不断运动的。
(3)原子间有间隔。
(4)同种原子化学性质相同,不同的原子化学性质不同。
分子是由原子构成的有些分子是由同种原子构成的。大多数分子是由两种或两种以上原子构成的分子不一定比原子大,但分子一定比构成它的原子大。化学反应的微观实质:
在化学变化中,分子可以分成原子,原子又结合成新的分子。由原子直接构成的物质碳(C)硅(Si)金属稀有气体某些固态非金属镁(Mg)铜(Cu)铁(Fe)汞(Hg)氦气(He)氖气(Ne)金刚石(C)铝(Al)氩气(Ar)分子、原子的区别和联系由分子构成的物质,分子是保持物质化学性质的最小粒子。化学变化中的最小粒子。(1)分子的质量和体积都很小(2)分子是不断运动的,温度升高,分子运动加快(3)分子间有间隔(4)同种分子化学性质相同,不同的分子化学性质不同(2)原子是不断运动的,温度升高,原子运动加快(1)原子的质量和体积都很小。(4)同种原子化学性质相同,不同的原子化学性质不同(3)原子间有间隔分子、原子的区别和联系化学反应中可以再分(在化学反应中,分子分裂成原子,由原子重新组合成新的分子)化学反应中不能再分。在化学变化前后,原子的种类、性质都不变。
分子是由原子构成的。分子可以构成物质,原子也可以直接构成物质;分子不一定比原子大,但分子一定比构成它的原子大。有的物质由分子构成,如:氧气(O2)、臭氧(O3)、氢气(H2)、氮气(N2)、水(H2O)、过氧化氢(H2O2)、二氧化碳(CO2)、氨气(NH3)。有的物质由原子构成,如金属:镁(Mg)、铝(Al) 、铁(Fe)、铜(Cu)、汞(Hg);稀有气体:氦气( He)、氖气(Ne) 、氩气(Ar);某些固态非金属:碳(C)、硅(Si)等。【例3】判断:分子间有间隔,例如,水银温度计受热,水银柱会上升。( )
点拨:水银是金属,由原子构成,因此水银柱的上升是原子间间隔变大的结果。
×【例4】下列关于原子的说法正确的是( )
A.化学变化中的最小粒子 B.比分子小的粒子
C.不能再分的最小粒子 D.比分子轻的粒子【练习3】1993年8月, 我国科学家利用超高真空扫描隧道显微镜,在一块晶体硅的表面通过探针的作用搬走了原子,写下了 “中国”两字(如右图).下列说法不正确的是
( )
A.上述操作中发生了化学变化
B.上述操作中只发生了物理变化
C.这两个汉字是目前世界上最小的汉字
D.这标志着我国科学已进入操纵原子的阶段
AA原 子(带正电)(不带电) ( 1个电子带一个单位负电荷) (1个质子带一个单位正电荷)(不带电) 原子的结构原子核所带正电荷数简称核电荷数=核外电子数核电荷数=质子数不是所有的原子都有中子,氢原子中没有中子 在原子中,质子数不一定等于中子数不同种类的原子内质子数不同原子中质子数等于核外电子数,原子核内质子所带电荷与核外电子的电荷数量相等,电性相反,所以原子不显电性。为什么原子不显电性?(1) 能直接构成纯净物的是
(2) 能保持物质化学性质的是
(3)质量与氢原子质量近似相等的是
(4)在同种原子中数目相等的是
(5)化学反应中的最小粒子是
(6)带正电荷的是
(7)不显电性的是
(8)质量最小的是 【练习4】在①分子 ②原子 ③原子核 ④质子 ⑤中子 ⑥电子 等粒子中,找出符合下列条件的粒子的序号,填在相应的横线上。⑥① ② ⑤ ② ③ ④④ ⑥④ ⑤① ②① ②【练习5】据英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光格钟”,成了世界上最精确的钟。已知一种锶原子的相对原子质量为88,其质子数是38,则这种锶原子的核外电子数为( )
A.38 B.50 C.88 D.126
A原子结构示意图一般少于4易失去电子一般多于4易得到电子易发生化学反应等于8(氦等于2)不易得失电子很难发生化学反应,化学性质很不活泼未达到未达到达到原子最外层电子数规律元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关。一般地说,在单核粒子中,如果最外层电子数目相同,则化学性质相似。【例5】根据下列原子结构示意图判断,化学性质最相似的两种元素是( )
A.①和② B.①和④
C.②和③ D.③和④
B以一种碳原子质量的1/12(1.66×10-27 kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar )。碳12原子的质量×1/12Ar=相对原子质量相对原子质量≈质子数+中子数
相对原子质量只是一个比,不是原子的实际质量。它的单位是1,省略不写 。【练习6】判断:原子虽然很小,但也有质量,其实际质量用相对原子质量表示,单位是克。( )
×【例6】某原子的质量是碳12原子质量的2倍,求这种原子的相对原子质量。【解】设碳12原子的质量为aKg,则这种原子的质量为2aKg,其相对原子质量为答:这种原子的相对原子质量为24。离子是由原子得到或失去电子后形成的。
原子得电子——带负电——形成阴离子
原子失电子——带正电——形成阳离子在原子中:核电荷数=质子数=核外电子数。
在离子中:核电荷数=质子数≠核外电子数。三、离子离子的表示方法——离子符号。离子符号表示式Xn+或Xn-,X表示元素符号,X右上角的“+”或“-”表示离子带的是正电荷还是负电荷,“n”表示带n个单位的电荷,如果n 为1就省略不写。例如,Al3+表示1个铝离子带3个单位正电荷。部分原子的结构示意图记住并能正确书写下列常见的离子:
氢离子(H+)、钠离子(Na+)、钾离子( K+ )、镁离子( Mg2+ ) 、钙离子( Ca2+ )、钡离子( Ba2+ ) 、锌离子( Zn2+ ) 、铜离子( Cu2+ ) 、铝离子( Al3+ ) 、铁离子( Fe3+ ) 、亚铁离子( Fe2+ ) 、氯离子( Cl- ) 、硫离子( S2- ) 、氧离子( O2- )
氢氧根离子( OH- ) 、硝酸根离子( NO3- )
硫酸根离子( SO42- )、碳酸根离子( CO32- )
磷酸根离子( PO43- )、铵根离子( NH4+ )
?离子也是构成物质的粒子。如氯化钠、硫酸铜由离子构成。【练习7】某原子的结构示意图为
它的最外层电子数n=______,核外共有______个电子。
【例7】近年用红外激光技术研究液氢,发现液氢中含有H3+。则H3+属于( )
A.分子 B.原子 C.离子
C133【例8】对于Fe、Fe2+、Fe3+三种粒子的判断,正确的是( )
①核电荷数相同 ; ②核外电子数相等 ;③电子层结构完全相同 ;④质量几乎相等 ;⑤所含的质子数相等。
A.①③④⑤ B.②③④
C.①④⑤ D.③④⑤
C元素是质子数(即核电荷数) 相同的一类原子的总称。不同元素的根本区别是质子数(即核电荷数)不同。元素的种类由质子数决定。四、元素元素符号的意义表示一种元素表示该元素的一个原子H表示氢元素表示一个氢原子部分元素符号有三种意义:②一个铁原子①铁元素FeC③铁这种物质①碳元素②一个碳原子③碳这种物质Ne①表示氖元素②表示一个氖原子③表示氖气具有三种意义的元素符号有:
Cu、Fe、Hg等金属元素、稀有气体元素以及C、P、S、Si等固态非金属元素。元素符号前的数字:表示原子个数 ,如2N
离子符号前面的数字:表示离子个数 ,如2Mg2+
元素符号右上角的数字:表示该离子所带的电荷数 ,如Mg2+
物质发生化学变化时,分子一定发生变化,原子不发生变化,元素也不发生变化。氩元素水分子氨分子氧元素在单核粒子中,如果质子数相同,属于同种元素。元素和原子的区别和联系质子数(即核电荷数) 相同的一类原子的总称。化学变化中的最小粒子。宏观概念,只讲种类,不讲个数。描述物质的宏观组成。水是由氢元素和氧元素组成的。微观概念,既讲种类,又讲个数。描述微观构成。水分子是由氢原子和氧原子构成的。
碳是由碳原子构成的。【例9】科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。据此推断,当一种元素的原子经过放射变化后,结果变成了另一种元素的原子。它一定是放射了( )
A.电子 B.中子
C.质子 D.该原子的原子核【练习8】下列符号中,既能表示一种元素,又能表示一种元素的一个原子,还能代表一种物质的是( )
A.N2 B. O
C. P D. Fe
CCD【练习 9】若用“ ”表示氢原子,下列方框中,符合2H意义的示意图是( )
A【例10】今有四种粒子的结构示意图,下列说法正确的是( )
① ② ③ ④
A.它们表示四种元素
B.④表示的元素是非金属元素
C.①④表示的是阳离子
D.①③④的电子层排布相同
D(2)钠、镁、铝均属于 元素(选填“金属”或“非金属”),它们的原子在化学反应中易 (选填“得到”或“失去”)电子而形成 (选填“阳”或“阴”)离子,其中地壳中含量最多的金属元素形成的离子其符号是 。
?
(3)钙元素的原子结构示意图为 ,据此推测,
钙元素在元素周期表中的位置应该是 (选填“A”“B”或“C”)。【例11】根据下表提供的信息,回答下列问题。
(1)氢元素的元素符号为 ,钠元素的原子序数是 ,镁原子最外层有 个电子。H112金属失去阳Al3+B元素周期表1.元素周期表上分两大区域2.横行——周期3.纵行——族7个横行就是7个周期18个纵行16个族(8、9、10三个纵行共同组成一个族)金属和非金属五、物质的分类、组成、构成6 C碳12.01原子序数核电荷数质子数元素符号元素名称相对原子质量原子序数=核电荷数=质子数由元素周期表能获得元素的如下信息:纯净物
混合物物质物质的初步分类宏观:由一种物质组成。宏观:由两种或两种以上的物质混合而成。微观:只含一种分子(由分子构成的物质)微观:含有多种分子。(由分子构成的物质)根据下列的图形给物质分类(混合物、纯净物)纯净物纯净物混合物纯净物【练习10】在横线上填上相应物质的序号:①盐水 ②液氧 ③洁净空气 ④硫磺 ⑤铝 ⑥冰水混合物 ⑦氯酸钾 ⑧氯化钾
(1)属于混合物的是 。
(2)属于纯净物的是 。注意:若名称是“某酸某”或“某化某”一定是纯净物。②④⑤⑥⑦⑧①③物质构成分子构成原子构成元素同类原子
总称离子组成构成分解1.二氧化碳由 组成;
二氧化碳由 构成。
2.汞由 组成;
汞由 构成。
3.硫酸铜(CuSO4)由 组成;
硫酸铜(CuSO4)由 构成。
4.二氧化碳分子由 构成。
练习铜元素、硫元素、氧元素汞元素碳元素和氧元素汞原子碳原子和氧原子铜离子和硫酸根离子二氧化碳 分子【例12】关于分子、原子、离子的说法中,正确的是( )
A.分子、原子、离子都是构成物质的粒子
B.只有带电的原子才叫离子
C.原子是构成物质的最小粒子
D.分子是化学变化中的最小粒子
A谢谢21世纪教育网(www.21cnjy.com) 中小学教育资源网站 有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
