人教版高中化学必修1第二章《化学物质及其变化》单元测试题(解析版)
文档属性
| 名称 | 人教版高中化学必修1第二章《化学物质及其变化》单元测试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 85.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-09-29 14:49:56 | ||
图片预览




文档简介
必修1第二章《化学物质及其变化》单元测试题
一、单选题(每小题只有一个正确答案)
1.某物质经分析知道其中只含有两种元素,此物质不可能是( )
A. 化合物
B. 纯净物
C. 混合物
D. 单质
2.点燃的镁条能在氨气中剧烈燃烧,发生如下反应:Mg+2NH3Mg(NH2)2+H2,对该反应说法正确的是( )
A. NH3既是氧化剂又是还原剂
B. 氢元素既被氧化又被还原
C. 0.5 mol氢气生成时转移1 mol电子
D. 镁具有氧化性
3.下列离子组在强酸性溶液中能大量共存是( )
A. K+、Fe2+、、Cl﹣
B. Na+、Fe3+、SCN﹣、
C. K+、Na+、Cl﹣、
D. Al3+、Na+、C1﹣、
4.在酸性溶液中能大量共存的离子组是( )
A. OH﹣、、Na+
B. Cu2+、、OH﹣
C. Ba2+、K+、
D. Ag+、Cl﹣、
5.下列反应中属于氧化还原反应的是( )
①3Cl2+6KOH===5KCl+KClO3+3H2O
②2NO2+2NaOH===NaNO3+NaNO2+H2O
③SnCl4+2H2O===SnO2+4HCl
④NaOH+HCl===H2O+NaCl
A. ①②
B. ②③
C. ①③
D. ③④
6.某无色透明溶液中,能大量共存的离子组是( )
A. Cu2+、Na+、、Cl﹣
B. Ba2+、Na+、OH﹣、
C. OH﹣、HCO3﹣、Ca2+、Na+
D. K+、Na+、OH﹣、NO3﹣
7.下列分散系属于胶体的是( )
A. 矿泉水
B. 生理盐水
C. 豆浆
D. 白酒
8.不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 都比较稳定,密封放置不产生沉淀
B. 都有丁达尔效应
C. 加入少量NaOH溶液都可产生沉淀
D. 分散质微粒均可透过滤纸
9.下列对于NaHSO4的分类中不正确的是( )
A. NaHSO4是盐
B. NaHSO4是酸式盐
C. NaHSO4是钠盐
D. NaHSO4是酸
10.下列有关电解质的说法中正确的是( )
A. 氢氧化钠固体溶于水后能导电,所以氢氧化钠是电解质
B. 二氧化碳水溶液能够导电,所以二氧化碳是电解质
C. 铁、铜能导电,所以铁、铜为电解质
D. 氯化铁溶液能够导电,所以氯化铁溶液是电解质
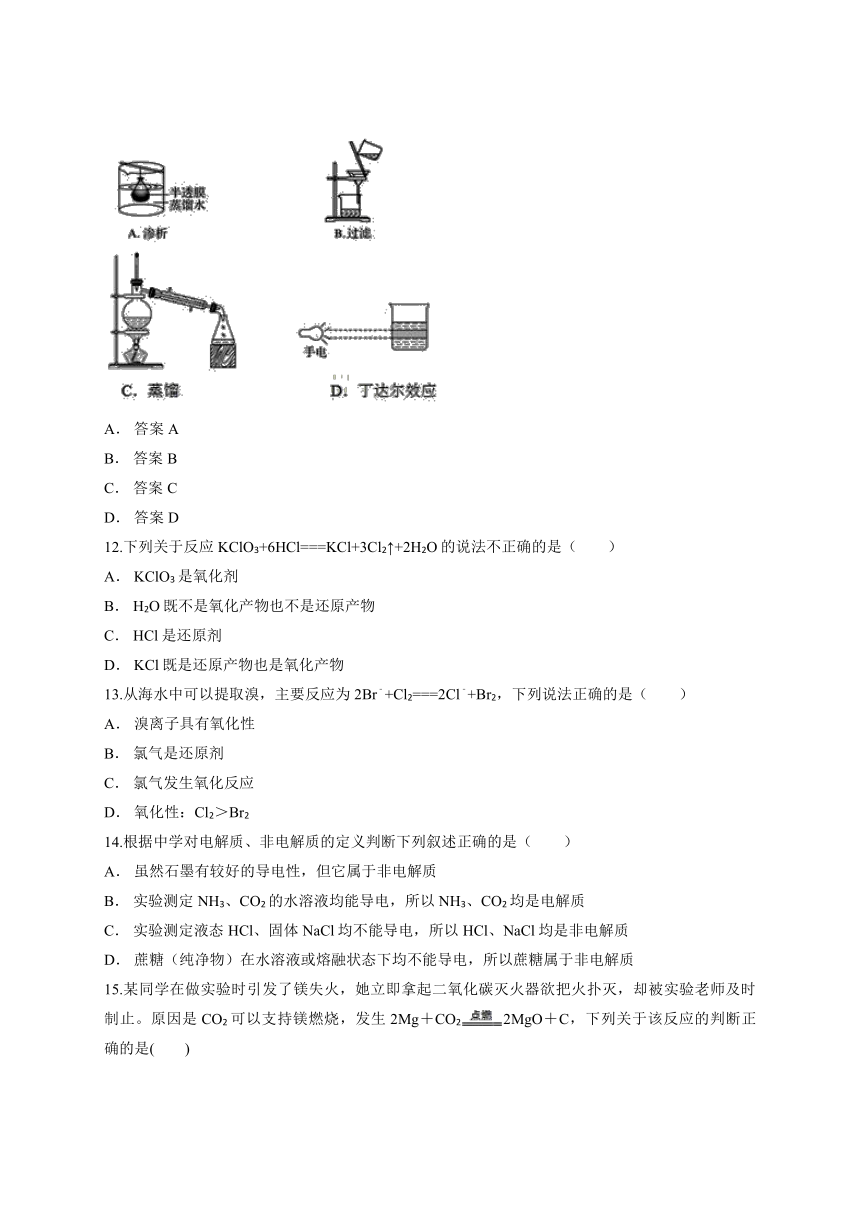
11.下列实验装置或操作与微粒的大小无直接关系的是( )
A. 答案A
B. 答案B
C. 答案C
D. 答案D
12.下列关于反应KClO3+6HCl===KCl+3Cl2↑+2H2O的说法不正确的是( )
A. KClO3是氧化剂
B. H2O既不是氧化产物也不是还原产物
C. HCl是还原剂
D. KCl既是还原产物也是氧化产物
13.从海水中可以提取溴,主要反应为2Br﹣+Cl2===2Cl﹣+Br2,下列说法正确的是( )
A. 溴离子具有氧化性
B. 氯气是还原剂
C. 氯气发生氧化反应
D. 氧化性:Cl2>Br2
14.根据中学对电解质、非电解质的定义判断下列叙述正确的是( )
A. 虽然石墨有较好的导电性,但它属于非电解质
B. 实验测定NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 实验测定液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D. 蔗糖(纯净物)在水溶液或熔融状态下均不能导电,所以蔗糖属于非电解质
15.某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO22MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
二、填空题
16.用双线桥法标出下列反应电子转移的方向和数目。
(1)4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
(2)2KClO32KCl+3O2↑
(3)Cl2+2NaOH===NaClO+NaCl+H2O
(4)2H2O22H2O+O2↑
(5)S+2H2SO4(浓)3SO2↑+2H2O
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
(8)2KMnO4K2MnO4+MnO2+O2↑
17.(12分)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):
①________;②________;③________。
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________(填“是”或“不是”)氧化还原反应。
(3)写出物质C与足量稀硫酸反应的离子方程式:_______________________________
________________________________________________________________________。
(4)HCO3-与H+、OH-在溶液都不能大量共存,试用离子方程式说明________________________________________________________________________
________________________________________________________________________。
18.写出下列物质在水溶液中的电离方程式。
(1)Fe2(SO4)3______________________;
(2)CuCl2______________________;
(3)KClO3______________________;
(4)Na2CO3______________________;
(5)Ca(HCO3)2______________________;
(6)KAl(SO4)2______________________。
19.某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、六种离子。
(1)甲厂废水明显呈碱性,故甲厂废水中含有的三种离子是_____________________(填离子符号),乙厂的废水中一定含有的阴离子是_____________________(填离子符号),加入铁粉后可回收某种金属,写出该反应的离子方程式:________________________。
(2)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________(填写离子符号)转化为沉淀。经过滤后的废水主要含_______________(填化学式),可以用来浇灌农田。
20.某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填入以下空格内。
(2)反应过程中,被氧化与被还原的元素的物质的量之比为____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:_______________________。
三、实验题
21.Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于________(填“纯净物”或者“混合物”)。将其加入适量盐酸,反应的化学方程式:___________________________________________________________
________________________________________________________________________。
(2)用上述所得溶液进行下列实验:取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀产生,反应的离子方程式:________________________________________________。
(3)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现________色,即可制得Fe(OH)3胶体。
(4)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________烧杯的液体中产生了丁达尔效应。
22.某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:_______________________________________、
________________________________________________________________________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入________。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入________________,使沉淀完全溶解。
④将所得溶液蒸发、结晶,得到纯净的硝酸钙晶体。
四、计算题
23.已知反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为?
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是?
答案解析
1.【答案】D
【解析】只含有两种元素的物质,不可能是单质;可能是化合物或纯净物(如一氧化碳);也可能是混合物(如一氧化碳和二氧化碳的混合气体)。
2.【答案】C
【解析】反应中氢元素化合价从+1价降到0价,得到电子,被还原,NH3是氧化剂,镁是还原剂,A、B错误;氢元素化合价从+1价降到0价,得到1个电子,0.5 mol氢气生成时转移1 mol电子,C正确;镁具有还原性,D错误。
3.【答案】D
【解析】H+、Fe2+、发生氧化还原反应,不能共存,故A不选;
Fe3+、SCN﹣结合生成络合物,不能共存,故B不选;
酸溶液中不能大量存在,故C不选;
酸溶液中该组离子之间不反应,可大量共存,故D选。
4.【答案】C
【解析】酸性溶液中存在大量氢离子。
OH﹣、之间发生反应,且二者都与氢离子反应,在溶液中不能大量共存,A错误;
Cu2+、OH﹣之间发生反应,OH﹣与氢离子反应,在溶液中不能大量共存,B错误;
Ba2+、K+、之间不发生反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,C正确;
Ag+与Cl﹣、之间发生反应,在溶液中不能大量共存,D错误。
5.【答案】A
【解析】凡是有化合价升降的反应均是氧化还原反应,通过判断反应中各物质所含元素在反应前后的价态可知,①、②项中的反应有化合价的升降。
6.【答案】D
【解析】Cu2+为有色离子,不满足溶液为无色溶液的条件,故A错误;
Ba2+、之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
OH﹣、、Ca2+之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故C错误;
K+、Na+、OH﹣、之间不发生反应,且都是无色离子,在溶液中能够大量共存,故D正确;故选D。
7.【答案】C
【解析】矿泉水、生理盐水、白酒是溶液,豆浆分散质微粒直径在1~100 nm之间,属于胶体。
8.【答案】B
【解析】 溶液和胶体外观基本一致,一般为均一、透明、稳定的溶液,A不符合题意;胶体能产生丁达尔效应而溶液不能,B符合题意;向Fe(OH)3胶体中加入NaOH溶液,会使胶体发生聚沉,产生Fe(OH)3沉淀,而MgCl2与NaOH反应生成Mg(OH)2沉淀,C不符合题意;胶体和溶液的分散质粒子均可透过滤纸,D不符合题意。
9.【答案】D
【解析】硫酸氢钠在水溶液中完全电离产生钠离子、氢离子和硫酸根离子,所以硫酸氢钠属于酸式盐、钠盐,故选D。
10.【答案】A
【解析】二氧化碳水溶液能导电,是因为二氧化碳溶于水生成的碳酸溶液导电,二氧化碳是非电解质,B项错误;铁、铜是单质,不是电解质,C项错误;氯化铁溶液是混合物,氯化铁溶液既不是电解质,也不是非电解质,D项错误。
11.【答案】C
【解析】胶体粒子直径在1~100 nm之间,能透过滤纸,但不能透过半透膜,溶液中的粒子直径小于1 nm,可透过半透膜和滤纸,而浊液的分散质粒子直径大于100 nm,不能透过滤纸和半透膜,故渗析、过滤与微粒大小有关。蒸馏是利用了物质沸点不同分离互溶液体的方法,与分散质粒子大小无关。丁达尔效应是胶体粒子对光线的散射作用形成的,而溶液和浊液没有丁达尔效应,故丁达尔效应与微粒大小有关。
12.【答案】D
【解析】KClO3中Cl元素的化合价由+5价降低为0,KClO3是氧化剂,A正确;
H、O元素的化合价不变,H2O既不是氧化产物也不是还原产物,B正确;
HCl中Cl元素的化合价由﹣1价升高为0,HCl为还原剂,C正确;
氯气既是还原产物也是氧化产物,KCl中元素的化合价不变,KCl既不是氧化产物也不是还原产物,D错误。
13.【答案】D
【解析】反应2Br﹣+Cl2===2Cl﹣+Br2中Cl元素化合价降低,Cl2为氧化剂,Br元素化合价升高,被氧化,Br﹣为还原剂。
溴离子化合价处于最低价态,只具有还原性,A错误;
反应中Cl元素化合价降低,Cl2为氧化剂,发生还原反应,B、C错误;
根据氧化剂氧化性大于氧化产物氧化性可知,氧化性:Cl2>Br2,D正确。
14.【答案】D
【解析】非电解质必须是化合物,A错误;NH3、CO2的水溶液均能导电,溶液中的离子是氨水、碳酸电离出的,不是NH3、CO2电离出的,所以NH3、CO2是非电解质,B错误;液态HCl、固体NaCl均不能导电,但它们在水溶液里能电离出自由移动的离子,是电解质,C错误;蔗糖(纯净物)在水溶液或熔融状态下均不能导电,属于非电解质,D正确。
15.【答案】B
【解析】标出变价元素化合价,用双线桥画出电子转移方向,根据概念即可分析得出答案。,所以MgO是氧化产物,A错误;氧化剂是CO2,氧化产物是MgO,氧化性为CO2>MgO,还原剂是 Mg,还原产物是C,还原性Mg>C,B正确;CO2作氧化剂,化合价降低,被还原,发生还原反应,C错误;氧元素没变价,所以氧原子不可能得电子,D错误。
16.【答案】
【解析】计算、对比方程式中变价元素化合价的升降,确定元素化合价变化;结合在氧化还原反应中,若元素的化合价升高,则失去电子,发生氧化反应(被氧化);若元素的化合价降低,则得到电子,发生还原反应(被还原)。确定元素得电子还是失电子;然后计算得失电子的个数:得失电子的数目=化合价的变化值×化合物中变价元素原子个数×该化合物的化学计量数。
17.【答案】 (1)CO2 H2O Na2CO3 (2)不是 (3)CO32-+2H+===H2O+CO2↑ (4)HCO3-+H+===CO2↑+H2O、HCO3-+OH-===CO32-+H2O
【解析】 (1)①中CO2是非金属氧化物,其他都是金属氧化物;②中H2O不是酸,其他都是酸;③中Na2CO3是盐,其他都是碱。
(2)化学反应为Na2CO3+CO2+H2O===2NaHCO3,反应中没有元素价态变化,不是氧化还原反应。
18.【答案】(1)Fe2(SO4)3===2Fe3++3
(2)CuCl2===Cu2++2Cl-
(3)KClO3===K++
(4)Na2CO3===2Na++
(5)Ca(HCO3)2===Ca2++2H
(6)KAl(SO4)2===K++Al3++2
【解析】
19.【答案】(1)OH-、Cl-、K+ Fe+2Ag+===Fe2++2Ag
(2)Ag+、Fe3+、Cl-、OH- KNO3
【解析】(1)甲厂的废水明显呈碱性,必定含有OH-,则Ag+、Fe3+不可能存在于甲厂的废水中,而必定存在于乙厂的废水中,由于Cl-和Ag+不能大量共存,推出Cl-不可能存在于乙厂的废水中,而存在于甲厂的废水中,一种溶液中必定同时存在阴、阳离子,所以必定存在于乙厂的废水中。推知甲厂废水中含有OH-、Cl-、K+。乙厂废水中含有Ag+、Fe3+、,加入铁粉可以置换出溶液中的银。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的Ag+、Cl-、Fe3+、OH-化为沉淀,过滤所得的废水中主要含KNO3。
20.【答案】(1)H2O NO HNO3 (2)1∶2
(3)
【解析】(1)NF3中N元素的化合价由+3价升高为+5价,由+3价降低为+2价,发生自身氧化还原反应生成NO和HNO3,则该反应为NF3+H2O―→HF+NO+HNO3。(2)生成硝酸时失去电子被氧化,生成NO时得到电子被还原,由电子守恒可知,被氧化与被还原的元素的物质的量之比为1∶2。(3)由电子守恒及原子守恒可知,该反应为3NF3+5H2O===9HF+2NO+HNO3。
21.【答案】 (1)纯净物 Fe2O3+ 6HCl===2FeCl3+ 3H2O (2)Fe3++ 3OH-===Fe(OH)3↓ (3)红褐 (4)乙
【解析】 (1)Fe2O3固体(红棕色)只含一种物质,属于纯净物;氧化铁属于碱性氧化物,和酸反应生成铁盐和水,化学方程式为Fe2O3+6HCl===2FeCl3+3H2O。(2)氯化铁和NaOH发生复分解反应,生成红褐色沉淀氢氧化铁,同时生成NaCl,离子方程式为Fe3++3OH-===Fe(OH)3↓。(3)将蒸馏水加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现红褐色,得到氢氧化铁胶体。(4)甲烧杯中液体为溶液、乙烧杯中液体为胶体,胶体中分散质粒子直径在1~100 nm之间,溶液中分散质粒子直径小于1 nm,胶体能产生丁达尔效应,所以乙产生丁达尔效应。
22.【答案】 (1)Ca2++CO32-===CaCO3↓ CaCO3+2H+===Ca2++CO2↑+H2O (2)①碳酸钠溶液 ③稀硝酸
【解析】 正确理解题中信息,写出相应方程式再改写成离子方程式即可。
23.【答案】(1)4∶1 (2)42 g
【解析】从反应方程式可知3 mol Cu被氧化时,参加反应的HNO3为8 mol,但其中只有2 mol HNO3得到电子被还原(从化合价分析可以判断),因此3 mol Cu还原2 mol HNO3,即应按3Cu~2HNO3这一关系式进行计算。
n(Cu)==1 mol,
3Cu―→2HNO3
3 mol 2 mol
1 mol mol
m(HNO3)=63 g·mol-1×mol=42 g。
一、单选题(每小题只有一个正确答案)
1.某物质经分析知道其中只含有两种元素,此物质不可能是( )
A. 化合物
B. 纯净物
C. 混合物
D. 单质
2.点燃的镁条能在氨气中剧烈燃烧,发生如下反应:Mg+2NH3Mg(NH2)2+H2,对该反应说法正确的是( )
A. NH3既是氧化剂又是还原剂
B. 氢元素既被氧化又被还原
C. 0.5 mol氢气生成时转移1 mol电子
D. 镁具有氧化性
3.下列离子组在强酸性溶液中能大量共存是( )
A. K+、Fe2+、、Cl﹣
B. Na+、Fe3+、SCN﹣、
C. K+、Na+、Cl﹣、
D. Al3+、Na+、C1﹣、
4.在酸性溶液中能大量共存的离子组是( )
A. OH﹣、、Na+
B. Cu2+、、OH﹣
C. Ba2+、K+、
D. Ag+、Cl﹣、
5.下列反应中属于氧化还原反应的是( )
①3Cl2+6KOH===5KCl+KClO3+3H2O
②2NO2+2NaOH===NaNO3+NaNO2+H2O
③SnCl4+2H2O===SnO2+4HCl
④NaOH+HCl===H2O+NaCl
A. ①②
B. ②③
C. ①③
D. ③④
6.某无色透明溶液中,能大量共存的离子组是( )
A. Cu2+、Na+、、Cl﹣
B. Ba2+、Na+、OH﹣、
C. OH﹣、HCO3﹣、Ca2+、Na+
D. K+、Na+、OH﹣、NO3﹣
7.下列分散系属于胶体的是( )
A. 矿泉水
B. 生理盐水
C. 豆浆
D. 白酒
8.不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 都比较稳定,密封放置不产生沉淀
B. 都有丁达尔效应
C. 加入少量NaOH溶液都可产生沉淀
D. 分散质微粒均可透过滤纸
9.下列对于NaHSO4的分类中不正确的是( )
A. NaHSO4是盐
B. NaHSO4是酸式盐
C. NaHSO4是钠盐
D. NaHSO4是酸
10.下列有关电解质的说法中正确的是( )
A. 氢氧化钠固体溶于水后能导电,所以氢氧化钠是电解质
B. 二氧化碳水溶液能够导电,所以二氧化碳是电解质
C. 铁、铜能导电,所以铁、铜为电解质
D. 氯化铁溶液能够导电,所以氯化铁溶液是电解质
11.下列实验装置或操作与微粒的大小无直接关系的是( )
A. 答案A
B. 答案B
C. 答案C
D. 答案D
12.下列关于反应KClO3+6HCl===KCl+3Cl2↑+2H2O的说法不正确的是( )
A. KClO3是氧化剂
B. H2O既不是氧化产物也不是还原产物
C. HCl是还原剂
D. KCl既是还原产物也是氧化产物
13.从海水中可以提取溴,主要反应为2Br﹣+Cl2===2Cl﹣+Br2,下列说法正确的是( )
A. 溴离子具有氧化性
B. 氯气是还原剂
C. 氯气发生氧化反应
D. 氧化性:Cl2>Br2
14.根据中学对电解质、非电解质的定义判断下列叙述正确的是( )
A. 虽然石墨有较好的导电性,但它属于非电解质
B. 实验测定NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 实验测定液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D. 蔗糖(纯净物)在水溶液或熔融状态下均不能导电,所以蔗糖属于非电解质
15.某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO22MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
二、填空题
16.用双线桥法标出下列反应电子转移的方向和数目。
(1)4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
(2)2KClO32KCl+3O2↑
(3)Cl2+2NaOH===NaClO+NaCl+H2O
(4)2H2O22H2O+O2↑
(5)S+2H2SO4(浓)3SO2↑+2H2O
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
(8)2KMnO4K2MnO4+MnO2+O2↑
17.(12分)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):
①________;②________;③________。
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________(填“是”或“不是”)氧化还原反应。
(3)写出物质C与足量稀硫酸反应的离子方程式:_______________________________
________________________________________________________________________。
(4)HCO3-与H+、OH-在溶液都不能大量共存,试用离子方程式说明________________________________________________________________________
________________________________________________________________________。
18.写出下列物质在水溶液中的电离方程式。
(1)Fe2(SO4)3______________________;
(2)CuCl2______________________;
(3)KClO3______________________;
(4)Na2CO3______________________;
(5)Ca(HCO3)2______________________;
(6)KAl(SO4)2______________________。
19.某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、六种离子。
(1)甲厂废水明显呈碱性,故甲厂废水中含有的三种离子是_____________________(填离子符号),乙厂的废水中一定含有的阴离子是_____________________(填离子符号),加入铁粉后可回收某种金属,写出该反应的离子方程式:________________________。
(2)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________(填写离子符号)转化为沉淀。经过滤后的废水主要含_______________(填化学式),可以用来浇灌农田。
20.某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填入以下空格内。
(2)反应过程中,被氧化与被还原的元素的物质的量之比为____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:_______________________。
三、实验题
21.Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于________(填“纯净物”或者“混合物”)。将其加入适量盐酸,反应的化学方程式:___________________________________________________________
________________________________________________________________________。
(2)用上述所得溶液进行下列实验:取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀产生,反应的离子方程式:________________________________________________。
(3)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现________色,即可制得Fe(OH)3胶体。
(4)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________烧杯的液体中产生了丁达尔效应。
22.某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:_______________________________________、
________________________________________________________________________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入________。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入________________,使沉淀完全溶解。
④将所得溶液蒸发、结晶,得到纯净的硝酸钙晶体。
四、计算题
23.已知反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为?
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是?
答案解析
1.【答案】D
【解析】只含有两种元素的物质,不可能是单质;可能是化合物或纯净物(如一氧化碳);也可能是混合物(如一氧化碳和二氧化碳的混合气体)。
2.【答案】C
【解析】反应中氢元素化合价从+1价降到0价,得到电子,被还原,NH3是氧化剂,镁是还原剂,A、B错误;氢元素化合价从+1价降到0价,得到1个电子,0.5 mol氢气生成时转移1 mol电子,C正确;镁具有还原性,D错误。
3.【答案】D
【解析】H+、Fe2+、发生氧化还原反应,不能共存,故A不选;
Fe3+、SCN﹣结合生成络合物,不能共存,故B不选;
酸溶液中不能大量存在,故C不选;
酸溶液中该组离子之间不反应,可大量共存,故D选。
4.【答案】C
【解析】酸性溶液中存在大量氢离子。
OH﹣、之间发生反应,且二者都与氢离子反应,在溶液中不能大量共存,A错误;
Cu2+、OH﹣之间发生反应,OH﹣与氢离子反应,在溶液中不能大量共存,B错误;
Ba2+、K+、之间不发生反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,C正确;
Ag+与Cl﹣、之间发生反应,在溶液中不能大量共存,D错误。
5.【答案】A
【解析】凡是有化合价升降的反应均是氧化还原反应,通过判断反应中各物质所含元素在反应前后的价态可知,①、②项中的反应有化合价的升降。
6.【答案】D
【解析】Cu2+为有色离子,不满足溶液为无色溶液的条件,故A错误;
Ba2+、之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
OH﹣、、Ca2+之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故C错误;
K+、Na+、OH﹣、之间不发生反应,且都是无色离子,在溶液中能够大量共存,故D正确;故选D。
7.【答案】C
【解析】矿泉水、生理盐水、白酒是溶液,豆浆分散质微粒直径在1~100 nm之间,属于胶体。
8.【答案】B
【解析】 溶液和胶体外观基本一致,一般为均一、透明、稳定的溶液,A不符合题意;胶体能产生丁达尔效应而溶液不能,B符合题意;向Fe(OH)3胶体中加入NaOH溶液,会使胶体发生聚沉,产生Fe(OH)3沉淀,而MgCl2与NaOH反应生成Mg(OH)2沉淀,C不符合题意;胶体和溶液的分散质粒子均可透过滤纸,D不符合题意。
9.【答案】D
【解析】硫酸氢钠在水溶液中完全电离产生钠离子、氢离子和硫酸根离子,所以硫酸氢钠属于酸式盐、钠盐,故选D。
10.【答案】A
【解析】二氧化碳水溶液能导电,是因为二氧化碳溶于水生成的碳酸溶液导电,二氧化碳是非电解质,B项错误;铁、铜是单质,不是电解质,C项错误;氯化铁溶液是混合物,氯化铁溶液既不是电解质,也不是非电解质,D项错误。
11.【答案】C
【解析】胶体粒子直径在1~100 nm之间,能透过滤纸,但不能透过半透膜,溶液中的粒子直径小于1 nm,可透过半透膜和滤纸,而浊液的分散质粒子直径大于100 nm,不能透过滤纸和半透膜,故渗析、过滤与微粒大小有关。蒸馏是利用了物质沸点不同分离互溶液体的方法,与分散质粒子大小无关。丁达尔效应是胶体粒子对光线的散射作用形成的,而溶液和浊液没有丁达尔效应,故丁达尔效应与微粒大小有关。
12.【答案】D
【解析】KClO3中Cl元素的化合价由+5价降低为0,KClO3是氧化剂,A正确;
H、O元素的化合价不变,H2O既不是氧化产物也不是还原产物,B正确;
HCl中Cl元素的化合价由﹣1价升高为0,HCl为还原剂,C正确;
氯气既是还原产物也是氧化产物,KCl中元素的化合价不变,KCl既不是氧化产物也不是还原产物,D错误。
13.【答案】D
【解析】反应2Br﹣+Cl2===2Cl﹣+Br2中Cl元素化合价降低,Cl2为氧化剂,Br元素化合价升高,被氧化,Br﹣为还原剂。
溴离子化合价处于最低价态,只具有还原性,A错误;
反应中Cl元素化合价降低,Cl2为氧化剂,发生还原反应,B、C错误;
根据氧化剂氧化性大于氧化产物氧化性可知,氧化性:Cl2>Br2,D正确。
14.【答案】D
【解析】非电解质必须是化合物,A错误;NH3、CO2的水溶液均能导电,溶液中的离子是氨水、碳酸电离出的,不是NH3、CO2电离出的,所以NH3、CO2是非电解质,B错误;液态HCl、固体NaCl均不能导电,但它们在水溶液里能电离出自由移动的离子,是电解质,C错误;蔗糖(纯净物)在水溶液或熔融状态下均不能导电,属于非电解质,D正确。
15.【答案】B
【解析】标出变价元素化合价,用双线桥画出电子转移方向,根据概念即可分析得出答案。,所以MgO是氧化产物,A错误;氧化剂是CO2,氧化产物是MgO,氧化性为CO2>MgO,还原剂是 Mg,还原产物是C,还原性Mg>C,B正确;CO2作氧化剂,化合价降低,被还原,发生还原反应,C错误;氧元素没变价,所以氧原子不可能得电子,D错误。
16.【答案】
【解析】计算、对比方程式中变价元素化合价的升降,确定元素化合价变化;结合在氧化还原反应中,若元素的化合价升高,则失去电子,发生氧化反应(被氧化);若元素的化合价降低,则得到电子,发生还原反应(被还原)。确定元素得电子还是失电子;然后计算得失电子的个数:得失电子的数目=化合价的变化值×化合物中变价元素原子个数×该化合物的化学计量数。
17.【答案】 (1)CO2 H2O Na2CO3 (2)不是 (3)CO32-+2H+===H2O+CO2↑ (4)HCO3-+H+===CO2↑+H2O、HCO3-+OH-===CO32-+H2O
【解析】 (1)①中CO2是非金属氧化物,其他都是金属氧化物;②中H2O不是酸,其他都是酸;③中Na2CO3是盐,其他都是碱。
(2)化学反应为Na2CO3+CO2+H2O===2NaHCO3,反应中没有元素价态变化,不是氧化还原反应。
18.【答案】(1)Fe2(SO4)3===2Fe3++3
(2)CuCl2===Cu2++2Cl-
(3)KClO3===K++
(4)Na2CO3===2Na++
(5)Ca(HCO3)2===Ca2++2H
(6)KAl(SO4)2===K++Al3++2
【解析】
19.【答案】(1)OH-、Cl-、K+ Fe+2Ag+===Fe2++2Ag
(2)Ag+、Fe3+、Cl-、OH- KNO3
【解析】(1)甲厂的废水明显呈碱性,必定含有OH-,则Ag+、Fe3+不可能存在于甲厂的废水中,而必定存在于乙厂的废水中,由于Cl-和Ag+不能大量共存,推出Cl-不可能存在于乙厂的废水中,而存在于甲厂的废水中,一种溶液中必定同时存在阴、阳离子,所以必定存在于乙厂的废水中。推知甲厂废水中含有OH-、Cl-、K+。乙厂废水中含有Ag+、Fe3+、,加入铁粉可以置换出溶液中的银。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的Ag+、Cl-、Fe3+、OH-化为沉淀,过滤所得的废水中主要含KNO3。
20.【答案】(1)H2O NO HNO3 (2)1∶2
(3)
【解析】(1)NF3中N元素的化合价由+3价升高为+5价,由+3价降低为+2价,发生自身氧化还原反应生成NO和HNO3,则该反应为NF3+H2O―→HF+NO+HNO3。(2)生成硝酸时失去电子被氧化,生成NO时得到电子被还原,由电子守恒可知,被氧化与被还原的元素的物质的量之比为1∶2。(3)由电子守恒及原子守恒可知,该反应为3NF3+5H2O===9HF+2NO+HNO3。
21.【答案】 (1)纯净物 Fe2O3+ 6HCl===2FeCl3+ 3H2O (2)Fe3++ 3OH-===Fe(OH)3↓ (3)红褐 (4)乙
【解析】 (1)Fe2O3固体(红棕色)只含一种物质,属于纯净物;氧化铁属于碱性氧化物,和酸反应生成铁盐和水,化学方程式为Fe2O3+6HCl===2FeCl3+3H2O。(2)氯化铁和NaOH发生复分解反应,生成红褐色沉淀氢氧化铁,同时生成NaCl,离子方程式为Fe3++3OH-===Fe(OH)3↓。(3)将蒸馏水加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现红褐色,得到氢氧化铁胶体。(4)甲烧杯中液体为溶液、乙烧杯中液体为胶体,胶体中分散质粒子直径在1~100 nm之间,溶液中分散质粒子直径小于1 nm,胶体能产生丁达尔效应,所以乙产生丁达尔效应。
22.【答案】 (1)Ca2++CO32-===CaCO3↓ CaCO3+2H+===Ca2++CO2↑+H2O (2)①碳酸钠溶液 ③稀硝酸
【解析】 正确理解题中信息,写出相应方程式再改写成离子方程式即可。
23.【答案】(1)4∶1 (2)42 g
【解析】从反应方程式可知3 mol Cu被氧化时,参加反应的HNO3为8 mol,但其中只有2 mol HNO3得到电子被还原(从化合价分析可以判断),因此3 mol Cu还原2 mol HNO3,即应按3Cu~2HNO3这一关系式进行计算。
n(Cu)==1 mol,
3Cu―→2HNO3
3 mol 2 mol
1 mol mol
m(HNO3)=63 g·mol-1×mol=42 g。
