第五单元《化学方程式》复习课件
图片预览










文档简介
课件36张PPT。第五单元 化学方程式
复习课人教版 九年级上这是《初中化学课堂教学优化设计的实践探索》(人教版“初中化学教案” )一书的配套课件,这本书的形成历时十余年,是作者多年教学实践的积累,以“把每一节课当作礼物送给学生”作为设计追求!
购书可与作者联系,QQ:871003695;手机/微信:13990810599。
书到付款。
一、质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质质量总和。
理解时要注意三点:
①“参加”意味着反应物中过量的剩余部分的质量不应算在内。如蜡烛燃烧剩余的石蜡不算在内;又如在2H2 + O2 2H2O中,参加反应的H2 、O2与生成的H2O的质量比为4:32:36,如果H2 的质量是5份,O2的质量是32份,生成的H2O的质量是37份,还是36份?为什么?
②“总和”意味着把各种状态的反应物和生成物都算在内。如肉眼看不见的气体也应考虑。
③ 质量守恒定律仅适用化学变化。点燃化学反应质量守恒的原因在化学反应前后,原子的种类、数目、质量均未改变。3.化学反应中的“六个不变”、“两个一定变”、“一个可能变”
“六个不变”宏观: 微观: 反应物和生成物的总质量不变元素的种类不变同种元素质量不变原子的种类不变“两个一定变” 宏观:物质的种类一定变(生成了新的物质)微观:分子的种类一定变(生成了新的分子)“一个可能变”:原子的数目不变原子的质量不变分子的总数目可能变。2H2+O2 2H2O H2+Cl2 2HCl【例1】判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)根据质量守恒定律,1L氢气和1L氧气反应生成2L水。( )
(2)10 g水蒸发变成10 g水蒸气符合质量守恒定律。( )
(3).蜡烛完全燃烧后,蜡烛没有了,这违背了质量守恒定律。( )
(4)只有固体、液体间反应遵守质量守恒定律,如果有气体参加反应,就不遵守质量守恒定律。( )
(5)燃烧的镁条和生成的氧化镁质量相等。( )
(6)水在催化剂的作用下可变成燃油(主要含C、H)。( )
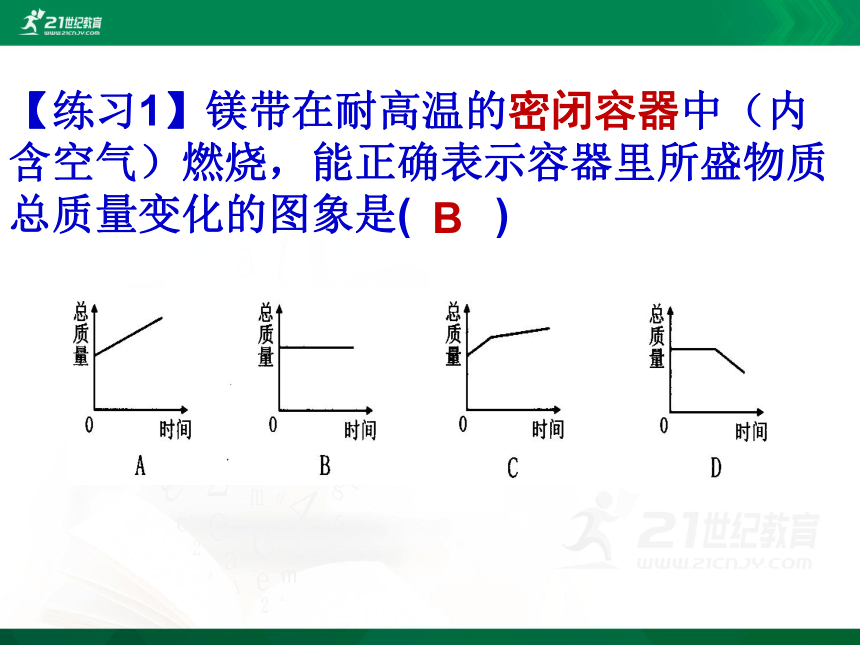
××××××【练习1】镁带在耐高温的密闭容器中(内含空气)燃烧,能正确表示容器里所盛物质总质量变化的图象是( )B【例2】氢气在氧气中燃烧,下列说法符合质量守恒定律的是( )
A.2克H2和7克O2反应生成9克H2O
B.1克H2和8克O2反应生成9克H2O
C.4克H2和5克O2反应生成9克H2O
D.5克H2和4克O2反应生成9克H2OB2H2+ O2 2H2O点燃4 : 32 : 361 : 8 : 9【练习3】a克过氧化氢溶液和b克二氧化锰混合, 待完全反应后得c克残余物, 则生成氧气的质量为( )
(a-c)克 B. (a + b-c)克
C. (a-b + c)克 D.(a-b-c)克
【练习2】根据2 CH3OH+3X+4NaOH=2Na2CO3+6H20,推求X的化学式为( )
A.O2 B.CO C.CO2 D.H2
AB【练习4】在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为_____。
解析:3×32+4×y=2×102y=27设Y的相对分子质量为y,根据质量守恒定律27【例3】(1)某物质在空气中完全燃烧生成CO2和H2O,该物质 碳元素, 氢元素, 氧元素。(选填“含有”、“不含有”、“可能含有”)。
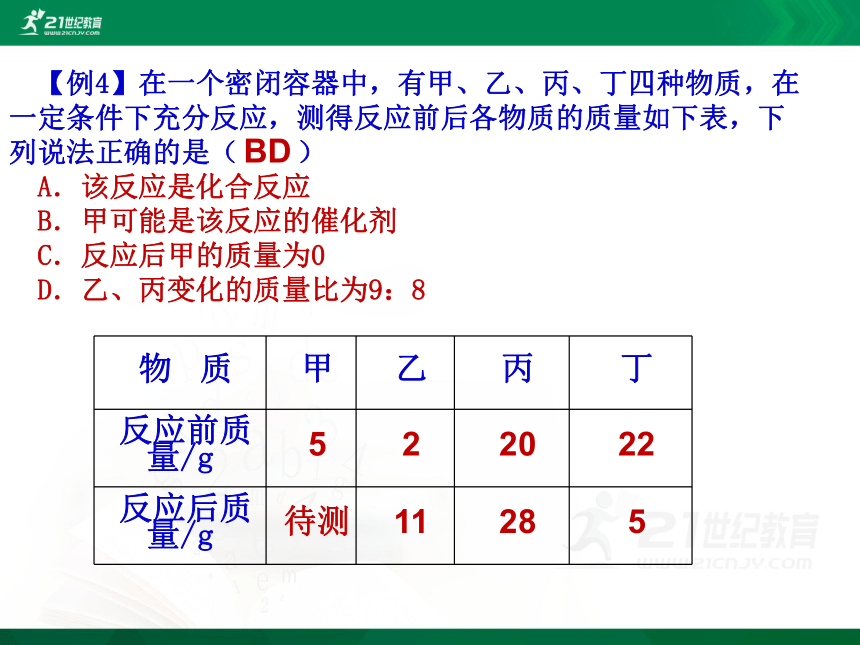
(2)4.6g某物质在空气中完全燃烧生成8.8g CO2和5.4gH2O,通过计算,该物质 碳元素, 氢元素, ____氧元素。(以上三空选填“含有”、“不含有”、“可能含有”)。其中碳元素 g,氢元素 g,氧元素 g。含有含有可能含有含有含有含有8.8g CO2含碳元素的质量为:5.4gH2O含氢元素的质量为:该物质含碳、氢元素的质量和为: 2.4g+0.6g=3g所以该物质还含氧元素,其质量为: 4.6g-3g=1.6g1.60.6 2.4【例4】在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )
A.该反应是化合反应
B.甲可能是该反应的催化剂
C.反应后甲的质量为0
D.乙、丙变化的质量比为9:8BD【例5】小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫酸( H2SO4 )在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:
(1)提出假设:物质发生化学变化后,总质量______(填“变”或“不变”)。
(2)设计实验方案:按你的假设小明设计了如图装置的实验,实验进行时把气球中的铁粉倒入稀硫酸中, 此反应的化学方程式为: 。反应后, 你认为天平最终能平衡吗?说出你的理由. 不变Fe + H2SO4 = FeSO4 + H2↑反应后, 天平最终不能平衡,因为生成了氢气,气球不会变瘪,气球在空气中会受到向上的浮力。二、化学方程式
1.定义:用化学式表示化学反应的式子
2.意义:
①表示反应物、生成物以及反应条件。②表示反应物、生成物之间的质量关系(即质量比)③表示反应物、生成物之间的粒子数关系(粒子个数比)例如:2H2 + O2 2H2O的意义
质的方面:表示在点燃条件下,氢气和氧气反应生成水。
量的方面:表示每4份质量的氢气和32份质量的氧气反应生成36份质量的水。
粒子方面:每2个氢分子和一个氧分子反应生成2个水分子。
点燃【练习5】化学方程式2H2+O2 2H2O的正确意义是( )
A.氢原子和氧原子在点燃条件下生成水分子
B.2份质量的氢气和1份质量的氧气在点燃条件下生成2份质量的水
C.氢气在氧气中燃烧生成水
D.氢元素和氧元素在点燃条件下生成水元素
点燃C3.化学方程式的书写
(1)原则
①必须以客观事实为基础,不能凭空臆想,臆造事实上不存在的物质和化学反应。
②遵守质量守恒定律,等号的两边各原子的种类与数目必须相等。
(2)书写步骤与方法
左边反应物,右边生成物;写准化学式,记住配系数;
中间连等号,条件要标注;生成气体或沉淀,要用箭号来体现。
注意:
①反应物无气体,而生成物有气体的,需要在生成物气体物质的化学式右边标“↑”。 ②在溶液中的反应,如果反应物没有固体,生成物有固体,需要在生成物固体物质的化学式右边标“↓”。 ③配平化学方程式时不能改动化学式右下角的数字。
【例6】配平下列化学方程式
(1)C3H8 + O2→ CO2+ H20
(2)C2H2 + O2→ CO2+ H20
(3)Fe2O3+ CO→ Fe+ CO2
三、有关化学方程式的计算
1.计算依据
①质量守恒定律:反应物质量总和等于生成物质量总和;
②方程式中各物质的质量之比等于它们的相对分子质量与化学计量数乘积之比
2.计算步骤:“设、方、关、比、算、答”
【例7】已知化学反应:2A + B = 2C + D,当10g A和8g B恰好完全反应后,生成6g C。如果要得到3g D,则参加反应的B物质的质量是( )
A.1g B.2g C.3g D.4g
【练习6】已知在反应3A+2B=2C+D中,反应物A、B的质量比为3:4。当反应生成C和D的质量共140g时,B消耗的质量为____ g。
B80【例8】让4g 氢气和16g 氧气充分反应后,生成水的质量为( )
A.12g B.16g C.18g D.20g 2H2+O2 2H2O点燃4 : 32 : 36解析:参加反应的氢气和氧气的质量比为4:324g 氢气要完全燃烧需要32g氧气,而氧气只有16g,故4g 氢气只有2g参加反应,故生成水的质量应为:2g+16g=18gC【例9】 如下图氯酸钾制氧气时,反应中二氧化锰在混合物中质量分数随时间变化的图象正确的是( )A【例10】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g,求:(1)、制取氧气的质量; ⑵剩余固体中含有哪些物质?各为多少克?分析 :MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以放出O2的质量为26.5g-16.9g=9.6g, 这9.6g是解本题的关键.
答:制得氧气的质量为9.6g,剩余固体中有KCl和MnO2 ,质量分别为14.9g和2g。MnO2解 :根据质量守恒定律 m(O2) = 26.5g-16.9g=9.6g设生成KCl的质量为x2KClO3 2KCl+3O2↑ 96x=14.9gMnO2的质量 为:16.9g – 14.9g = 2g x 9.6g【例10】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g,求:(1)制取氧气的质量; ⑵剩余固体中含有哪些物质?各为多少克? 答:制得氧气的质量为9.6g,剩余固体中有KCl和MnO2 ,质量分别为14.9g和2g。MnO2解 :设MnO2的质量为x,制得氧气的质量为y。2KClO3 2KCl + 3O2↑245 149 96x=2g氯化钾的质量 为:16.9g- 2g = 14.9g 26.5g- x 16. 9g-x yy=9.6g【例10】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g,求:(1)制取氧气的质量; ⑵剩余固体中含有哪些物质?各为多少克??【拓展提升1】有质量相等的两份氯酸钾,只向其中一份加入少量二氧化锰,同时放在两只试管内加热。下列有关放出氧的质量(g)与反应时间(t)的关系图象(图中a是纯氯酸钾的曲线,b是混有二氧化锰的曲线)中正确的是( )?ABCDc【拓展提升2】将A、B、C三种物质各10克,加热进行化合反应生在成D ,其中B是催化剂,当A完全反应后,生成D 16克,则反应后混合物中B与C的质量比是( )
A .5∶1 B. 5∶2
C.5∶3 D. 4∶1
B【拓展提升3】现有A、B、C三种物质各15克,充分反应后生成 D物质30克,此时C 已完全反应,若再加入10克C,A恰好完全反应,则参加反应的A与B的质量比( )
A.3∶2 B .2∶3
C.1∶1 D .3∶5
A【拓展提升4】在反应X+2Y=R+2M中,已知R和M的相对分子质量比为22∶9,当1.6gX与Y完全反应后,生成 4.4克R,则在反应中Y和M的质量比 。X + 2Y = R + 2M1.6g4.4g22 : 18?=3.6g?ˊY和M的质量比为6.4g :3.6g=16:9=6.4g16:9【拓展提升5】取一定量的高锰酸钾放入大试管中,充分加热直到不再产生气体为止。试求剩余固体中二氧化锰的质量分数。【解】设:高锰酸钾的质量为x,生成氧气的质量为y,生成二氧化锰的质量为z。2KMnO4 K2MnO4 + MnO2 + O2↑316 87 32x y z剩余固体中二氧化锰的质量分数为:答:剩余固体中二氧化锰的质量分数为30.6%。【拓展提升6】氧化铜(CuO)能被(H2)还原,化学方程式为:CuO+H2 Cu+ H2O,今有氧化铜与金属铜的混合物0.92克,被H2完全还原后,得到0.752克固体剩余物,求①原混合物中氧化铜的质量分数;②原混合物中铜元素的质量分数。(相对原子质量: Cu —64;O — 16)解:CuO中氧元素的质量为:0.92g-0.752g=0.168g原混合物中CuO的质量为:原混合物中CuO的质量分数为:原混合物中铜元素的质量为:原混合物中铜元素的质量分数为:答:原混合物中氧化铜的质量分数为91.3%;原混合物中铜元素的质量分数为81.74%。CuO + H2 Cu + H2O方法二解:设原混合物中单质铜的质量为x。0.92g-x0.752g-x80 64原混合物中氧化铜的质量为:0.92g-0.08g=0.84g以下略……【拓展提升6】氧化铜(CuO)能被(H2)还原,化学方程式为:CuO+H2 Cu+ H2O,今有氧化铜与金属铜的混合物0.92克,被H2完全还原后,得到0.752克固体剩余物,求①原混合物中氧化铜的质量分数;②原混合物中铜元素的质量分数。(相对原子质量: Cu —64;O — 16)CuO + H2 H2O + Cu方法三解:设原混合物中氧化铜的质量为xx80 64 以下略……△2=0.92g-0.752g=0.168g△1=80-64=16【拓展提升6】氧化铜(CuO)能被(H2)还原,化学方程式为:CuO+H2 Cu+ H2O,今有氧化铜与金属铜的混合物0.92克,被H2完全还原后,得到0.752克固体剩余物,求①原混合物中氧化铜的质量分数;②原混合物中铜元素的质量分数。(相对原子质量: Cu —64;O — 16)【拓展提升7】在KClO3与MnO2组成混合物中,MnO2的质量分数为20%,加热一段时间后,MnO2质量分数提高到25%,求氯酸钾的分解百分率?(即参加反应的氯酸钾占原氯酸钾的质量分数。)答:氯酸钾的分解百分率为63.8%。【解】设MnO2的质量为a,则反应前混合物的质量为a÷20%=5a,则其中KClO3的质量为5a-a=4a,反应后混合物的质量为a÷25%=4a,因此放出O2的质量为5a-4a=a。设分解的KClO3的质量为xMnO22KClO3 2KCl+3O2↑245????? ?? 96
x???????? a氯酸钾的分解百分率=谢谢21世纪教育网(www.21cnjy.com) 中小学教育资源网站 有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
复习课人教版 九年级上这是《初中化学课堂教学优化设计的实践探索》(人教版“初中化学教案” )一书的配套课件,这本书的形成历时十余年,是作者多年教学实践的积累,以“把每一节课当作礼物送给学生”作为设计追求!
购书可与作者联系,QQ:871003695;手机/微信:13990810599。
书到付款。
一、质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质质量总和。
理解时要注意三点:
①“参加”意味着反应物中过量的剩余部分的质量不应算在内。如蜡烛燃烧剩余的石蜡不算在内;又如在2H2 + O2 2H2O中,参加反应的H2 、O2与生成的H2O的质量比为4:32:36,如果H2 的质量是5份,O2的质量是32份,生成的H2O的质量是37份,还是36份?为什么?
②“总和”意味着把各种状态的反应物和生成物都算在内。如肉眼看不见的气体也应考虑。
③ 质量守恒定律仅适用化学变化。点燃化学反应质量守恒的原因在化学反应前后,原子的种类、数目、质量均未改变。3.化学反应中的“六个不变”、“两个一定变”、“一个可能变”
“六个不变”宏观: 微观: 反应物和生成物的总质量不变元素的种类不变同种元素质量不变原子的种类不变“两个一定变” 宏观:物质的种类一定变(生成了新的物质)微观:分子的种类一定变(生成了新的分子)“一个可能变”:原子的数目不变原子的质量不变分子的总数目可能变。2H2+O2 2H2O H2+Cl2 2HCl【例1】判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)根据质量守恒定律,1L氢气和1L氧气反应生成2L水。( )
(2)10 g水蒸发变成10 g水蒸气符合质量守恒定律。( )
(3).蜡烛完全燃烧后,蜡烛没有了,这违背了质量守恒定律。( )
(4)只有固体、液体间反应遵守质量守恒定律,如果有气体参加反应,就不遵守质量守恒定律。( )
(5)燃烧的镁条和生成的氧化镁质量相等。( )
(6)水在催化剂的作用下可变成燃油(主要含C、H)。( )
××××××【练习1】镁带在耐高温的密闭容器中(内含空气)燃烧,能正确表示容器里所盛物质总质量变化的图象是( )B【例2】氢气在氧气中燃烧,下列说法符合质量守恒定律的是( )
A.2克H2和7克O2反应生成9克H2O
B.1克H2和8克O2反应生成9克H2O
C.4克H2和5克O2反应生成9克H2O
D.5克H2和4克O2反应生成9克H2OB2H2+ O2 2H2O点燃4 : 32 : 361 : 8 : 9【练习3】a克过氧化氢溶液和b克二氧化锰混合, 待完全反应后得c克残余物, 则生成氧气的质量为( )
(a-c)克 B. (a + b-c)克
C. (a-b + c)克 D.(a-b-c)克
【练习2】根据2 CH3OH+3X+4NaOH=2Na2CO3+6H20,推求X的化学式为( )
A.O2 B.CO C.CO2 D.H2
AB【练习4】在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为_____。
解析:3×32+4×y=2×102y=27设Y的相对分子质量为y,根据质量守恒定律27【例3】(1)某物质在空气中完全燃烧生成CO2和H2O,该物质 碳元素, 氢元素, 氧元素。(选填“含有”、“不含有”、“可能含有”)。
(2)4.6g某物质在空气中完全燃烧生成8.8g CO2和5.4gH2O,通过计算,该物质 碳元素, 氢元素, ____氧元素。(以上三空选填“含有”、“不含有”、“可能含有”)。其中碳元素 g,氢元素 g,氧元素 g。含有含有可能含有含有含有含有8.8g CO2含碳元素的质量为:5.4gH2O含氢元素的质量为:该物质含碳、氢元素的质量和为: 2.4g+0.6g=3g所以该物质还含氧元素,其质量为: 4.6g-3g=1.6g1.60.6 2.4【例4】在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )
A.该反应是化合反应
B.甲可能是该反应的催化剂
C.反应后甲的质量为0
D.乙、丙变化的质量比为9:8BD【例5】小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫酸( H2SO4 )在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:
(1)提出假设:物质发生化学变化后,总质量______(填“变”或“不变”)。
(2)设计实验方案:按你的假设小明设计了如图装置的实验,实验进行时把气球中的铁粉倒入稀硫酸中, 此反应的化学方程式为: 。反应后, 你认为天平最终能平衡吗?说出你的理由. 不变Fe + H2SO4 = FeSO4 + H2↑反应后, 天平最终不能平衡,因为生成了氢气,气球不会变瘪,气球在空气中会受到向上的浮力。二、化学方程式
1.定义:用化学式表示化学反应的式子
2.意义:
①表示反应物、生成物以及反应条件。②表示反应物、生成物之间的质量关系(即质量比)③表示反应物、生成物之间的粒子数关系(粒子个数比)例如:2H2 + O2 2H2O的意义
质的方面:表示在点燃条件下,氢气和氧气反应生成水。
量的方面:表示每4份质量的氢气和32份质量的氧气反应生成36份质量的水。
粒子方面:每2个氢分子和一个氧分子反应生成2个水分子。
点燃【练习5】化学方程式2H2+O2 2H2O的正确意义是( )
A.氢原子和氧原子在点燃条件下生成水分子
B.2份质量的氢气和1份质量的氧气在点燃条件下生成2份质量的水
C.氢气在氧气中燃烧生成水
D.氢元素和氧元素在点燃条件下生成水元素
点燃C3.化学方程式的书写
(1)原则
①必须以客观事实为基础,不能凭空臆想,臆造事实上不存在的物质和化学反应。
②遵守质量守恒定律,等号的两边各原子的种类与数目必须相等。
(2)书写步骤与方法
左边反应物,右边生成物;写准化学式,记住配系数;
中间连等号,条件要标注;生成气体或沉淀,要用箭号来体现。
注意:
①反应物无气体,而生成物有气体的,需要在生成物气体物质的化学式右边标“↑”。 ②在溶液中的反应,如果反应物没有固体,生成物有固体,需要在生成物固体物质的化学式右边标“↓”。 ③配平化学方程式时不能改动化学式右下角的数字。
【例6】配平下列化学方程式
(1)C3H8 + O2→ CO2+ H20
(2)C2H2 + O2→ CO2+ H20
(3)Fe2O3+ CO→ Fe+ CO2
三、有关化学方程式的计算
1.计算依据
①质量守恒定律:反应物质量总和等于生成物质量总和;
②方程式中各物质的质量之比等于它们的相对分子质量与化学计量数乘积之比
2.计算步骤:“设、方、关、比、算、答”
【例7】已知化学反应:2A + B = 2C + D,当10g A和8g B恰好完全反应后,生成6g C。如果要得到3g D,则参加反应的B物质的质量是( )
A.1g B.2g C.3g D.4g
【练习6】已知在反应3A+2B=2C+D中,反应物A、B的质量比为3:4。当反应生成C和D的质量共140g时,B消耗的质量为____ g。
B80【例8】让4g 氢气和16g 氧气充分反应后,生成水的质量为( )
A.12g B.16g C.18g D.20g 2H2+O2 2H2O点燃4 : 32 : 36解析:参加反应的氢气和氧气的质量比为4:324g 氢气要完全燃烧需要32g氧气,而氧气只有16g,故4g 氢气只有2g参加反应,故生成水的质量应为:2g+16g=18gC【例9】 如下图氯酸钾制氧气时,反应中二氧化锰在混合物中质量分数随时间变化的图象正确的是( )A【例10】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g,求:(1)、制取氧气的质量; ⑵剩余固体中含有哪些物质?各为多少克?分析 :MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以放出O2的质量为26.5g-16.9g=9.6g, 这9.6g是解本题的关键.
答:制得氧气的质量为9.6g,剩余固体中有KCl和MnO2 ,质量分别为14.9g和2g。MnO2解 :根据质量守恒定律 m(O2) = 26.5g-16.9g=9.6g设生成KCl的质量为x2KClO3 2KCl+3O2↑ 96x=14.9gMnO2的质量 为:16.9g – 14.9g = 2g x 9.6g【例10】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g,求:(1)制取氧气的质量; ⑵剩余固体中含有哪些物质?各为多少克? 答:制得氧气的质量为9.6g,剩余固体中有KCl和MnO2 ,质量分别为14.9g和2g。MnO2解 :设MnO2的质量为x,制得氧气的质量为y。2KClO3 2KCl + 3O2↑245 149 96x=2g氯化钾的质量 为:16.9g- 2g = 14.9g 26.5g- x 16. 9g-x yy=9.6g【例10】有氯酸钾和二氧化锰的混合物共26.5g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g,求:(1)制取氧气的质量; ⑵剩余固体中含有哪些物质?各为多少克??【拓展提升1】有质量相等的两份氯酸钾,只向其中一份加入少量二氧化锰,同时放在两只试管内加热。下列有关放出氧的质量(g)与反应时间(t)的关系图象(图中a是纯氯酸钾的曲线,b是混有二氧化锰的曲线)中正确的是( )?ABCDc【拓展提升2】将A、B、C三种物质各10克,加热进行化合反应生在成D ,其中B是催化剂,当A完全反应后,生成D 16克,则反应后混合物中B与C的质量比是( )
A .5∶1 B. 5∶2
C.5∶3 D. 4∶1
B【拓展提升3】现有A、B、C三种物质各15克,充分反应后生成 D物质30克,此时C 已完全反应,若再加入10克C,A恰好完全反应,则参加反应的A与B的质量比( )
A.3∶2 B .2∶3
C.1∶1 D .3∶5
A【拓展提升4】在反应X+2Y=R+2M中,已知R和M的相对分子质量比为22∶9,当1.6gX与Y完全反应后,生成 4.4克R,则在反应中Y和M的质量比 。X + 2Y = R + 2M1.6g4.4g22 : 18?=3.6g?ˊY和M的质量比为6.4g :3.6g=16:9=6.4g16:9【拓展提升5】取一定量的高锰酸钾放入大试管中,充分加热直到不再产生气体为止。试求剩余固体中二氧化锰的质量分数。【解】设:高锰酸钾的质量为x,生成氧气的质量为y,生成二氧化锰的质量为z。2KMnO4 K2MnO4 + MnO2 + O2↑316 87 32x y z剩余固体中二氧化锰的质量分数为:答:剩余固体中二氧化锰的质量分数为30.6%。【拓展提升6】氧化铜(CuO)能被(H2)还原,化学方程式为:CuO+H2 Cu+ H2O,今有氧化铜与金属铜的混合物0.92克,被H2完全还原后,得到0.752克固体剩余物,求①原混合物中氧化铜的质量分数;②原混合物中铜元素的质量分数。(相对原子质量: Cu —64;O — 16)解:CuO中氧元素的质量为:0.92g-0.752g=0.168g原混合物中CuO的质量为:原混合物中CuO的质量分数为:原混合物中铜元素的质量为:原混合物中铜元素的质量分数为:答:原混合物中氧化铜的质量分数为91.3%;原混合物中铜元素的质量分数为81.74%。CuO + H2 Cu + H2O方法二解:设原混合物中单质铜的质量为x。0.92g-x0.752g-x80 64原混合物中氧化铜的质量为:0.92g-0.08g=0.84g以下略……【拓展提升6】氧化铜(CuO)能被(H2)还原,化学方程式为:CuO+H2 Cu+ H2O,今有氧化铜与金属铜的混合物0.92克,被H2完全还原后,得到0.752克固体剩余物,求①原混合物中氧化铜的质量分数;②原混合物中铜元素的质量分数。(相对原子质量: Cu —64;O — 16)CuO + H2 H2O + Cu方法三解:设原混合物中氧化铜的质量为xx80 64 以下略……△2=0.92g-0.752g=0.168g△1=80-64=16【拓展提升6】氧化铜(CuO)能被(H2)还原,化学方程式为:CuO+H2 Cu+ H2O,今有氧化铜与金属铜的混合物0.92克,被H2完全还原后,得到0.752克固体剩余物,求①原混合物中氧化铜的质量分数;②原混合物中铜元素的质量分数。(相对原子质量: Cu —64;O — 16)【拓展提升7】在KClO3与MnO2组成混合物中,MnO2的质量分数为20%,加热一段时间后,MnO2质量分数提高到25%,求氯酸钾的分解百分率?(即参加反应的氯酸钾占原氯酸钾的质量分数。)答:氯酸钾的分解百分率为63.8%。【解】设MnO2的质量为a,则反应前混合物的质量为a÷20%=5a,则其中KClO3的质量为5a-a=4a,反应后混合物的质量为a÷25%=4a,因此放出O2的质量为5a-4a=a。设分解的KClO3的质量为xMnO22KClO3 2KCl+3O2↑245????? ?? 96
x???????? a氯酸钾的分解百分率=谢谢21世纪教育网(www.21cnjy.com) 中小学教育资源网站 有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
